2024年中考化學模擬卷






(本試卷共14道題 滿分50分 化學和物理考試時間共150分鐘)
可能用到的近似相對原子質量:H — 1 C — 12 O — 16 Al — 27
第一部分 選擇題(共10分)
(本部分共包括10道小題,每小題1分。下列每小題只有一個最符合題目要求的選項)
1. 《天工開物》是我國古代科技發展的智慧結晶,書中記載的下列過程涉及化學變化的是( )。
A. 機杼織布 B. 楠木制舟
C. 五谷釀酒 D. 海水曬鹽
2. 材料是人類賴以生存和發展的重要物質。下列物質屬于合成材料的是( )。
A. 棉花 B. 羊毛
C. 塑料 D. 蠶絲
3. 化學是一門以實驗為基礎的科學。下列實驗操作正確的是( )。
A. 取固體粉末 B. 稀釋濃硫酸 C. 加熱液體 D. 滴加液體
4. 學習化學要通過實驗探究物質變化的本質。下列實驗現象描述錯誤的是( )。
A. 打開濃鹽酸的瓶蓋,瓶口出現白霧
B. 將硝酸銨溶于水,溶液的溫度降低
C. 硫在氧氣中燃燒,發出藍紫色火焰
D. 氫氧化鈉溶液中通入CO2會變渾濁
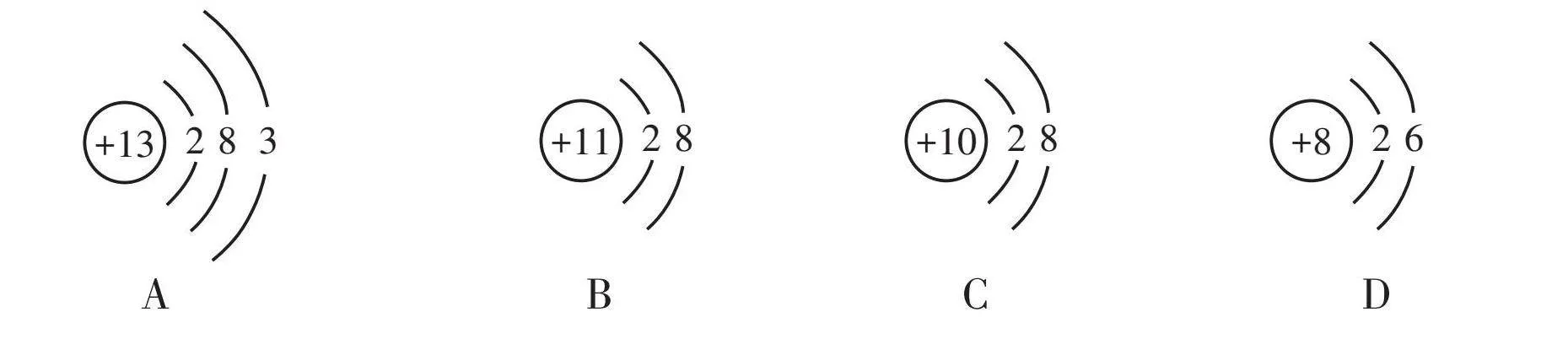
5. 原子結構示意圖形象揭示了原子核外電子的運動情況。下列結構示意圖表示陽離子的是( )。
[+13] [2][8][3] [+11] [2][8] [+10] [2][8] [+8] [2][6]
A B C D
6. 冬奧會中冰壺機器人的電池選用質量輕、能提供足夠能量的鋰電池。鋰元素在元素周期表中的信息如圖1。下列有關鋰元素的說法錯誤的是( )。
A. 原子序數是3
B. 元素符號是Li
C. 屬于金屬元素
D. 相對原子質量為6.941 g
7. 下圖所示的四支蠟燭都將熄滅,從燃燒條件分析,原因與另外三支蠟燭不同的是( )。
A B C D
8. 桂花清甜濃郁,其花香的主要成分之一是芳樟醇(C10H18O)。下列關于芳樟醇的說法正確的是( )。
A. 芳樟醇屬于氧化物
B. 芳樟醇由29個原子構成
C. 芳樟醇中氧元素的質量分數最小
D. 芳樟醇中碳、氫元素的質量比為5∶9
9. 對于化學方程式2Al2O3 [ 通電 ] 4Al + 3O2↑,從中不能獲得的信息是( )。
A. 該反應為分解反應
B. 該反應的反應速率
C. 反應前后鋁元素的化合價發生了變化
D. 該反應中氧化鋁和氧氣質量比為51∶24
10. 下列實驗方法能達到實驗目的的是( )。第二部分 非選擇題(共40分)(本部分包括4道小題)
11. (7分)請閱讀下面科普短文。
氫能作為一種儲量豐富、來源廣泛、熱值高的清潔能源,是未來的主要能源。制氫、儲氫和用氫是目前重點關注的問題。
I. 制氫:目前制氫方法主要有化石能源制氫和電解水制氫。由化石能源(煤、天然氣)制得的H2中含有CO,利用液氮的低溫可將CO液化分離,從而獲得純凈的氫氣。電解水法制氫的能量轉化如圖2所示。
II. 儲氫:氫氣儲存方式主要有金屬氫化物儲氫、低溫液化儲氫、高壓壓縮儲氫、碳基材料儲氫等。金屬氫化物儲氫是把氫以氫化物的形式儲存在金屬或合金中,這種方法比液化儲氫和高壓儲氫安全,并且有很高的儲存容量。我國科學家研究的一種儲氫、釋氫材料為氫化鋁(AlH3),其中釋放氫能的原理是利用氫化鋁與水發生反應生成氫氧化鋁沉淀和氫氣。
III. 用氫:目前液氫已應用于航天領域作燃料,氫氧燃料電池用作汽車的驅動電源等。通過P2G技術(工作原理如圖3所示)還可實現綜合能源系統中電(尤其是將廉價盈余的電)到氣的能量轉換。
隨著科技的發展,氫氣終將成為主要能源之一。
[電能] [熱能][CH4][甲烷化] [電解水] [電解槽][甲烷反應器] [O2][H2][H2O][CO2][圖3]
結合短文,請回答下列問題。
(1)氫能具有的優點是 (填一點即可)。
(2)文中所述利用液氮將H2與CO分離的方法,說明氫氣的沸點比CO的沸點 。
(3)碳納米管是一種納米級材料,其結構為由碳原子呈六邊形排列的同軸圓管,可用作碳基儲氫材料。碳納米管屬于 (填“單質”或“化合物”)。
(4)從分子的角度解釋低溫、高壓儲氫的原理 。
(5)寫出氫化鋁(AlH3)與水反應的化學方程式 。
(6)H2可通過燃燒提供能量,反應的化學方程式為 。
(7)P2G設備中甲烷反應器里發生反應的化學方程式為[4H2] + [CO2] [ 催化劑 高溫] [CH4+2H2O],若有原料1600萬噸氫氣,理論上約能生成CH4的質量是 萬噸。
12. (14分)實驗探究是學習化學的重要方法,請你參與下列探究活動。
【探究一】實驗室制取氣體。
(1)圖4中儀器①的名稱是 。
(2)實驗室用圖4中A裝置制取氧氣,化學方程式為 。欲收集一瓶較純凈的氧氣,可從圖4中選擇的收集裝置是 (填字母序號)。
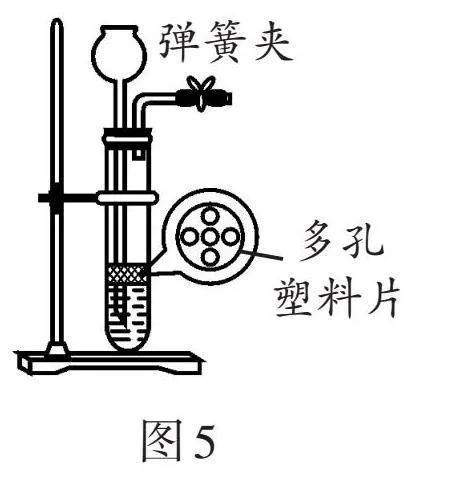
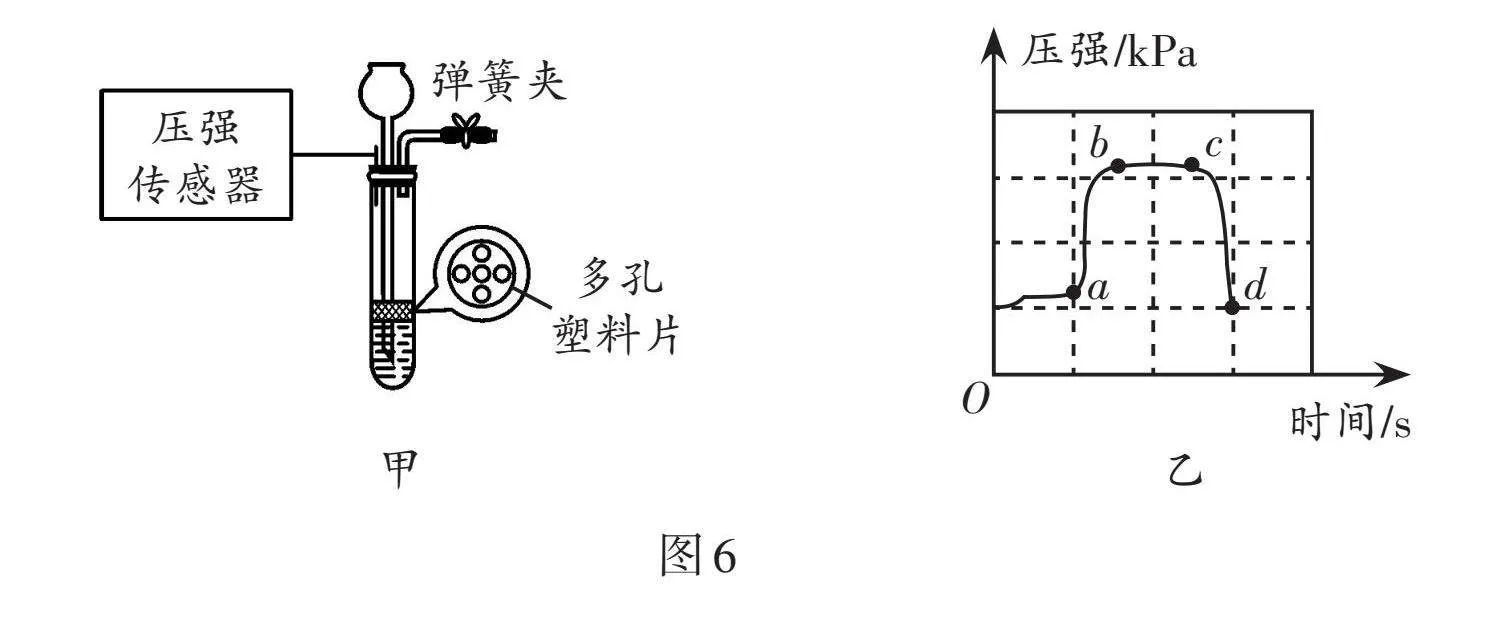
(3)圖5裝置是小組同學組裝的實驗室制取二氧化碳氣體的發生裝置,該裝置的優點是 。在圖5裝置中連接壓強傳感器(如圖6甲),從而測定實驗中試管內氣體壓強變化的情況(如圖6乙)。下列說法合理的是
(填字母序號)。
A. ab段試管中液面逐漸上升
B. bc段石灰石與稀鹽酸脫離接觸
C. c點的對應操作是打開彈簧夾
【探究二】探究人體呼出氣體的組成變化。
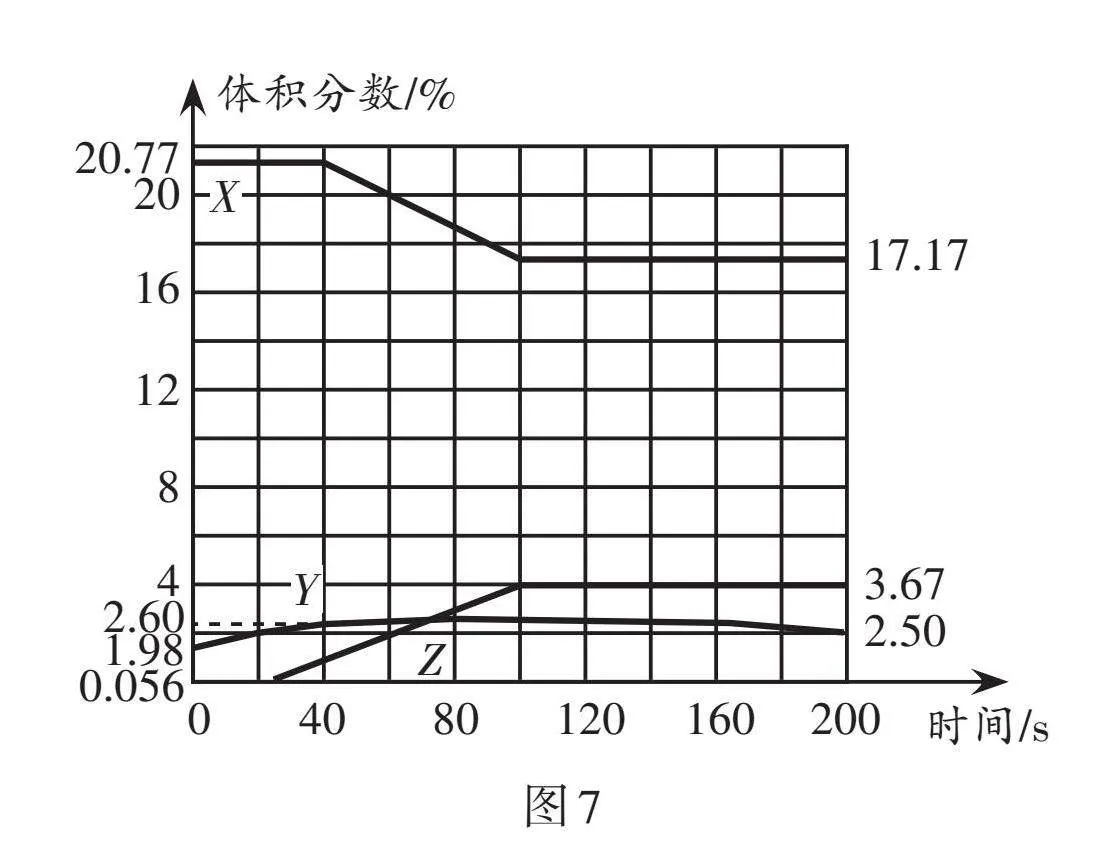
分別把可以測試氧氣、二氧化碳、水蒸氣的體積的探頭放入開口的保鮮袋中,采集數據后向袋內呼出氣體。采集的數據經處理后,如圖7所示。根據實驗操作及記錄回答相關問題。
(1)圖7中表示氧氣體積分數變化的曲線是 (填“X”“Y”或“Z”)。Y的體積分數在60 s之后逐漸減小的原因是 。
(2)該實驗中,200 s時沒有被采集數據的其他所有氣體的總體積分數為 。
(3)分析圖7數據,比較呼出氣體與吸入的空氣,其組成上的變化是
。
【探究三】探究稀鹽酸與氫氧化鈉溶液的反應。
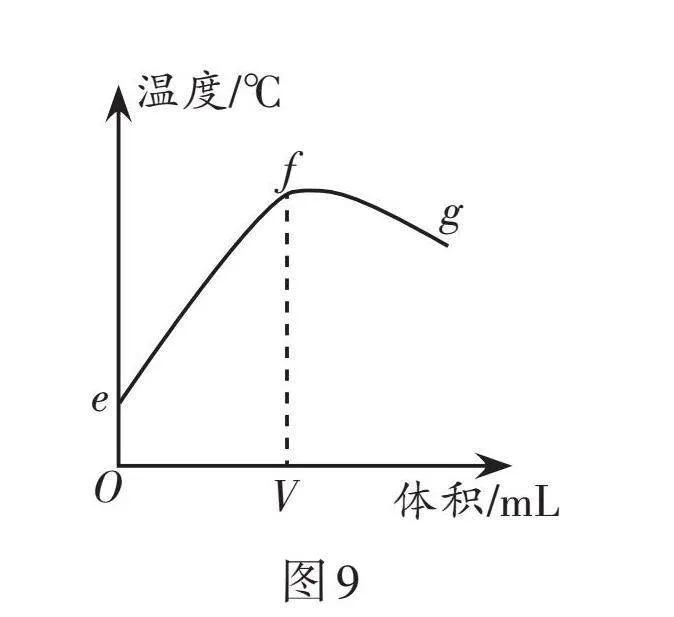
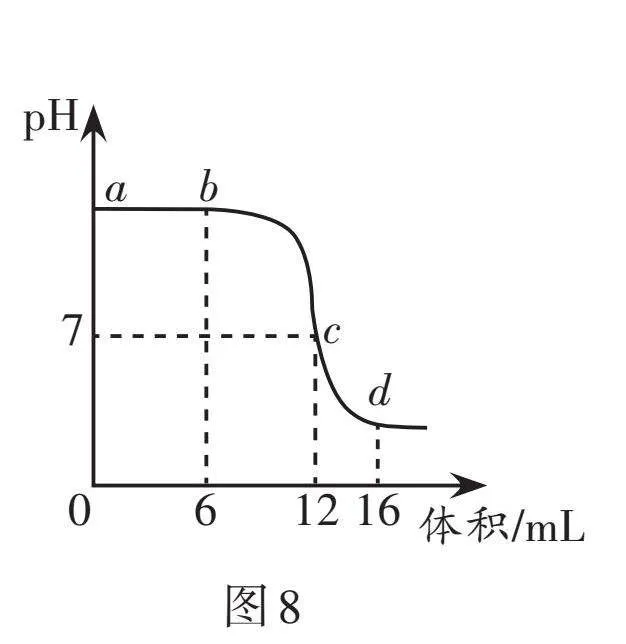
利用pH傳感器和溫度傳感器測量反應過程中相關物理量的變化情況,得到圖8和圖9。
(1)鹽酸與氫氧化鈉發生中和反應的化學方程式為 。
(2)由圖8判斷下列說法錯誤的是 (填字母序號)。
A. 該實驗是向氫氧化鈉溶液中滴加稀鹽酸
B. b點溶液中的溶質只有氯化鈉
C. c點氫氧化鈉與稀鹽酸恰好反應
D. 向d點溶液中滴加硝酸銀溶液,可證明鹽酸有剩余
(3) 從圖9分析可知該反應為 (填“放熱”或“吸熱”)反應。圖9中f → g的過程中,溶液的溫度稍有降低的原因是 。
13. (8分)人類文明進步與金屬材料的發展關系十分密切,金屬材料與我們的生活息息相關。
(1)《天工開物》中有多處關于金屬的記載。
①根據“凡黃金為五金之長,熔化成形之后,住世永無變更”,可說明黃金
(填“易”或“不易”)與空氣中的成分反應。
②“點鉛勾錫”是指在生成的錫中加入鉛,能使其在較低溫度熔化流出,原因是 。
(2)圖10所示的“七一勛章”在選擇鑄造材料時,不需要考慮的因素是 (填字母序號)。
A. 金屬的硬度
B. 金屬的價格
C. 金屬的導電性
D. 金屬的耐腐蝕性
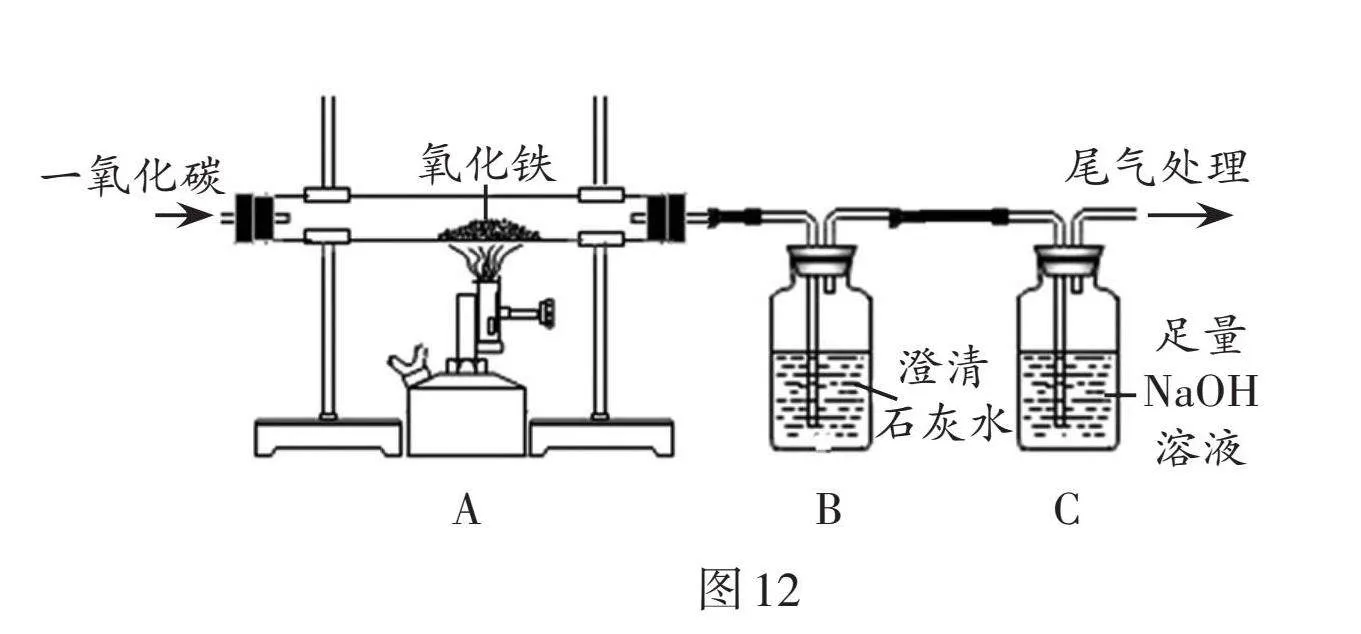
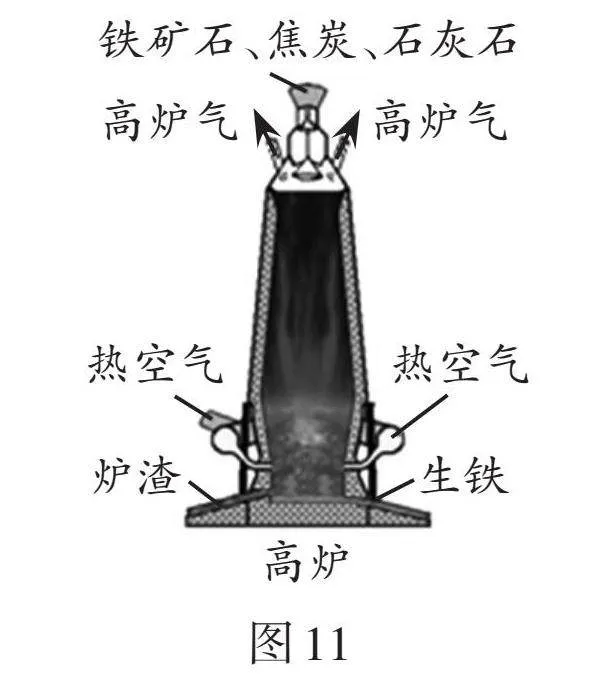
(3)學校組織九年級同學參觀了某鋼鐵廠,大家進一步認識了煉鐵的工藝流程。結合圖11、圖12回答有關問題。
①圖11中涉及的物質,屬于金屬材料的是 。
A. 鐵礦石 B. 焦炭
C. 石灰石 D. 生鐵
②以赤鐵礦石為原料在高溫下與一氧化碳反應的化學方程式是
。
③如圖12,請設計實驗方案,驗證實驗后A裝置中有鐵生成:
(簡要寫出實驗方法和現象)。
(4)我國的鋼鐵年產量很高,但因銹蝕造成的損失也很驚人,請寫出一條防止鐵制品生銹的具體方法: 。
14. (11分)同學們在生物課上學習了影響農作物生長的因素,查閱資料得知,在鹽堿地里農作物生長不好,甚至會寸草不生。他們對此產生了濃厚的興趣,積極查找相關資料,展開項目式探究。
任務一:探尋鹽堿地的成因。
【查閱資料】
①我國的鹽堿地主要分布在東北、華北、西北內陸地區以及長江以北沿海地帶。
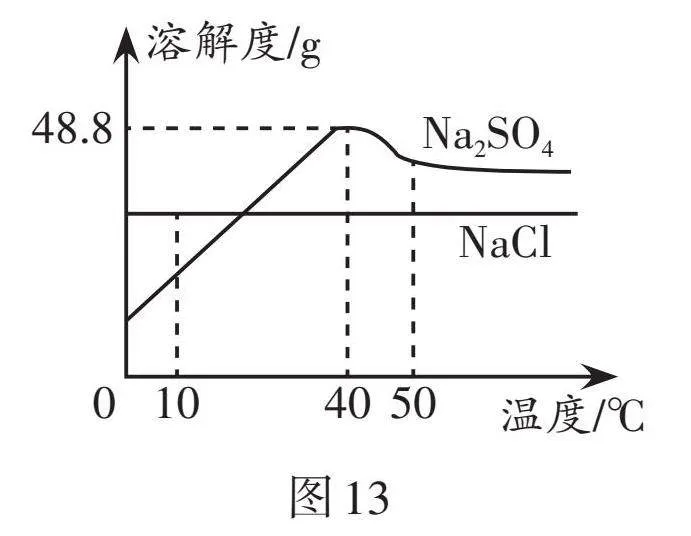
②鹽堿土形成的根本原因在于水分狀況不良,各種易溶性鹽類在該地區的土壤表層逐漸積聚,鹽堿土含有過量的鹽分,主要是氯化鈉和硫酸鈉,其溶解度曲線如圖13所示。
③植物細胞在鹽堿土壤很難吸收到水分,影響作物生長。
④鹽堿地的成因是:有些地區春季地表水分蒸發強烈,地下水中的氯化鈉析出聚集表層,即“返鹽”季節;有些地區到了秋季,土壤中會析出芒硝(主要成分是硫酸鈉晶體),人們將上述現象俗稱為“春泛鹽,秋泛硝”。
【小組討論】
(1)由圖13可知,50 ℃時,兩者中溶解度較大的物質是 。
(2)40 ℃時,將25 gNa2SO4固體放入50 g水中, 充分溶解后可得到Na2SO4的
(選填“飽和”或“不飽和”)溶液。
(3)結合圖13中的溶解度曲線,試解釋“秋泛硝”的原理
。
任務二:了解鹽堿地的改良方法。
【查閱資料】
①鹽堿地也是一種珍貴的土地資源,改良鹽堿地的方法一般有水利改良法、農業改良法、化學改良法。其中化學改良法一般用石膏,研究發現,用深翻與石膏相配合并采用水稻與小麥輪作制度,效果更好。
②通過持續治理改造,我國鹽堿地呈現面積總量減少、重度鹽堿地面積比例逐年降低的趨勢。
【小組討論】
(1)水利改良法是通過灌水沖洗、引洪放淤、不斷淋洗,該過程發生的是
(填“物理”或“化學”)變化。
(2)鹽堿地加入石膏后,土壤的pH會變 (填“變大”“變小”或“不變”)。
(3)施用有機肥料(能產生有機酸)和某些高效復合肥也可改良鹽堿地。請你寫出一種復合肥的化學式 。
任務三:分離提純硫酸鈉。
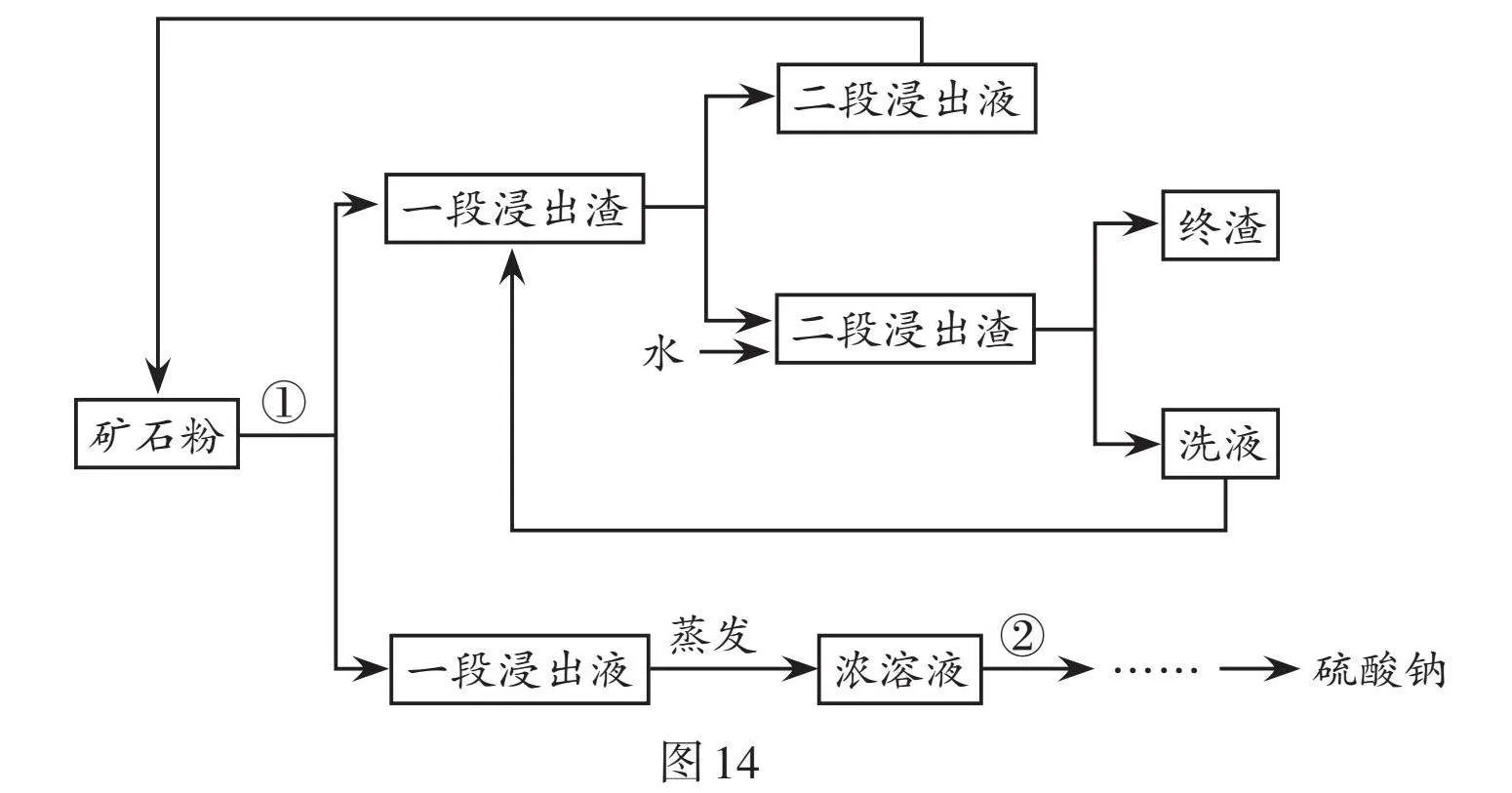
芒硝(主要成分是硫酸鈉晶體)用途廣泛,可從鈣芒硝礦(主要成分有硫酸鈉和硫酸鈣)提取,生產硫酸鈉的工藝流程如圖14所示。
結合圖13和圖14回答下列問題。
(1)流程圖中①處用到的分離方法是 。
(2)提取過程中礦石粉共經過 次浸出,可有效增大“一段浸出液”的濃度,其目的是提高產率和 。
(3)圖14中②處濃溶液的溫度約為 時,開始降溫結晶,較為合適。

