例析高考中氧化還原反應常見題型

氧化還原反應是高中化學十分重要的一類問題,它涉及化學反應的本質,是理解許多化學反應的關鍵.在高考中,氧化還原反應的考查形式多種多樣,選擇題、實驗題和解答題中,都會出現它的身影.
1 氧化還原反應的判斷
高考中氧化還原反應的判斷不僅是對學生基礎知識的檢驗,更是對他們邏輯思維能力和分析能力的考查.通過掌握判斷氧化還原反應的關鍵要素———電子的得失或共用電子對的偏移,以及靈活運用各種輔助判斷方法,如觀察反應前后元素化合價的變化等,學生可以更加準確地識別氧化還原反應.
例1 (2023年全國乙卷)下列應用中涉及氧化還原反應的是( ).
A.使用明礬對水進行凈化
B.雪天道路上撒鹽融雪
C.暖貼中的鐵粉遇空氣放熱
D.熒光指示牌被照發光
解析
使用明礬凈化水,其核心機制在于明礬能夠發生水解反應,反應方程式為Al3+ +3H2O?Al(OH)3(膠體)+3H+ ,Al(OH)3膠體具有強大的吸附能力,但此過程無化合價變化,非氧化還原反應,選項A 錯誤.雪天在道路上撒鹽是利用雪遇到鹽時會降低其熔點的特性,從而使雪更容易融化,在整個過程中,元素化合價未變,非氧化還原反應,選項B錯誤.在暖貼中,鐵粉、碳粉及氯化鈉等成分接觸空氣后,會形成大量微小原電池,該過程中鐵和氧反應過程中化合價會發生改變,為氧化還原反應,選項C正確.熒光指示牌被照發光是因為光的反射,并未發生反應,選項D錯誤.答案為C.
點評
氧化還原反應是化學反應中的一類重要反應,其中氧化反應和還原反應是緊密相連、相互依存的,它們共同構成了氧化還原反應的整體.在識別氧化還原反應時,我們需要注意一些特殊的反應類型,例如歧化反應.此外,還需要關注元素存在形態的變化,在化學反應中,元素由化合態變為游離態,元素化合價可能升高,也可能降低.理解氧化性和還原性的關系對于掌握氧化還原反應至關重要,強氧化劑容易得到電子,強還原劑容易失去電子,這種關系能幫助我們預測和解釋氧化還原反應中的電子轉移情況.
例2 (2023年浙江卷)關于反應2NH2OH+4Fe3+ =N2O↑+4Fe2+ +4H+ +H2O,下列說法正確的是( ).
A.生成1molN2O,轉移4mol電子
B.NH2OH 是還原產物
C.NH2OH 既是氧化劑又是還原劑
D.若設計為原電池,Fe2+ 為負極產物
解析
可以將已知反應拆分成如下反應:2NH2OH-4e- →N2O+4H+ +H2O,4Fe3+ +4e- →4Fe2+ ,則生成1 molN2O,轉移4 mol電子,選項A 正確.NH2OH 中N 元素化合價升高,被氧化,所以NH2OH 是還原劑,選項B、C 錯誤.若建構一個原電池,那么正極通常是得到電子的一極,Fe3+ 為氧化劑,得到電子生成Fe2+ ,故Fe2+ 為正極產物,選項D 錯誤.答案為A.
點評
通過電子的得失或共用電子對的偏移,氧化還原反應實現了化學物質的相互轉化,這種轉化不僅改變了物質的化學性質,也常常伴隨著能量的變化.同時,化合價的升降是氧化還原反應的外在表現,它直觀地反映了元素在反應中的氧化或還原狀態.因此,深入理解電子轉移和化合價升降這兩個基本性質,對于掌握氧化還原反應的本質和規律,以及應用氧化還原反應解決實際問題都具有重要的指導意義.
2 化學式的書寫
在高考化學中,氧化還原反應是考查學生化學知識運用能力的重點內容之一,而正確書寫氧化還原反應中的化學式則是解題的關鍵.這些化學式不僅反映了反應物與生成物之間的關系,更揭示了氧化還原反應中電子的轉移和化合價的變化.
例3 (2023年遼寧卷,節選)硫酸工業在國民經濟中占有重要地位.
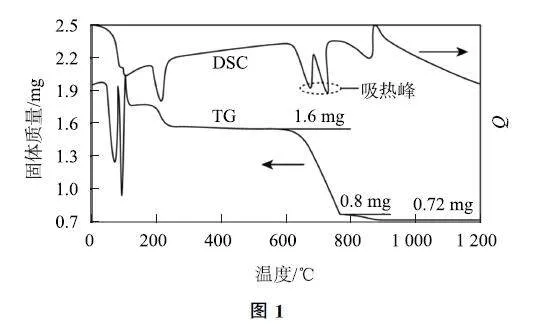
我國古籍記載了硫酸的制備方法———“煉石膽(CuSO4·5H2O)取精華法”.借助現代儀器分析,該制備過程中CuSO4·5H2O 分解的TG 曲線(熱重)及DSC曲線(反映體系熱量變化情況,數值已省略)如圖1所示.700 ℃左右有2個吸熱峰,則此時分解生成的氧化物有SO2、______和______(填化學式).
解析
圖示曲線顯示,700℃左右出現兩個吸熱峰,說明此時CuSO4 發生熱分解反應,從TG 圖像可知,質量減半表明有CuO 剩余,且伴隨其他氣體生成,此時氣體產物為SO2、SO3、O2,可能出現的化學方程式為3CuSO4=700℃=3CuO +2SO2 ↑ +SO3↑+O2↑,結合反應中固體產物和氣體產物的質量可以確定,該反應的產物為CuO、SO2、SO3、O2.
答案 CuO,SO3.
點評
熟練掌握氧化還原反應中化學式的書寫方法和技巧,對于學生在高考中取得優異成績至關重要.這不僅要求學生深刻理解氧化還原反應的基本原理,還要能夠靈活運用化學式書寫規則,準確表達反應過程中的物質轉化和電子轉移情況.
3 氧化還原反應的計算
在高考化學中,有關氧化還原反應的計算是檢驗學生綜合運用知識的能力、邏輯思維能力和計算能力的重要環節.這類計算不僅涉及反應方程式的配平、化學計量關系的確定,還涵蓋了氧化還原反應中電子轉移數目、化合價變化等核心概念的運用.
例4 (2022年湖南卷)科學家發現某些生物酶體系可以促進H+ 和e- 的轉移(如a、b 和c),能將海洋中的NO- 2 轉化為N2 進入大氣層,反應過程如圖2所示.下列說法正確的是( ).
A.過程Ⅰ中NO- 2 發生氧化反應
B.a 和b 中轉移的e- 數目相等
C.過程Ⅱ中參與反應的n(NO)∶n(NH4+)=1∶4
D.過程Ⅰ→Ⅲ的總反應為NO2-+NH4+=N2↑+2H2O
解析
應過程可知,過程Ⅰ 中NO- 2 轉化為NO,N 元素化合價由+3降為+2,則NO- 2發生還原反應,選項A 錯誤.在酶1的作用下,NO- 2轉化為NO 和H2O,遵循化學反應的原則,即得失電子守恒、電荷守恒以及原子守恒,離子反應方程式為、電荷守恒以及原子守恒,離子反應方程式為NO- 2 +2H+ +e- =酶= 1NO+H2O,生成1molNO 時,a 過程中轉移的電子數目為1,過程Ⅱ中,NO和 NH4+ 在酶2的作用下,生成 H2O 和N2H4,根據守恒原則,該反應的離子方程式為NO+NH4++3e-+2H+ =酶=2H2O+N2H4,在這個過程中消耗1molNO 時,轉移的電子數目為3.綜上分析,兩個過程中轉移電子數并不相等,選項B錯誤.由以上分析可知,過程Ⅱ中參與反應的n(NO)∶n(NH4+)=1∶1,選項C錯誤.過程Ⅲ的離子方程式為N2H4=酶=3N2+4H+ +4e- ,過程Ⅰ→Ⅲ的總反應為NO2-+NH4+=N2↑+2H2O,選項D正確.答案為D.
點評
在解答有關氧化還原反應的計算時,要求學生不僅要有扎實的化學理論基礎,還要能夠靈活運用數學計算技巧,準確處理氧化還原反應中的數量關系.
在解答氧化還原反應類試題時,熟練掌握相關定義,正確判斷各物質的性質是解題基礎,準確寫出相應的化學反應式是解題的關鍵.因此,在日常學習中,學生要積極總結,不斷提升自身的解題效率.
(完)

