銅及其化合物高考考點剖析
隨著教育改革的不斷推進,高考化學對于銅及其化合物的考查也在逐漸增加.因此,理解和掌握銅的相關知識對于提高學生化學成績至關重要.本文對高考中關于銅的常見考點進行深入探討,以供讀者參考.
1 銅及其化合物基礎概念
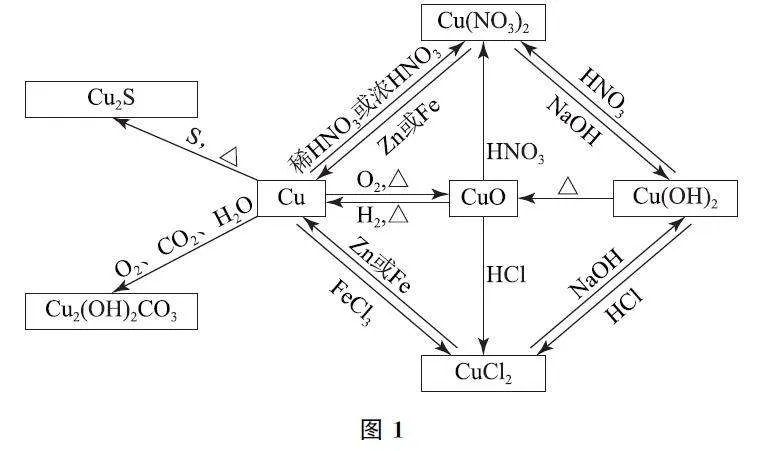
銅作為重要的金屬物質,自身及其化合物的相關性質往往會成為命題熱點,高考中所涉及的知識點廣泛且深入,小到對銅的認知,大到對銅及其化合物知識的運用.因此,學生要掌握Cu、CuO、CuSO4、CuSO4·5H2O、Cu(OH)2 等物質的物理和化學性質.例如,Cu單質為紫紅色,易溶于強氧化性酸;CuO 為黑色粉末,可溶于酸溶液;CuSO4·5H2O 為藍色晶體;Cu(OH)2為藍色固體,可溶于酸,難溶于水.除此之外,學生還要掌握在不同條件下,Cu及其化合物之間的轉化關系(如圖1所示,需要重點掌握各物質間轉化的條件).
例1 (2023年1月浙江卷)CuSO4 應用廣泛,下列說法不正確的是( ).
A.Cu元素位于元素周期表p區
B.CuSO4 屬于強電解質
C.CuSO4 溶液呈酸性
D.CuSO4 能使蛋白質變性
解析
Cu原子最外層電子排布式為3d104s1,屬于ds區,故A 錯誤.CuSO4 在溶液中能夠完全電離,屬于強電解質,故B 正確.CuSO4 為強酸弱堿鹽,Cu2+ 會發生水解反應:Cu2+ +2H2O?Cu(OH)2+2H+ ,有H+ 產生,溶液顯酸性,故C正確.Cu2+ 為重金屬離子,會使蛋白質發生變性,故D正確.
答案 A.
2 Cu與酸的反應
Cu及其化合物與酸反應等也是考查的重點.Cu不能與大部分的弱酸反應,但是可以和濃H2SO4、HNO3 等發生反應,生成相應的鹽、酸性氣體和H2O.需要注意的是,在與HNO3 的反應中,HNO3 的濃度不同會生成不同的產物.Cu 與稀HNO3 反應生成NO,而與濃HNO3 反應則生成NO2.
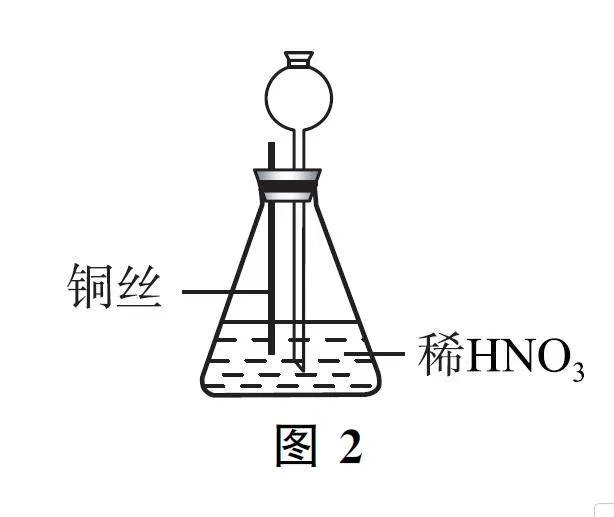
例2 (2024年湖南卷)某學生按圖2所示方法進行實驗,觀察到以下實驗現象:
① 銅絲表面緩慢放出氣泡,錐形瓶內氣體呈紅棕色;
② 銅絲表面氣泡釋放速度逐漸加快,氣體顏色逐漸變深;
③ 一段時間后氣體顏色逐漸變淺,至幾乎無色;
④ 錐形瓶中液面下降,長頸漏斗中液面上升,最終銅絲與液面脫離接觸,反應停止.
下列說法正確的是( ).
A.開始階段銅絲表面氣泡釋放速度緩慢,原因是銅絲在稀HNO3 中表面鈍化
B.錐形瓶內出現了紅棕色氣體,表明銅和稀HNO3 反應生成了NO2
C.紅棕色逐漸變淺的主要原因是3NO2+H2O=2HNO3+NO
D.銅絲與液面脫離接觸,反應停止,原因是硝酸消耗完全
解析
銅絲在稀HNO3 中不發生鈍化,二者反應生成CuNO3、NO 和H2O,NO 和O2 反應生成NO2,故錐形瓶內出現紅棕色氣體;一段時間后紅棕色逐漸變淺的主要原因是NO2 與H2O 反應生成HNO3 和NO,化學方程式為3NO2 + H2O =2HNO3+NO;反應一段時間后,氣體壓強增大,導致銅絲與液面脫離接觸.綜上分析選項C正確.
答案 C.
3 除雜問題
在一些工藝流程問題中,Cu2+ 往往會以雜質的形式出現,在加工過程中需將其除去.此時就要借助相應的反應,將Cu2+ 轉化為不溶物[如Cu(OH)2],通過過濾將其除去.在除雜過程中,還需要注意不能引入新的雜質.
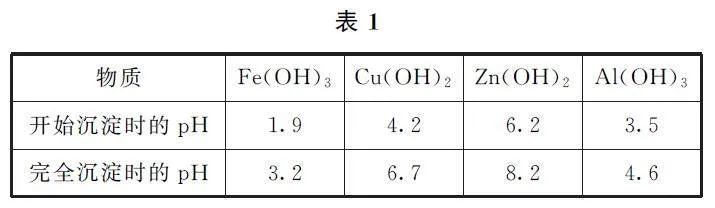
例3 (2023年湖南卷)處理某銅冶金污水(含Cu2+ 、Fe3+ 、Zn2+ 、Al3+ )的部分流程如圖3所示.
已知:① 溶液中金屬離子開始沉淀和完全沉淀的pH 如表1 所示.② Ksp (CuS)=6.4×10-36、Ksp(ZnS)=1..6×10-24.
下列說法錯誤的是( ).
A.“沉渣Ⅰ”中含有Fe(OH)3 和Al(OH)3
B.Na2S溶液呈堿性,其主要原因是S2- +H2O?HS- +OHC.“
C.“沉淀池Ⅱ”中,當Cu2+ 、Zn2+ 完全沉淀時,溶液中c(Cu2+ )/c(Zn2+ )=4.0×10-12
D.“出水”經陰離子交換樹脂軟化處理后,可用作工業冷卻循環用水
解析
分析題意可得,當pH=1.9時,Fe(OH)3 開始沉淀;pH=3.5時,Al(OH)3 開始沉淀.由圖3可知pH=4,因此會生成Fe(OH)3 和Al(OH)3,選項A 說法正確.Na2S溶液中,S2- 發生水解:S2- +H2O?HS- +OH- ,溶液呈堿性,選項B 說法正確.當Cu2+ 、Zn2+ 完全沉淀時,CuS、ZnS均達到沉淀溶解平衡,則c(Cu2+ )/c(Zn2+ )=c(Cu2+ )·c(S2- )/c(Zn2+ )·c(S2- )=Ksp(CuS)/Ksp(ZnS)=6.4×10-36/1.6×10-24=4.0×10-12,選項C說法正確.污水經處理后,溶液中仍存在大量的Cu2+ ,因此還需進一步處理,達到工業冷卻循環用水標準后,方可使用,選項D說法錯誤.
答案 D.
4 Cu及其化合物的制備
Cu及其化合物的制備在考試中時有出現,在這類試題中,不僅會考查Cu的相關化學方程式的書寫,還會涉及工藝、操作的相關問題,綜合性較強.解題過程中,一定要結合Cu及其化合物的性質,厘清每一步工藝的目的,根據題干信息快速找到解題突破點,進而解答相關問題.
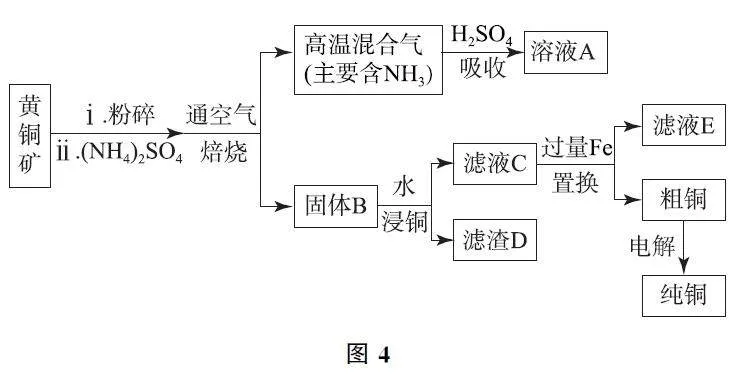
例4 (2024年北京卷,節選)利用黃銅礦(主要成分為CuFeS2,含有SiO2 等雜質)生產純銅,流程如圖4所示.
(1)礦石在焙燒前需粉碎,其作用是______.
(2)(NH4)2SO4 的作用是利用其分解產生的SO3 使礦石中的銅元素轉化為CuSO4.(NH4)2SO4發生熱分解的化學方程式是______.
解析
(1)礦石在焙燒前需粉碎,其作用是增大接觸面積,加快反應速率,使反應更充分.
(2)(NH4)2SO4 發生熱分解,生成氨氣、SO3 和水,化學方程式為(NH4)2SO4=△=2NH3↑+SO3↑+H2O.
綜上所述,銅在高考中的地位比較重要,且知識點會分布在選擇題、實驗題、工藝流程題等各種題型中,因此需要學生在日常學習中,扎實掌握Cu及其化合物的基礎性質、物質間的轉化等相關知識,同時要掌握解答相關問題的技巧與方法.以保證在實際的考試中能夠做到“以不變應萬變”,輕松應對高考中可能出現的各種復雜問題.
(完)

