基于宏基因組學的江西桃紅嶺梅花鹿潛在病原初步調查

摘 要:近些年,江西桃紅嶺梅花鹿國家級自然保護區植被正向演替明顯,大量梅花鹿(Cervus nippon)開始向保護區外圍擴散和聚集,調查桃紅嶺梅花鹿潛在病原攜帶情況,有利于掌握其種群健康狀況,進而制定精確的保護管理對策,因此在該保護區不同區域(核心區、緩沖區和實驗區)采集梅花鹿新鮮糞便樣品,并基于宏基因組測序技術分析其病原攜帶情況。結果表明:桃紅嶺梅花鹿攜帶病原微生物包括細菌、真菌、放線菌、支原體、衣原體和螺旋體,共34屬63種,其中包含大量人獸共患病病原;病原豐度最高的5個屬分別是擬梭菌屬(Clostridioides)、李斯特菌屬(Listeria)、克雷伯氏菌屬(Klebsiella)、志賀氏菌屬(Shigella)和沙門氏菌屬(Salmonella),豐度最高的5個種分別是艱難擬梭菌(Clostridioides difficile)、單核增生李斯特氏菌(Listeria mono?cytogenes)、肺炎克雷伯氏菌(Klebsiella pneumoniae)、腸炎沙門氏菌(Salmonella enter?itidis)和福氏志賀氏菌(Shigella flexneri);不同研究區域中,核心區梅花鹿攜帶病原數量顯著低于緩沖區和實驗區。以上結果表明,桃紅嶺梅花鹿攜帶有多種病原,存在一定疫病發生風險。建議在保護區核心區積極開展棲息地矮化工作,同時開展高危病原的持續性監測及預警,并加強對保護區外圍擴散梅花鹿種群的保護管理。
關鍵詞:梅花鹿;江西桃紅嶺梅花鹿國家級自然保護區;宏基因組測序;病原微生物
中圖分類號:Q933
文獻標識碼:A
文章編號:2310 - 1490(2024)- 03 - 0504 - 09
DOI:10.12375/ysdwxb.20240306
疫病是影響野生動物種群生存與發展的重要因素。我國野生動物疫病種類眾多,包含病毒、細菌和寄生蟲等諸多類群,對珍稀瀕危野生動物保護、禽畜養殖及人類健康等均構成了重大威脅[1?2]。據統計,野生動物疾病多達幾百種,其中人獸共患病有200余種[3],約占人類新發疾病的60. 3%[4]。氣候變化和人類活動是導致野生動物疫病頻發的最主要驅動因素,氣候變化改變了病原微生物、野生動物的分布區域和棲息環境,為野生動物疫病暴發和流行創造了條件,而人類活動則加大了疫病暴發和流行的風險[5?6]。由于珍稀瀕危野生動物的棲息地不斷喪失和人類活動的不斷加劇,一些疫病在人類、畜禽和野生動物間傳播擴散,使珍稀瀕危野生動物種群的保護面臨巨大挑戰[7]。因此,對珍稀瀕危野生動物種群的病原攜帶狀況進行研究,對于評估目標種群的健康狀況,以及制定精確的保護管理對策十分重要。
梅花鹿(Cervus nippon)隸屬于鯨偶蹄目(Cetartiodactyla)鹿科(Cervidae)鹿屬(Cervus),是東亞季風區特產鹿類,國際瀕危物種,我國一級重點保護野生動物[8]。歷史上,梅花鹿曾廣泛分布于亞洲東北部,我國曾分布有6 個亞種,目前僅存東北亞種(C. n.hortulorum)、四川亞種(C. n. sichuanicus)和華東亞種(C. n. kopschi)3個亞種的野外種群[8?9]。華東梅花鹿主要分布在江西東北部、浙江西北部和安徽南部,為保護瀕危的華東梅花鹿種群,江西省和浙江省分別建立了以華東梅花鹿為重點保護對象的國家級自然保護區[10]。近年來,由于江西桃紅嶺梅花鹿國家級自然保護區實行嚴格的封山育林政策,導致保護區內植被正向演替明顯,梅花鹿棲息空間受到擠壓,大量梅花鹿開始向保護區外圍擴散,其種群遭受人為干擾強度和疫病發生風險均顯著增加,而當前對桃紅嶺梅花鹿種群的疫源疫病狀況研究較少。
傳統動物病原檢測方法比較繁瑣,且單次檢測樣品數量有限,隨著測序技術的發展,高通量測序在環境微生物檢測方面的應用為動物病原檢測提供了新的方法和手段[11?12]。宏基因組指特定環境條件下所有生物遺傳物質的總和[13]。基于二代測序技術的宏基因組測序可直接提取環境中微生物的總DNA進行測序分析,實現對特定環境中所有微生物種類及數量的精確鑒定[14?15]。本研究采用宏基因組測序技術對江西桃紅嶺梅花鹿種群的病原攜帶狀況進行檢測分析,通過分析不同區域梅花鹿群體的潛在病原攜帶狀況,較系統地評價人為活動及潛在疫病對桃紅嶺梅花鹿種群的影響,從而為江西桃紅嶺梅花鹿種群的保護管理和疫源疫病防控提供理論依據和數據支撐。
1 材料與方法
1. 1 樣品采集
2022年7月,在江西桃紅嶺梅花鹿國家級自然保護區(以下簡稱“桃紅嶺保護區”)的核心區、緩沖區和實驗區分別采集梅花鹿新鮮糞便樣品25份,共計采集樣品75份。采集過程均佩戴一次性無菌手套,為避免樣品交叉污染,每采集一份樣品更換一次手套。采集的糞便樣品儲存于無菌無核酸酶的50 mL離心管中,然后用手提冰箱低溫運輸至實驗室,于超低溫冰箱中-80 ℃保存。
1. 2 糞便樣品DNA 提取及宏基因組測序
將糞便樣品用液氮進行充分研磨,使用TaKaRaMiniBEST Universal Genomic DNA Extraction Kit試劑盒提取糞便樣品總DNA,提取的DNA經1%瓊脂糖凝膠電泳檢測其完整性和純度,對不合格的DNA樣品進行重新提取檢測,直至符合要求。將每個研究區域的25份樣品按DNA濃度1∶1∶1∶1∶1的比例進行5 合1 混樣,即每個研究區域最終獲得5 組混合DNA樣品(實驗區,A1~A5;緩沖區,B1~B5;核心區,C1~C5),共15組。最后對混合DNA樣品進行建庫及測序,每個樣品測序數據量為6 Gb,宏基因組測序由生工生物工程(上海)股份有限公司完成。
1. 3 數據處理與統計分析
將測序的原始數據通過Fastp進行質量評估和數據過濾,使用megahit 和SPAdes 拼接組裝,采用Prodigal對拼接結果進行ORF預測。基于各樣品的基因預測結果,采用CD-HIT軟件去冗余,獲得非冗余基因集,然后將基因集與NR、PHI-base等數據庫比對,獲得基因的物種注釋信息,并根據基因集豐度得到物種豐度。應用R軟件進行主成分分析(principalcomponents analysis,PCA)和置換多元方差分析(PERMANOVA)。使用SPSS v24. 0軟件進行數據統計分析,plt;0. 05為差異顯著。使用OriginPro軟件作圖。
2 結果
2. 1 宏基因組測序數據
宏基因組測序數據經過濾后,15組樣品共得到101 021. 286 3 Mb的有效數據,包括6. 57×108個reads。樣品平均序列長度為148~150 bp,質量在Q20以上的堿基占95. 92%~97. 89%,質量在Q30以上的堿基占90. 45%~93. 67%,樣品文庫覆蓋率為93. 00%~99. 00%(表1)。以上數據表明,本次宏基因組測序結果能夠代表樣品的真實情況,具有較高的可靠性。
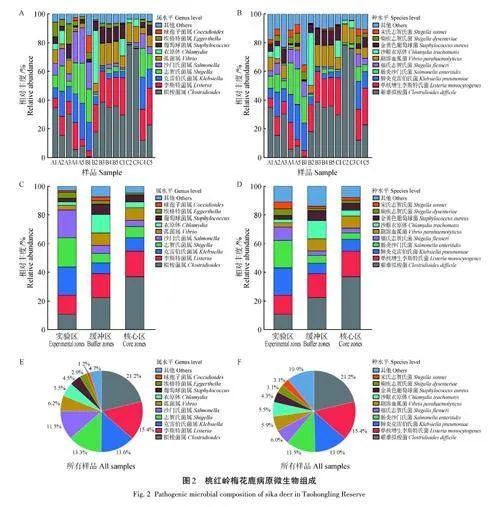
2. 2 桃紅嶺梅花鹿腸道微生物組成
獲得的15組梅花鹿糞便樣品宏基因組數據共鑒定出微生物4界53門70綱165目389科1 349屬8 382種。在界水平上,15組樣品中細菌占比均最高,相對豐度為95. 04%~99. 80%(圖1A)。在門水平上,桃紅嶺梅花鹿腸道優勢菌門為厚壁菌門(Firmicutes)、擬桿菌門(Bacteroidetes)、放線菌門(Actinobacteria)、變形菌門(Proteobacteria)和廣古菌門(Euryarchaeota)(圖1B)。
2. 3 桃紅嶺梅花鹿潛在病原微生物組成
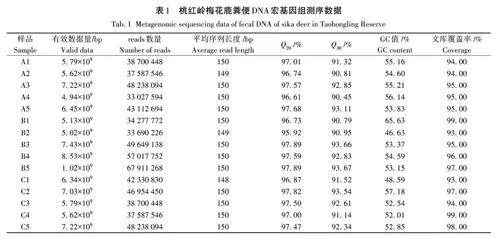
通過將宏基因組測序數據與PHI-base 數據庫(http://www. phi-base. org/)比對得到病原物種信息,在剔除掉植物和昆蟲病原后,共鑒定出桃紅嶺梅花鹿潛在病原微生物2 界9 門14 綱23 目27 科34 屬63種。本研究選取屬、種兩個層級的數據對不同樣品的病原微生物組成進行分析。
在屬、種兩個水平上,15組樣品間的病原微生物組成均存在較大差異(圖2A、B)。對不同區域樣品進行統計分析表明,在屬水平上,實驗區樣品豐度排名前5的病原分別是志賀氏菌屬(Shigella)、克雷伯氏菌屬(Klebsiella)、沙門氏菌屬(Salmonella)、李斯特菌屬(Listeria)和擬梭菌屬(Clostridioides);緩沖區樣品豐度排名前5的分別是擬梭菌屬、李斯特菌屬、衣原體(Chlamydia)、弧菌屬(Vibrio)和克雷伯氏菌屬;核心區樣品豐度排名前5的分別是擬梭菌屬、李斯特菌屬、克雷伯氏菌屬、弧菌屬和志賀氏菌屬(圖2C)。在種水平上,實驗區樣品豐度排名前5的病原分別是腸炎沙門氏菌(Salmonella enteritidis)、肺炎克雷伯氏菌(Klebsiella pneumoniae)、單核增生李斯特氏菌(Listeria monocytogenes)、艱難擬梭菌(Clostridi?oides difficile)和福氏志賀氏菌(Shigella flexneri);緩沖區樣品豐度排名前5的分別是艱難擬梭菌、單核增生李斯特氏菌、沙眼衣原體(Chlamydia trachoma?tis)、副溶血弧菌(Vibrio parahaemolyticus)和肺炎克雷伯氏菌;核心區樣品豐度排名前5的分別是艱難擬梭菌、單核增生李斯特氏菌、肺炎克雷伯氏菌、副溶血弧菌和金黃色葡萄球菌(Staphylococcus aureus)(圖2D)。3個研究區域在屬水平上共有的病原是克雷伯氏菌屬、李斯特菌屬和擬梭菌屬,在種水平上共有的病原是肺炎克雷伯氏菌、單核增生李斯特氏菌和艱難擬梭菌。將15組樣品進行統一分析,結果表明,桃紅嶺梅花鹿攜帶病原豐度在屬水平上排名前5的分別是擬梭菌屬、李斯特菌屬、克雷伯氏菌屬、志賀氏菌屬和沙門氏菌屬(圖2E),在種水平上排名前5的分別是艱難擬梭菌、單核增生李斯特氏菌、肺炎克雷伯氏菌、腸炎沙門氏菌和福氏志賀氏菌(圖2F)。
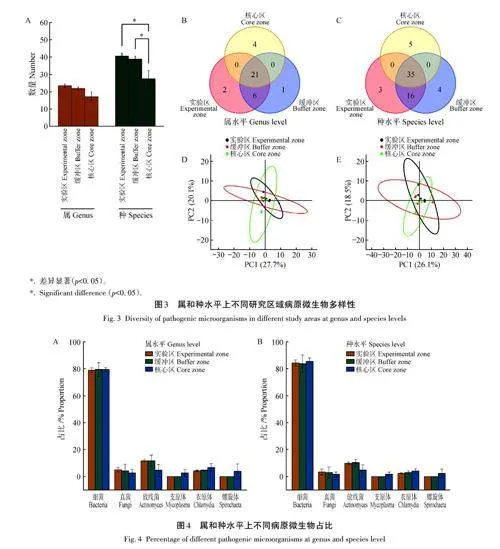
2. 4 不同研究區域病原微生物多樣性
15組樣品共檢測出病原34屬63種,其中實驗區29 屬54 種,緩沖區28 屬55 種,核心區25 屬40 種。在屬水平上,3個研究區域病原數量沒有顯著差異,在種水平上,核心區病原數量顯著低于實驗區和緩沖區(圖3A)。此外,在屬水平上,3個研究區域共有的病原為21個,實驗區、緩沖區和核心區獨有病原分別為2、1、4個,實驗區和緩沖區共有的病原為6個(圖3B);在種水平上,3個研究區域共有的病原為35個,實驗區、緩沖區和核心區獨有病原分別為3、4、5個,實驗區和緩沖區共有的病原為16 個(圖3C)。對3個研究區域的病原微生物種類進行PCA分析,在屬、種兩個水平上,3個研究區域樣品在PCA圖中均大范圍重疊,表明3個研究區域的病原微生物多樣性較為相似(圖3D、E)。PERMANOVA分析也表明,在屬和種水平上,3個研究區域的病原微生物多樣性均沒有顯著性差異。上述結論表明,桃紅嶺保護區核心區梅花鹿攜帶病原數量顯著低于實驗區和緩沖區,但不同區域梅花鹿攜帶病原種類具有較高的相似性。
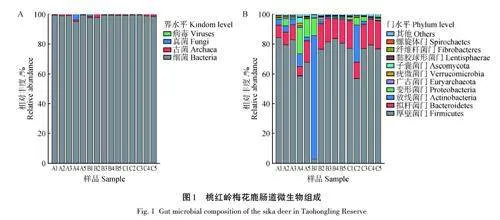
2. 5 不同研究區域病原微生物分類
對15組樣品檢出的病原進行分類。桃紅嶺梅花鹿攜帶病原微生物主要可分為細菌、真菌、放線菌、衣原體、支原體和螺旋體。在屬、種兩個水平上,3 個研究區域中細菌的占比均最高(78. 85%~85. 48%),支原體的占比均最低(0~2. 73%),表明細菌是桃紅嶺梅花鹿攜帶的主要病原微生物(圖4A、B)。此外,對檢出的63種病原進行分析表明,63種病原中有27種為人獸共患病病原,占比為42. 86%。
2. 6 不同研究區域梅花鹿病原的差異
在63種檢出病原中,已報道可造成鹿科動物感染的病原有肺炎克雷伯氏菌、腸炎沙門氏菌、單核增生李斯特氏菌和多殺巴斯德氏菌(Pasteurella multo?cida)。這4種病原在3個研究區域中均被檢出,對比其在不同研究區域的平均相對豐度表明,除核心區腸炎沙門氏菌豐度顯著低于實驗區外,其余病原豐度均沒有顯著差異(圖5)。
3 討論
本研究從桃紅嶺梅花鹿糞便樣品中共檢測出潛在病原34屬63種,可分為細菌、真菌、放線菌、衣原體、支原體和螺旋體,其中,細菌占比最高。在種水平上,相對豐度較高的病原主要有艱難擬梭菌、單核增生李斯特氏菌、肺炎克雷伯氏菌、腸炎沙門氏菌和福氏志賀氏菌,這5種病原均為重要的人畜共患病致病菌[16]。肺炎克雷伯氏菌為寄生于腸道或呼吸道的條件致病菌,是引起人與動物肺部感染的主要病原之一[17?18];艱難擬梭菌可在人與多種動物體內定殖,造成感染性腹瀉[19];而單核增生李斯特氏菌、腸炎沙門氏菌和福氏志賀氏菌均是重要的食源性致病菌,可引起人、家畜及野生動物流產、腦膜炎、腸胃炎、敗血癥和死胎等多種病癥[20?22]。由于歷史遺留問題,桃紅嶺保護區外圍實驗區內分布多個村莊和大量農田,近些年向實驗區擴散的梅花鹿種群經常在農田采食農作物,與人畜接觸較為頻繁,其活動區域與當地村民放養的家畜活動區域高度重疊[23]。因此,同域放養的家畜可能是梅花鹿攜帶病原的重要來源。此外,人獸共患病病原在桃紅嶺梅花鹿檢出病原中的高占比(42. 86%)也表明,這些病原在梅花鹿、家畜、人中存在較高的傳播擴散風險。
PCA和PERMANOVA分析表明,桃紅嶺保護區不同區域梅花鹿攜帶病原種類沒有顯著性差異,并且在相對豐度排名靠前的病原中,不同研究區域間僅有個別病原的相對豐度存在差異。在野生動物中,類似的腸道微生物分布特征只在同域個體中比較常見[24?25]。這說明桃紅嶺保護區不同區域梅花鹿個體間的交流較為頻繁,所以病原微生物在不同區域個體間的分布較為相似。另一方面,桃紅嶺梅花鹿攜帶病原的數量從實驗區到核心區呈現依次遞減的趨勢,特別是在種水平上,核心區梅花鹿攜帶病原數量顯著低于緩沖區和實驗區,即越接近人類活動的區域,梅花鹿攜帶病原數量越多。該結果表明人類活動可能是影響桃紅嶺梅花鹿病原攜帶水平的重要因素。
經查閱相關文獻,發現本研究檢出的63種病原可直接感染鹿科動物的有肺炎克雷伯氏菌、腸炎沙門氏菌、單核增生李斯特氏菌和多殺巴斯德氏菌[17,26?29],其中,肺炎克雷伯氏菌是造成動物園和飼養梅花鹿個體肺部感染及死亡的主要病原[17?18];腸炎沙門氏菌主要侵染鹿類腸道,在規模化的梅花鹿和馬鹿(Cervus elaphus)養殖場中,腸炎沙門氏菌可與巴氏桿菌(Pasteurella)、魏氏梭菌(Clostridiumwelchii)等病原混合感染導致鹿類死亡[26?27];單核增生李斯特氏菌主要感染免疫力低下的個體,造成野生麋鹿(Elaphurus davidianus)及白尾鹿(Odocoileusvirginianus)的幼鹿死亡[28];多殺巴斯德氏菌則會引起梅花鹿的腸毒血癥,該病發病急,病死率高,常給梅花鹿養殖場造成重大經濟損失[29]。上述4種病原在本次研究的不同區域中均有被檢出,除腸炎沙門氏菌外,其他病原的相對豐度在不同研究區域中均沒有顯著差異。因此,在對桃紅嶺梅花鹿的疫源疫病監測中,應加強對這幾種病原的單獨監測及預警,以防止相關疫病暴發導致梅花鹿大量死亡。此外,除上述已知的4種梅花鹿病原外,金黃色葡萄球菌、志賀氏菌、巴爾通氏體(Bartonella)、彎曲桿菌(Cam?pylobacter)和耶爾森氏菌(Yersinia)等致病菌也是鹿科動物普遍攜帶的病原[30?34]。雖然目前沒有研究表明這些病原可直接感染梅花鹿,但依據其致病特性,依然認為它們是影響梅花鹿種群健康的潛在威脅,因此在對桃紅嶺梅花鹿種群的保護管理中也應引起重視。本研究通過與PHI-base數據庫比對來鑒定桃紅嶺梅花鹿攜帶的潛在病原,雖然PHI-base數據庫目前主要收錄能感染動物、植物、真菌和昆蟲等宿主的病原體致病基因、毒力基因等信息,且已經過實驗驗證,但在稀有及未知病原的鑒定上還存在欠缺。因此,后續對病原數據庫的補充完善及對宏基因組數據的深入挖掘,可能會給桃紅嶺梅花鹿病原調查的結論帶來新的見解。
綜上所述,本研究結果表明,桃紅嶺梅花鹿攜帶有多種病原,其中大部分為人獸共患病病原,且核心區梅花鹿攜帶病原顯著低于緩沖區和實驗區。同時,人類活動可能是影響桃紅嶺梅花鹿病原攜帶水平的重要因素。針對桃紅嶺梅花鹿種群的保護與管理,筆者建議:首先,在保護區核心區內積極推進棲息地矮化工作,擴大和改善梅花鹿適宜棲息地的面積和質量,避免桃紅嶺梅花鹿進一步向保護區外圍擴散;其次,對桃紅嶺梅花鹿關鍵高危病原開展持續性監測,并做好疫病預警,必要時采取人工干預措施防止疫病傳播擴散;最后,加強對保護區外圍擴散梅花鹿種群的管理,減少梅花鹿與人畜接觸的機會,并對當地村民進行保護宣傳,提高村民的保護意識。
參考文獻:
[1] 朱睿, 趙克雷. 淺談野生動物保護與流行疫病防控[J]. 四川
動物, 2023, 42(3): 355-360.
ZHU R, ZHAO K L. Wild animal protection and epidemic disease
prevention and control[J]. Sichuan Journal of Zoology,
2023, 42(3): 355-360.
[2] 姜丙坤, 孫斯翀, 劉頌蕊, 等. 同一健康理念下中國野生動物
源疫病監測及響應體系發展對策[J]. 生物多樣性, 2022, 30
(11): 251-265.
JIANG B K, SUN S C, LIU S R, et al. Countermeasures for the
development of Chinese wildlife disease surveillance and response
system under One Health framework[J]. Biodiversity Science,
2022, 30(11): 251-265.
[3] 王業, 夢夢, 何宏軒. 野生動物與人獸共患病[J]. 科學,
2020, 72(3): 4-8; 69.
WANG Y, MENG M, HE H X. Wildlife and zoonosis[J]. Science,
2020, 72(3): 4-8; 69.
[4] JONES K E, PATEL N G, LEVY M A, et al. Global trends in
emerging infectious diseases[J]. Nature, 2008, 451: 990-993.
[5] COHEN J M, SAUER E L, SANTIAGO O, et al. Divergent impacts
of warming weather on wildlife disease risk across climates
[J]. Science, 2020, 370(6519): eabb1702.
[6] ESPOSITO M M, TURKU S, LEHRFIELD L, et al. The impact
of human activities on zoonotic infection transmissions[J]. Animals,
2023, 13(10): 1646.
[7] HU B, HAN S Y, HE H X. Effect of epidemic diseases on wild
animal conservation[J]. Integrative Zoology, 2023, 18(6):
963-980.
[8] 國家林業和草原局, 農業農村部. 國家重點保護野生動物名
錄(2021 年2 月1 日修訂)[J]. 野生動物學報, 2021, 42(2):
605-640.
National Forestry and Grassland Administration, Ministry of Agriculture
and Rural Affairs. List of national key protected wild animals(
revised on February 1, 2021)[J]. Chinese Journal of Wildlife,
2021, 42(2): 605-640.
[9] 魏輔文. 中國獸類分類與分布[M]. 北京: 科學出版社,
2022: 387-388.
WEI F W. Taxonomy and distribution of mammals in China[M].
Beijing: Science Press, 2022: 387-388.
[10] 章叔巖, 郭瑞, 劉偉, 等. 華南梅花鹿研究現狀及展望[J].
浙江林業科技, 2016, 36(2): 90-94.
ZHANG S Y, GUO R, LIU W, et al. Research progress and
prospect of Cervus nippon kopschi[J]. Journal of Zhejiang Forestry
Science and Technology, 2016, 36(2): 90-94.
[11] SUMINDA G G D, BHANDARI S, WON Y, et al. Highthroughput
sequencing technologies in the detection of livestock
pathogens, diagnosis, and zoonotic surveillance[J]. Computational
and Structural Biotechnology Journal, 2022, 20: 5378-
5392.
[12] TITCOMB G C, JERDE C L, YOUNG H S. High-throughput sequencing
for understanding the ecology of emerging infectious
diseases at the wildlife-human interface[J]. Frontiers in Ecology
and Evolution, 2019, 7: 126.
[13] HANDELSMAN J, RONDON M R, BRADY S F, et al. Molecular
biological access to the chemistry of unknown soil microbes:
a new frontier for natural products[J]. Chemistry amp; Biology,
1998, 5(10): R245-R249.
[14] ANDERSEN S C, HOORFAR J. Surveillance of foodborne
pathogens: towards diagnostic metagenomics of fecal samples
[J]. Genes, 2018, 9(1): 14.
[15] DE FLAMINGH A, ISHIDA Y, PE?NEROVá P, et al. Combining
methods for non-invasive fecal DNA enables whole genome
and metagenomic analyses in wildlife biology[J]. Frontiers
in Genetics, 2023, 13: 1021004.
[16] RAHMAN M T, SOBUR M A, ISLAM M S, et al. Zoonotic diseases:
etiology, impact, and control[J]. Microorganisms, 2020,
8(9): 1405.
[17] 王煒強, 孫浩云, 楊志松. 動物園梅花鹿源肺炎克雷伯氏菌
的分離鑒定及耐藥性[J]. 野生動物學報, 2022, 43(1):
220-223.
WANG W Q, SUN H Y, YANG Z S. Isolation, identification
and drug resistance of Klebsiella pneumoniae isolated from sika
deer (Cervus nippon) in zoo[J]. Chinese Journal of Wildlife,
2022, 43(1): 220-223.
[18] 王印, 熊焰, 徐志文. 梅花鹿敗血性肺炎病原的分離及其藥
敏試驗[J]. 經濟動物學報, 2008, 12(3): 177-179.
WANG Y, XIONG Y, XU Z W. Isolation, identification and
drug sensitive test of sika deer septic pneumonia pathogen[J].
Journal of Economic Animal, 2008, 12(3): 177-179.
[19] 李丹洋, 韓雅莉, 馬亞琴, 等. 艱難梭菌動物感染流行病學
研究進展[J]. 中國人獸共患病學報, 2022, 38(9): 824-829.
LI D Y, HAN Y L, MA Y Q, et al. Research progress in the epidemiology
of Clostridium difficile infections in animals[J]. Chinese
Journal of Zoonoses, 2022, 38(9): 824-829.
[20] CAMARGO A C, WOODWARD J J, NERO L A. The continuous
challenge of characterizing the foodborne pathogen Listeria
monocytogenes[J]. Foodborne Pathogens and Disease, 2016, 13
(8): 405-416.
[21] JAJERE S M. A review of Salmonella enterica with particular focus
on the pathogenicity and virulence factors, host specificity
and antimicrobial resistance including multidrug resistance[J].
Veterinary World, 2019, 12(4): 504-521.
[22] MARCHANT P, HIDALGO-HERMOSO E, ESPINOZA K, et
al. Prevalence of Salmonella enterica and Shiga toxin-producing
Escherichia coli in zoo animals from Chile[J]. Journal of Veterinary
Science, 2016, 17(4): 583-586.
[23] 王林. 江西桃紅嶺梅花鹿國家級自然保護區梅花鹿棲息地優
化對策建議[J]. 河北林業科技, 2018(1): 68-70.
WANG L. The countermeasures and suggestions of improving
the Cervus nippon habitat in Jiangxi Taohongling National Nature
Reserve[J]. The Journal of Hebei Forestry Science and Technology,
2018(1): 68-70.
[24] ZHOU Z C, TANG L P, YAN L P, et al. Wild and captive environments
drive the convergence of gut microbiota and impact
health in threatened equids[J]. Frontiers in Microbiology,
2022, 13: 832410.
[25] 馮佳慧, 龔治忠, 許娜, 等. 升金湖越冬小白額雁與同域家
鴨腸道菌群多樣性研究[J]. 四川動物, 2022, 41(5):
490-499.
FENG J H, GONG Z Z, XU N, et al. Gut bacterial communities
of wintering Anser erythropus and sympatric Anas platyrhynchos
domesticus in Shengjin Lake, Anhui[J]. Sichuan Journal of Zoology,
2022, 41(5): 490-499.
[26] 宮國令. 規模化鹿場發生沙門氏菌和梭菌混合感染的報告
[J]. 中國草食動物, 2008, 28(3): 70-71.
GONG G L. Report on mixed infection of Salmonella and Clos?
tridium in large-scale deer farm[J]. China Herbivores, 2008, 28
(3): 70-71.
[27] 張發慧. 馬鹿沙門氏菌、巴氏桿菌及魏氏梭菌混合感染的診
治[J]. 中國畜牧獸醫, 2005, 32(1): 56.
ZHANG F H. Diagnosis and treatment of mixed infection of Sal?
monella, Pasteurella and Clostridium welchii in red deer[J].
Animal Science Abroad, 2005, 32(1): 56.
[28] WEYNA A A W, NIEDRINGHAUS K D, KUNKEL M R, et al.
Listeriosis with viral coinfections in 8 gray foxes, 8 wild turkeys,
and 2 young cervids in the southeastern United States[J]. Journal
of Veterinary Diagnostic Investigation, 2022, 34(4):
654-661.
[29] 時坤, 李男, 王樹志, 等. 鹿巴氏桿菌病的診斷與防制[J].
經濟動物學報, 2008, 12(1): 60-62.
SHI K, LI N, WANG S Z, et al. Diagnosis and control of sika
pasteurellosis[J]. Journal of Economic Animal, 2008, 12(1):
60-62.
[30] PATTIS I, MORIARTY E, BILLINGTON C, et al. Concentrations
of Campylobacter spp., Escherichia coli, enterococci, and
Yersinia spp. in the feces of farmed red deer in New Zealand[J].
Journal of Environmental Quality, 2017, 46(4): 819-827.
[31] LAUKOVá A, BINO E, KUBA?OVá I, et al. Characterisation
of faecal staphylococci from roe deer (Capreolus capreolus) and
red deer (Cervus elaphus) and their susceptibility to gallidermin
[J]. Probiotics and Antimicrobial Proteins, 2020, 12(1):
302-310.
[32] LI Y M, HU X L, YANG S, et al. Comparison between the fecal
bacterial microbiota of healthy and diarrheic captive musk deer
[J]. Frontiers in Microbiology, 2018, 9: 300.
[33] PANGJAI D, INTACHINDA S, MARUYAMA S, et al. Isolation
and phylogenetic analysis of Bartonella species from Rusa
deer (Rusa timorensis) in Thailand[J]. Comparative Immunology,
Microbiology and Infectious Diseases, 2018, 56: 58-62.
[34] TOMINO Y, ANDOH M, HORIUCHI Y, et al. Surveillance of
Shiga toxin-producing Escherichia coli and Campylobacter spp.
in wild Japanese deer (Cervus nippon) and boar( Sus scrofa)[J].
The Journal of Veterinary Medical Science, 2020, 82(9): 1287-
1294.

