牡丹峰國家級自然保護區極北鯢產卵場生境



摘 要:極北鯢(Salamandrella keyserlingii)為國家二級重點保護野生動物,其生存受到生境退化和喪失的嚴重威脅,深入探究其產卵時的生境選擇偏好,對促進其種群數量的增長至關重要。2023年5月在牡丹峰國家級自然保護區,采用樣方法調查極北鯢及其卵袋的數量,同時測量產卵場19個生境因子,以期揭示影響其繁殖行為的關鍵因子。結果顯示:共發現154條極北鯢和85條卵袋,極北鯢傾向于選擇植被茂密、近河流的靜水池塘作為產卵地點,池塘面積65. 20 ~ 300. 00 m2,水體平均深度1. 13 m,土壤以黏質為主。所選區域地表溫度保持在14. 50 ~ 17. 20 ℃,水體溫度在13. 90 ~16. 70 ℃,光照強度適宜(7. 44 klx),空氣濕度42. 20% ~ 67. 20%。水質分析表明,水體pH偏堿性(8. 08 ± 0. 17),水體電導率(135. 35 ± 39. 86) μS/cm,溶解氧質量濃度(3. 62 ± 1. 50) mg/L。通過相關性分析和主成分分析,確定影響極北鯢(r1)和卵袋數量(r2)的關鍵因子。其中,距道路距離(r1 = 0. 827、r2 = 0. 724)、水體面積(r1 = 0. 792、r2 = 0. 901)、郁閉度(r1 = 0. 697、r2 = 0. 658)、水體溫度(r1 = 0. 597)、地表溫度(r1 =0. 582)、水體深度(r1 = -0. 706、r2 = -0. 667)、人為干擾程度(r1 = -0. 682、r2 = -0. 616)和水面覆蓋物(r2 = 0. 559)與極北鯢繁殖行為密切相關。氣候因子、水因子以及干擾因子在極北鯢選擇產卵位點時起到重要作用,保護此類環境因子對極北鯢的生存與繁殖具有重要意義。
關鍵詞:極北鯢;卵袋;產卵場生境;牡丹峰國家級自然保護區
中圖分類號:Q958. 1
文獻標識碼:A
文章編號:2310 - 1490(2024)- 03 - 0607 - 10
DOI:10.12375/ysdwxb.20240317
兩棲動物作為脊椎動物中種群數量減少最嚴峻的群體之一,其生存狀況已引起廣泛關注[1]。過去幾十年的研究顯示,全球兩棲類生物滅絕速度顯著加快,其中已有30多種兩棲類生物滅絕,80多種瀕臨滅絕[2?3]。這一現象主要歸因于人類活動導致的自然生境巨變,尤其是棲息地破碎化及水環境污染等問題[4?7]。兩棲動物的生存、繁殖和發育高度依賴于良好的水環境,而人類生產活動中使用的農藥、化肥及其所含的重金屬離子等污染物,對兩棲動物的水體生存環境構成了嚴重威脅[8?12]。此外,人為捕捉及貿易[13]、氣候變化[14?17]、疾病傳播[18?20]以及外來物種入侵[21]等因素也對兩棲動物的數量產生負面影響。
極北鯢(Salamandrella keyserlingii)隸屬于兩棲綱(Amphibia)有尾目(Caudata)小鯢科(Hynobiidae),作為擁有長達2. 3億年的進化歷史物種[22],極北鯢在生物系統發育研究中占據重要位置[23]。該物種主要分布在高寒地帶,表現出較強的抗寒性和適應能力[24?27],在國外,極北鯢主要分布在蒙古國北部、朝鮮半島、日本和俄羅斯東部;國內主要分布于吉林、黑龍江、遼寧和內蒙古東北部[23,28]。然而,由于其對生境要求嚴苛,運動能力較弱,以及適宜棲息地面積的減少,極北鯢種群面臨較大的生存威脅。2021年,極北鯢被列入《國家重點保護野生動物名錄》二級。
極北鯢生境選擇受到多種環境因子影響,包括棲息地的類型、水溫、空氣濕度、林木郁閉度、植被覆蓋度、水體面積、產卵場生境、河岸坡度和水體pH等[29?33]。為了探討極北鯢種群與環境因子之間的關系,選擇位于黑龍江省牡丹江市東南部的牡丹峰國家級自然保護區作為研究區域。該保護區地貌以中低山丘陵為主,海拔200 ~1 000 m,為極北鯢提供了豐富的生境類型。近年來,根據保護區工作人員及周邊蛙農的觀察描述,極北鯢在牡丹峰國家級自然保護區的種群數量有了顯著增長。為了明確這一增長趨勢與環境因子之間的具體關系,本研究對保護區內極北鯢的種群數量和生境狀況等進行調查,旨在為極北鯢的保護及棲息地管理提供數據支持,并為保護策略的制定提供依據。
1 材料與方法
1. 1 極北鯢及卵袋數量調查
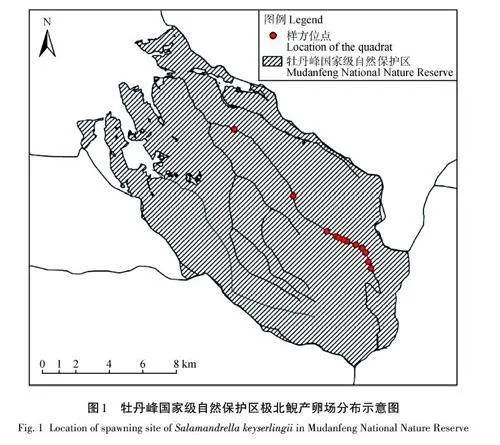
在長白山脈老爺嶺西北坡的牡丹峰國家級自然保護區進行研究,該區域為溫帶大陸性季風氣候。年平均氣溫為3. 6 ℃,年降雨量達542 mm,無霜期約120 d,河流體系隸屬于松花江水系。在2023年5月,選取坐標點44°27′ N、129°46′ E 作為起始點,沿公路向東南方向布設兩條各長10 km 的樣線。沿著兩條樣線,采用系統抽樣法選取12 個具有代表性的樣方,每個樣方包含一個水塘及其周圍10 m的范圍(圖1)。
為調查極北鯢與卵袋懸掛物數量,在每個樣方內設置4個特制的繁殖調查網框(圖2)[31]。網框外部由邊長為1 m的白色PVC管構建成正方形框架,內部采用網孔邊長為2 cm的尼龍材質網,并通過扎帶固定。為確保網框在水中的穩定性和浮力,在其四周綁上泡沫懸浮球。這些網框不僅有助于觀察和記錄極北鯢的數量及卵袋懸掛物,而且還為極北鯢在繁殖期間提供可掛卵的模擬環境。
1. 2 環境因子調查
對19個環境因子進行數據測量與記錄(表1)。為確保數據準確性與一致性,所有需實地測量的項目,如光照強度、水體溫度和空氣濕度等均固定在每日14:00測量。
在選定的水塘中,首先定位水塘對角線的中點作為測量的基準點,隨后,基于該基準點,選擇4個與中心點等距的采樣點,確保采樣點均勻分布于水塘4個方向,從而保證測量的全面性和代表性。對于連續性數據采用多次測量的方法,并對測得的數據進行均值計算。對于非連續性數據進行準確的描述性記錄。
1. 3 統計分析
數據處理采用SPSS、R語言和Origin軟件,在統計分析之前對生態因子中的非量化數據進行量化處理,使用Shapiro-Wilk檢驗評估數據的正態性,并利用Bartlett檢驗檢查方差同質性。在滿足正態性和方差齊性的前提下進行相關性分析,以確定影響極北鯢種群數量的主要因子和次要因子。通過主成分分析(principal component analysis)探究產卵場位點處生態因子的主要影響成分及其貢獻率。描述性統計值用平均值 ± 標準誤表示,顯著性水平設置為α = 0. 05。
2 結果與分析
2. 1 產卵場生境
在牡丹峰國家級自然保護區共記錄極北鯢個體154條及卵袋85條,主要棲息于海拔456. 00 ~690. 00 m的區域。極北鯢的棲息地選擇具有明顯的生境偏好,傾向于靠近河流、植被繁茂、林木郁閉度較高以及腐殖質層深厚的區域。在產卵習性上,極北鯢偏好于將黏質土壤環境中的靜水池塘或水坑作為產卵場所,池塘面積在65.20 ~ 300.00 m2,水體深度平均1.13 m,地表溫度保持在14.50 ~ 17.20 ℃,空氣濕度42.20% ~ 67.20%,光照強度適宜(7.44 klx),此類場所為極北鯢提供了理想的繁殖條件(圖3)。關于水體特性,極北鯢選擇的水體溫度維持在13.90 ~16.70 ℃。這些水體的可見度較低,可能與其中豐富的生物群落和腐殖質含量有關。水體pH相對穩定(8.08 ± 0.17),顯示出微弱的堿性特征。水體電導率為(135.35 ± 39.86) μS/cm,溶解氧質量濃度為(3.62 ±1.50) mg/L。
2. 2 極北鯢種群數量及卵袋數量與生態因子相關性
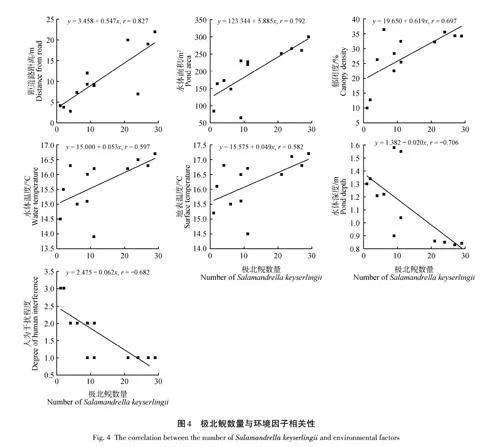
極北鯢的種群數量顯著受到多個生境因子的影響。其中,距道路距離(r = 0. 827,p lt; 0. 01)和水體面積(r = 0. 792,p lt; 0. 01)呈極顯著的正相關關系,同時,郁閉度(r = 0. 697,p lt; 0. 05)、水體溫度(r =0. 597,p lt; 0. 05)和地表溫度(r = 0. 582,p lt; 0. 05)也與極北鯢數量呈顯著正相關。相反,水體深度(r =-0. 706,p lt; 0. 05)和人為干擾程度(r = -0. 682,p lt;0. 05)則與極北鯢的種群數量呈顯著負相關(圖4)。
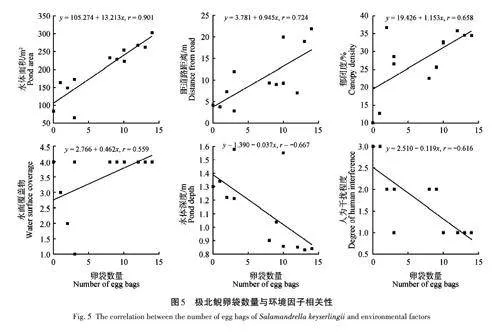
極北鯢卵袋數量也受到多個生境因子的顯著影響。水體面積(r = 0. 901,p lt; 0. 01)和距道路距離(r = 0. 724,p lt; 0. 01)與卵袋數量呈極顯著正相關。同時,郁閉度(r = 0. 658,p lt; 0. 05)和水面覆蓋物(r = 0. 559,p lt; 0. 05)與卵袋數量呈顯著正相關。水體深度(r = -0. 667,p lt; 0. 05)和人為干擾程度(r = -0. 616,p lt; 0. 05)則與卵袋數量呈顯著負相關(圖5)。
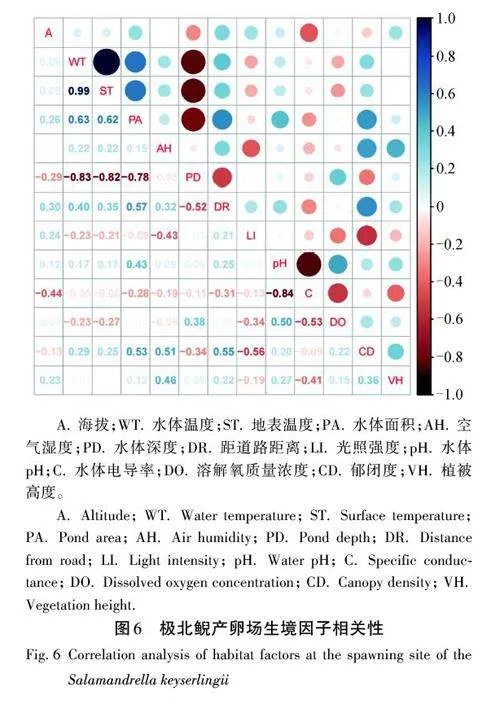
在進一步分析產卵位點生境因子間相關性時,發現各因子之間存在一定的差異性(圖6)。水體溫度與地表溫度之間存在顯著的正相關性(r =0. 990),顯示出兩者之間緊密的關聯。水體深度與水體溫度呈負相關關系(r = -0. 830),即隨著水體深度的增加,水體溫度呈現出逐漸降低的態勢。此外,水體pH與電導率由于受到相同環境條件的影響,呈現顯著的相關性(r = -0. 840)。通過理解生境因子間的相互作用,能夠明確影響極北鯢尋找最適產卵場的重要因素。
2. 3 極北鯢產卵場環境因子主成分分析
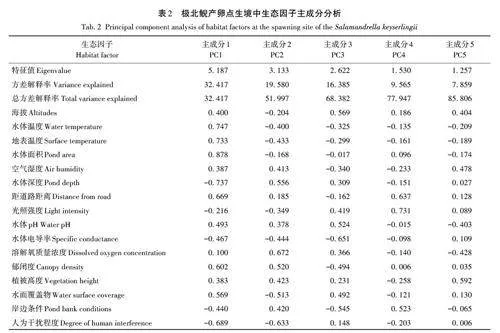
對保護區極北鯢產卵點19個生態因子進行主成分分析,以探究影響極北鯢產卵點生境選擇的主要因素。如表2所示,前5個主成分的累積解釋率為85. 81%。由于PC4和PC5的解釋率相對較低,因此重點分析前3 個主成分(PC1、PC2 和PC3)。其中,PC1占總變異量的32. 42%,是解釋變異最大的主成分。在PC1中,水體面積、水體溫度和水體深度等因子的載荷系數絕對值較大。這表明這些因子在極北鯢產卵點的生境選擇中起著關鍵作用,這些因子通常與極北鯢的生存條件密切相關。PC2占總變異量的19. 58%,是第2重要的主成分。在PC2中,溶解氧質量濃度和人為干擾程度的載荷系數絕對值較大。這兩個因子也對極北鯢的產卵點選擇有重要影響。溶解氧質量濃度是影響水生生物生存的關鍵因素之一,而人為干擾程度可能直接影響極北鯢的棲息環境和繁殖成功率。PC3占總變異量的16. 39%,是第3重要的主成分。在PC3中,水體電導率的載荷系數絕對值較大。水體電導率通常與水質和土壤條件有關,可能對極北鯢的產卵環境產生一定影響。綜上,氣候因子(如溫度)、水因子(如水體面積、水體深度、溶解氧質量濃度和水體電導率)以及干擾因子(如人為干擾程度)是影響極北鯢產卵位點生境選擇的主要因素。
3 討論
動物的生境選擇是一個復雜的過程,需要綜合考慮各種復雜的生存條件,以便找到最適宜的棲息環境[32]。對于極北鯢這一變溫動物而言,生理特性在其生境選擇中起著決定性作用。由于溫度和水的限制,極北鯢的分布受到嚴格約束[34]。
極北鯢在生命的不同階段對環境的需求也有所不同。在幼體時期,極北鯢完全依賴于水生環境,使用鰓呼吸;而成體則轉變為土穴居生活,依賴肺呼吸[22]。極北鯢的皮膚裸露且具有分泌黏液的能力,這一特性使得在濕潤環境中,極北鯢能夠通過皮膚來吸收氧氣,為其呼吸提供額外的輔助[35]。在選擇棲息地時,極北鯢更傾向于空氣濕度較高且靠近水源的地方。這樣的環境不僅能夠滿足極北鯢基本的生理需求,還為其提供了隱蔽和安全的避難所,使極北鯢能夠遠離捕食者和其他潛在威脅,確保生存的安全與舒適。
此外,道路附近的極北鯢數量較少,而且隨著與道路距離的增加,極北鯢的數量呈現出正相關的增長趨勢。這表明道路交通可能對極北鯢的種群數量穩定性產生較大影響[36]。特別是在幼體階段,極北鯢對水環境極為敏感,當水體遭受汽車尾氣、油脂和垃圾等污染物的侵害時,這些有害物質會干擾卵的正常孵化并影響蝌蚪的健康發育[37?38]。再加上極北鯢的四肢相對較弱,限制了它們的運動能力,這使得極北鯢在面對環境污染和人為干擾時顯得較為脆弱。除了水體污染外,人為活動產生的各種干擾因素也可能對極北鯢的種群穩定性造成一定的影響。
極北鯢產卵場位于森林生態系統中,這些森林中的高大喬木為成體極北鯢提供了理想的棲息地,同時也為剛完成變態的幼體提供了良好的擴散環境。產卵場內的植被構成主要以草本和較高的灌木為主,這些植被有效地充當了極北鯢的避難所,對于其生長與存活起到了重要的作用。為了最大限度地提高后代的存活率并降低自身及卵被捕食的風險,極北鯢在選擇產卵點時會綜合考慮較多因素。通常傾向于在岸邊腐殖質較厚、面積較大的靜水池塘中產卵。這些池塘的水生植物豐富多樣,如藻類、水草等,為極北鯢提供了理想的棲息和覓食場所。在繁殖季節,極北鯢會將卵袋附著于水面的水草上,借助豐富的水面覆蓋物和稍顯渾濁的水體為成體的繁殖及幼體的初期發育提供了隱蔽和保護[22,29,39]。總體來看,多種變量共同影響極北鯢產卵生境的選擇,這也印證了其對產卵環境要求的嚴苛。
通過生態考察發現,保護區內極北鯢與蛙類的分布區存在明顯的重疊。當蛙類蝌蚪與極北鯢蝌蚪共同生活在同一水域時,部分蛙類被證實是極北鯢的主要天敵,其蝌蚪會捕食極北鯢的蝌蚪,這不僅降低了極北鯢蝌蚪的成活率,還延長了它們的變態發育期,對極北鯢種群的健康發展構成威脅[40]。因此,建議深入保護區進行系統性兩棲類資源調查。通過了解保護區內兩棲動物的物種多樣性,能夠更準確地評估極北鯢所面臨的生存壓力,并為其制定針對性的保護措施。尤其在極北鯢的蝌蚪期,需要采取措施降低環境中的天敵密度,如及時發現并移除黑龍江林蛙(Rana amurensis)等天敵的卵團,以減少對極北鯢蝌蚪的捕食壓力[40]。
生境作為影響兩棲類種群數量的關鍵因素之一[4?5,39],其質量直接關系到兩棲動物的生存與繁衍。特別是繁殖期的生境質量,對兩棲類種群數量的變動起著決定性作用。因此,需要對保護區內極北鯢主要分布地區的生境進行長期監測和研究,以便及時發現并解決可能對其造成不利影響的因素。產卵地的選擇對于卵的存活、發育和生長至關重要[41?42]。建議將兩棲動物及其生境納入保護區的動物監測內容中,并將其作為環境評價的指示生物。通過開展系統性的研究,更深入地了解極北鯢的生態需求及其與環境的相互關系,從而為制定更有效的保護措施提供科學依據。
參考文獻:
[1] STUART S N, CHANSON J S, COX N A, et al. Status and
trends of amphibian declines and extinctions worldwide[J]. Science,
2004, 306(5702): 1783-1786.
[2] 武正軍, 李義明. 兩棲類種群數量下降原因及保護對策[J].
生態學雜志, 2004,23(1):140-146.
WU Z J, LI Y M. Causes and conservation strategies of amphibian
population declination[J]. Chinese Journal of Ecology, 2004, 23
(1): 140-146.
[3] 于業輝, 張守純, 趙玉軍, 等. 壺菌病與兩棲動物的種群衰退
[J]. 動物學雜志, 2006, 41(3): 118-122.
YU Y H, ZHANG S C, ZHAO Y J, et al. Chytridiomycosis and
amphibian population declines[J]. Chinese Journal of Zoology,
2006, 41(3): 118-122.
[4] ALFORD R A, RICHARDS S J. Global amphibian declines: a
problem in applied ecology[J]. Annual Review of Ecology and
Systematics, 1999,30: 133-165.
[5] 高國柱, 吳孝兵. 兩棲動物種群數量減少的原因探討[J]. 安
徽技術師范學院學報, 2005, 19(1): 37-41.
GAO G Z, WU X B. Discussion on the reasons for the decrease of
amphibian population[J]. Journal of Anhui Technical Teachers
College, 2005, 19(1): 37-41.
[6] 劉木養, 陳偉庭, 李東風. 除草劑稻草隆對蝌蚪生長發育的影
響[J]. 四川動物, 2006, 25(2): 382-385.
LIU M Y, CHEN W T, LI D F. Effects of herbicide-daocaolong
on growth and development of tadpoles of toad (Bufo melanosticus
Schneider)[J]. Sichuan Journal of Zoology, 2006, 25(2):
382-385.
[7] 牛海崗, 王宏元, 張育輝. 雙酚A對中國林蛙蝌蚪生長發育的
毒性效應[J]. 生態毒理學報, 2009, 4(3): 408-414.
NIU H G, WANG H Y, ZHANG Y H. Toxicity effects of bisphenol
A on growth and development of Rana chensinensis tadpoles
[J]. Asian Journal of Ecotoxicology, 2009, 4(3): 408-414.
[8] BRIDGES C M, SEMLITSCH R D. Variation in pesticide tolerance
of tadpoles among and within species of Ranidae and patterns
of amphibian decline[J]. Conservation Biology, 2000, 14(5):
1490-1499.
[9] 李貞, 李丕鵬, 徐齊艷, 等. 農藥和化肥對無尾兩棲類蝌蚪的
毒性效應研究進展[J]. 生態毒理學報, 2010, 5(2): 287-294.
LI Z, LI P P, XU Q Y, et al. Research advances in toxicological
effects of pesticide and fertilizer pollutants on the anuran larvae
[J]. Asian Journal of Ecotoxicology, 2010, 5(2): 287-294.
[10] BELDEN J, MCMURRY S, SMITH L, et al. Acute toxicity of
fungicide formulations to amphibians at environmentally relevant
concentrations[J]. Environmental Toxicology and Chemistry,
2010, 29(11): 2477-2480.
[11] GUO S Z, QIAN L J, SHI H H, et al. Effects of tributyltin
(TBT) on Xenopus tropicalis embryos at environmentally relevant
concentrations[J]. Chemosphere, 2010, 79(5): 529-533.
[12] HOOSER E A, BELDEN J B, SMITH L M, et al. Acute toxicity
of three strobilurin fungicide formulations and their active ingredients
to tadpoles[J]. Ecotoxicology, 2012, 21(5): 1458-
1464.
[13] 尹峰, 夢夢, 宋慧剛, 等. 中國食用野生動物狀況調查[J].
野生動物, 2006, 27(6): 2-5.
YIN F, MENG M, SONG H G, et al. Survey on wildlife consumption
as food in China[J]. Chinese Wildlife, 2006, 27(6):
2-5.
[14] CAREY C, ALEXANDER M A. Climate change and amphibian
declines: is there a link?[J]. Diversity and Distributions, 2003,
9(2): 111-121.
[15] 馬瑞俊, 蔣志剛. 全球氣候變化對野生動物的影響[J]. 生態
學報, 2005, 25(11): 3061-3066.
MA R J, JIANG Z G. Impact of global climate change on wildlife
[J]. Acta Ecologica Sinica, 2005, 25(11): 3061-3066.
[16] READING C J. Linking global warming to amphibian declines
through its effects on female body condition and survivorship[J].
Oecologia, 2007, 151(1): 125-131.
[17] 吳建國, 呂佳佳, 艾麗. 氣候變化對生物多樣性的影響:脆弱
性和適應[J]. 生態環境學報, 2009, 18(2): 693-703.
WU J G, LV J J, AI L. The impacts of climate change on the
biodiversity: vulnerability and adaptation[J]. Ecology and Environmental
Sciences, 2009, 18(2): 693-703.
[18] BURROWES P A, JOGLAR R L, GREEN D E. Potential
causes for amphibian declines in Puerto Rico[J]. Herpetologica,
2004, 60(2): 141-154.
[19] DASZAK P, BERGER L, CUNNINGHAM A A, et al. Emerging
infectious diseases and amphibian population declines[J].
Emerging Infectious Diseases, 1999, 5(6): 735-748.
[20] POUNDS J A, CRUMP M L. Amphibian declines and climate
disturbance: the case of the golden toad and the harlequin frog
[J]. Conservation Biology, 1994, 8(1): 72-85.
[21] VITOUSEK P M, MOONEY H A, LUBCHENCO J,et al. Human
domination of earth’s ecosystems[J]. Science, 1997, 277:
494-499.
[22] 趙文閣, 呂連寬. 極北鯢與胎生蜥蜴寒溫帶兩棲爬行動物的
典型代表[J]. 人與生物圈, 2013(增刊1): 99-101.
ZHAO W G, LU L K. The Arctic salamander and viviparous lizard
are typical representatives of amphibians and reptiles in the
cold temperate zone[J]. Man and the Biosphere, 2013(Suppl. 1):
99-101.
[23] 段卓. 極北鯢不同地理種群遺傳多樣性及骨骼形態分析
[D]. 哈爾濱: 哈爾濱師范大學, 2020.
DUAN Z. Analysis on genetic diversity and skeletal morphology
of Salamandrella keyserlingii in different geographical populations
[D]. Harbin: Harbin Normal University, 2020.
[24] MALYARCHUK B, DERENKO M, DENISOVA G. Phylogeny
and genetic history of the Siberian salamander (Salamandrella
keyserlingii, Dybowski, 1870) inferred from complete mitochondrial
genomes[J]. Molecular Phylogenetics and Evolution,
2013, 67(2): 348-357.
[25] ALFIMOV A V, BERMAN D I. Reproduction of the Siberian
salamander, Salamandrella keyserlingii (Amphibia, Caudata,
Hynobiidae), in water bodies on permafrost in northeastern Asia
[J]. Biology Bulletin, 2010, 37(8): 807-822.
[26] SEDALISCHEV V T, SOLOMONOVA T N, ODNOKURTSEV V
A, et al. 118. Siberian salamander Salamandrella keyserlingii
as an object for study of cold resistance[J]. Cryobiology, 2010,
61(3): 398.
[27] BERMAN D I, BULAKHOVA N A. Ecological characteristics of
the Siberian salamander (Salamandrella keyserlingii, Caudata,
Hynobiidae) from the coastal part of the sea of Okhotsk[J]. Biology
Bulletin, 2016, 43(7): 643-653.
[28] MATSUI M, YOSHIKAWA N, TOMINAGA A, et al. Phylogenetic
relationships of two Salamandrella species as revealed by
mitochondrial DNA and allozyme variation (Amphibia: Caudata:
Hynobiidae)[J]. Molecular Phylogenetics and Evolution,
2008, 48(1): 84-93.
[29] 張克勤, 張振華, 陳玉梅. 極北鯢繁殖習性的研究[J]. 動物
學雜志, 1993, 28(5): 9-12.
ZHANG K Q, ZHANG Z H, CHEN Y M. Study on reproductive
habits of Salamandrella keyserlingii[J]. Chinese Journal of Zoology,
1993, 28(5): 9-12.
[30] 王恒, 韓雷, 趙文閣, 等. 同域分布的兩種有尾類的產卵生
境[J]. 生態學雜志, 2019, 38(7): 2113-2119.
WANG H, HAN L, ZHAO W G, et al. Spawning habitats of two
sympatric species of Urodela[J]. Chinese Journal of Ecology,
2019, 38(7): 2113-2119.
[31] 羅玉梅, 王卓聰, 郭艷雙, 等. 長白山區路域兩棲類繁殖生
境恢復的初步研究[J]. 四川動物, 2022, 41(3): 278-283.
LUO Y M, WANG Z C, GUO Y S, et al. Preliminary study on
ecological restoration of amphibian breeding habitat in the Changbai
Mountain road area[J]. Sichuan Journal of Zoology, 2022,
41(3): 278-283.
[32] WILEN B O, FRAYER W E. Status and trends of U. S. wetlands
and deepwater habitats[J]. Forest Ecology and Management,
1990, 33/34: 181-192.
[33] 顏忠誠, 陳永林. 動物的生境選擇[J]. 生態學雜志, 1998,
17(2): 43-49.
YAN Z C, CHEN Y L. Habitat selection of animals[J]. Chinese
Journal of Ecology, 1998, 17(2): 43-49.
[34] 張曉翠, 敬凱. 兩棲類的繁殖遷徙研究概述[J]. 四川動物,
2014, 33(6): 943-953.
ZHANG X C,JING K. A summary on amphibian breeding migration
[J]. Sichuan Journal of Zoology, 2014, 33(6): 943-953.
[35] 張向. 小鯢科動物外部形態特征和皮膚組織的形態學研究
[D]. 洛陽: 河南科技大學, 2014.
ZHANG X. Morpholoy research on the external morphological
characteristics and skin tissue in hynobiid salamanders[D].
Luoyang:Henan University of Science and Technology, 2014.
[36] 王云, 楊艷剛, 史國強, 等. 長白山自然保護區公路致死影
響下兩棲類動物數量穩定性風險評價[J]. 交通運輸研究,
2021, 7(6):106-114.
WANG Y, YANG Y G, SHI G Q, et al. Influence of roadkill on
amphibian population quantity stability in Changbai Mountain
Nature Reserve[J]. Transport Research, 2021, 7(6): 106-114.
[37] 羅玉梅, 樸正吉, 王卓聰, 等. 長白山兩棲類繁殖期路域水
生境選擇性分析[J]. 四川動物, 2015, 34(4): 559-564.
LUO Y M, PIAO Z J, WANG Z C, et al. Road around water environment
habitat selection analysis of amphibians during breeding
season in Changbai Mountains[J]. Sichuan Journal of Zoology,
2015, 34(4): 559-564.
[38] 王曉雯. 氟化物對中華大蟾蜍幼體發育的影響[D]. 西安: 陜
西師范大學, 2011.
WANG X W. Effects of fluoride on larval development of Bufo
gargarizans[D]. Xi’an: Shaanxi Normal University, 2011.
[39] 梁國付, 李成蹊, 白鑫, 等. 農業景觀中環境因素對兩棲類
生物分布的影響[J]. 應用生態學報, 2019, 30(1):301-308.
LIANG G F, LI C X, BAI X, et al. Effects of environmental factors
on the distribution of amphibians in agricultural landscape
[J]. Chinese Journal of Applied Ecology, 2019, 30(1):
301-308.
[40] 龍章巍, 王巖, 朱洪強, 等. 極北鯢蝌蚪期生長發育規律的
研究[J]. 熱帶林業, 2019, 47(3): 57-61.
LONG Z W, WANG Y, ZHU H Q, et al. A study on the tadpole
growth and development of Salamandrella keyserlingii[J]. Tropical
Forestry, 2019, 47(3): 57-61.
[41] 李婷婷, 朱錫紅, 吳光年, 等. 鎮海棘螈產卵場微生境選擇
[J]. 生物多樣性, 2023, 31(1): 207-217.
LI T T, ZHU X H, WU G N, et al. Spawning ground microhabitat
selection by the Chinhai spiny newt (Echinotriton chinhaien?
sis)[J]. Biodiversity Science, 2023, 31(1): 207-217.
[42] 王彥平, 武正軍, 陸萍, 等. 寧波地區黑斑蛙的繁殖生態和
產卵地選擇[J]. 動物學研究, 2007, 28(2): 186-192.
WANG Y P, WU Z J, LU P, et al. Breeding ecology and oviposition
site selection of black-spotted pond frogs( Rana nigromacu?
lata) in Ningbo, China[J]. Zoological Research, 2007, 28(2):
186-192.

