乙醛不能使溴的四氯化碳溶液退色嗎
摘 要:綜合分析近期文獻中有關乙醛能否使溴的四氯化碳溶液退色的研究與表述。通過實驗驗證了乙醛能使溴的四氯化碳溶液退色,打破了高中教學中對于這部分知識的原有認知。通過驗證反應過程中產生的氣體,以及改用甲醛進行對比實驗,確認了乙醛與溴之間反應的基團,并進一步探討了其反應機理。從實驗和理論兩個方面證實乙醛可以使溴的四氯化碳溶液退色。
關鍵詞:乙醛;溴的四氯化碳溶液;甲醛;α-H取代
文章編號:1005-6629(2024)09-0068-04
中圖分類號:G633.8
文獻標識碼:B
1 問題提出
乙醛作為高中化學醇與羧酸之間重要的橋梁物質,被師生熟知。在高中教學中要求從醛基的角度出發,來探究醛類物質性質,并以此實現對官能團這一概念的學習和深化認識。在教學中對乙醛化學性質進行實驗驗證時發現,實驗室不存在純乙醛,只有40%的乙醛水溶液,因此產生疑問:如何才能完成乙醛能否使溴的四氯化碳溶液退色這一實驗?進而對中學教師中較為普遍的認知——乙醛不能使溴的四氯化碳溶液退色產生懷疑。一些教師認為:乙醛可以使溴水退色,因為溴與水反應生成溴化氫和次溴酸,乙醛與次溴酸反應被氧化成乙酸;由于溴的四氯化碳溶液中不存在氧化劑,無法將乙醛氧化成乙酸,所以乙醛應不能使溴的四氯化碳溶液退色。仔細分析會發現這種認知前后并無因果關系,所以結論不一定正確。
2 相關文獻的表述
查閱相關文獻發現對于乙醛能否使溴的四氯化碳溶液退色這一問題,范夢怡、劉鸝認為,醛類物質必須要含有能與溴反應的官能團,才能使溴的四氯化碳溶液退色[1]。董順、肖中榮則直接指出乙醛不能使溴的四氯化碳溶液退色[2,3]。魯科版教學用書上則表述:乙醛不能使溴的四氯化碳溶液退色[4]。由此可見“乙醛不能使溴的四氯化碳溶液退色”這一認識在重要中學教學期刊,甚至教學參考書中也具有一定的普遍性。
3 實驗驗證方法
高中實驗室無純乙醛原因為:純乙醛沸點為20.8℃,極易氣化,資料顯示乙醛純度越高越容易出現聚合而生成三聚乙醛,此反應伴隨放出大量的熱,易引發爆炸,存在危險性。高中實驗室不具備保存純乙醛條件,所以有關乙醛的實驗均使用40%的乙醛水溶液來代替純乙醛。由此導致的問題是:很難獲取純乙醛。筆者曾在冬季氣溫-20℃,室內16℃,采用蒸餾的方法(自來水冷卻,水溫11℃)獲取到極少量液態乙醛,其揮發速度很快,還未進行除水處理就已完全揮發。而在氣溫稍高時就無法通過蒸餾(自來水冷卻)得到液態乙醛。這就是乙醛能否使溴的四氯化碳溶液退色這一如此簡單的問題卻難以用實驗驗證的一個原因。為解決這一難題,我們設計以下兩種方案獲取無水乙醛,探討乙醛能否使溴的四氯化碳溶液退色這一問題。
3.1 四氯化碳萃取法
取20mL 40%的乙醛溶液與20mL四氯化碳,在分液漏斗中混合搖勻,靜置十分鐘,混合液出現分層現象,下層的四氯化碳溶液渾濁,將下層溶液分液后加入已放有20g無水氯化鈣的試劑瓶中,蓋上塞子,振蕩后放置30min。待溶液變澄清取3mL乙醛的四氯化碳溶液于試管中,向其中加入0.5mL溴的四氯化碳溶液,發現溴的顏色在擴散時就開始迅速變淺,15s后完全退去。
為避免可能是氯化鈣吸水時間過短,所得溶液中仍含有水,對驗證實驗造成干擾,更換所得乙醛中干燥劑,再次用無水氯化鈣干燥,并放置一天后,重復驗證實驗,仍能觀察到溴的四氯化碳溶液退色。此實驗結果說明,無水乙醛可以使溴的四氯化碳溶液退色。
3.2 蒸餾獲取干燥液態乙醛法
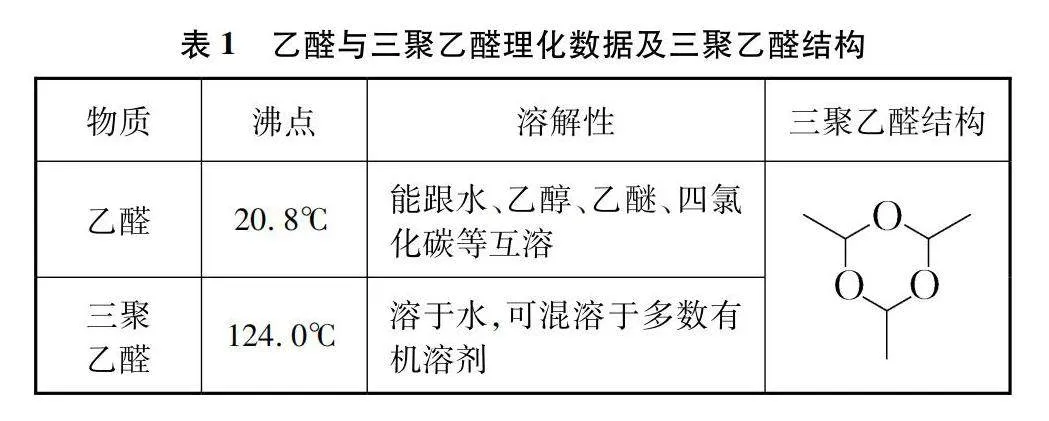
考慮到實驗3.1所得乙醛中可能含有三聚乙醛,干擾驗證實驗,所以再采取蒸餾得到純乙醛的方法進行實驗。乙醛與三聚乙醛的理化數據見表1。
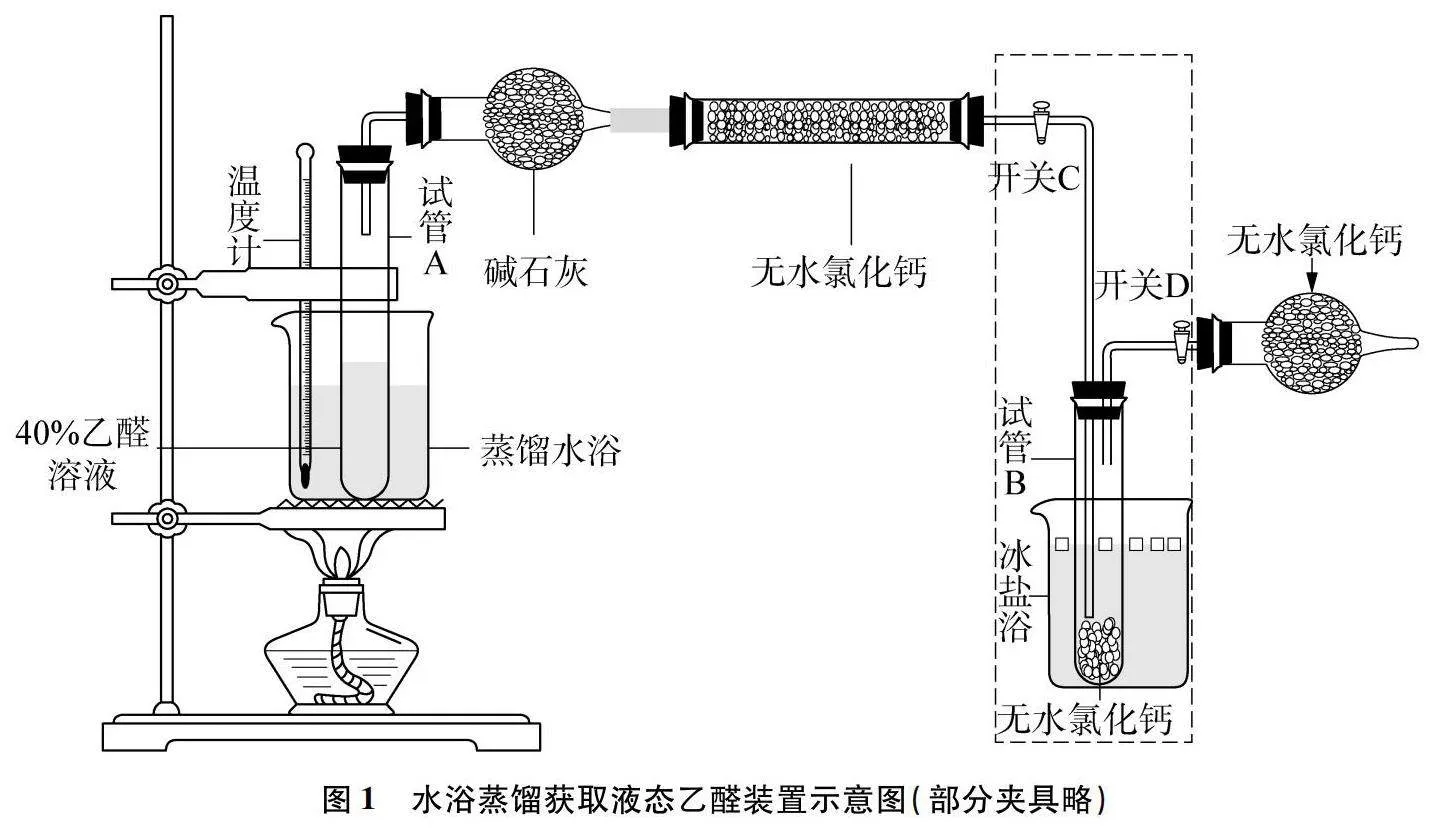
將40%乙醛溶液置于40℃水浴蒸餾(可能是溶液中乙醛與水形成氫鍵,使沸騰溫度變高,溫度低于40℃,觀察不到溶液沸騰發生),蒸餾出的乙醛先通入裝有堿石灰的干燥管,再通入裝有無水氯化鈣的干燥裝置中(如圖1),干燥后的乙醛蒸氣通入放置于冰鹽浴中裝有5g無水氯化鈣的試管中,為防空氣中的水進入,在試管與空氣連接部分接一裝有無水氯化鈣的干燥管。待試管A溶液不再沸騰時關閉開關C、D保留圖中虛線框部分并撤去其他裝置,為確保乙醛中不含水,放置30min(保持冰鹽浴狀態,否則室溫時乙醛會變為氣體)。取一只注射器取掉活栓,向針筒中加入1g無水硫酸銅,安裝好活栓,趕出氣體,將針頭插入試管B橡膠塞,從中吸取2mL乙醛(針頭長度不夠可以適當傾斜試管,乙醛取用完成后試管重新放置于冰鹽浴中),振蕩后未發現無水硫酸銅顏色變化。
說明干燥徹底,制備的液態乙醛中不含水。再取一只注射器,針頭插入試管B橡膠塞從中吸取0.5mL乙醛,取出后再迅速吸入溴的四氯化碳溶液1mL,用堵頭封閉注射器,振蕩后發現溶液顏色迅速退去,注射器中有無色氣體出現。同時將獲取的乙醛更換干燥劑在實驗室冰箱-5℃放置一天,重復上述與溴的四氯化碳溶液反應,實驗還是得到相同的結果。
為確認反應中未受三聚乙醛的干擾,先在錐形瓶中加鹽酸羥胺溶液(50g/L)15mL于冰鹽浴中放置10分鐘,取0.50mL試管B中所得乙醛加入其中,加兩滴溴酚蘭作指示劑,用0.5000mol/L氫氧化鈉標準溶液來滴定,原理為[5]:
CHCHO+NHOH·HCl=====CHCHNOH+HO+HCl
HCl+NaOH=====NaCl+HO
待達到滴定終點后再向試管中加入2.00mL 18mol/L濃硫酸作催化劑,如果體系中殘留有三聚乙醛,濃硫酸會使三聚乙醛解聚為乙醛,此時過量的鹽酸羥胺會與生成的乙醛反應,產生氯化氫。再用0.5000mol/L氫氧化鈉標準溶液來滴定體系中的酸,用第二次滴定所耗氫氧化鈉的物質的量減去作催化劑的濃硫酸所耗氫氧化鈉的物質的量,即可得出三聚乙醛解聚出的乙醛的物質的量。
實驗后發現氫氧化鈉用量恰好與用作催化劑的濃硫酸所能消耗的氫氧化鈉量相同,說明此乙醛中不含三聚乙醛,實驗中通過蒸餾的方法有效地去除了三聚乙醛的干擾。
以上實驗說明通過此方法得到純凈的乙醛,而且證明了純乙醛可以使溴的四氯化碳溶液退色。
4 乙醛使溴的四氯化碳溶液退色機理猜想
乙醛為什么能使溴的四氯化碳溶液退色呢?有以下兩種猜想:
猜想1:乙醛發生α-H取代,消耗溴單質。
乙醛分子存在α-H,因為醛基的存在,羰基吸電子誘導效應及α碳氫鍵超共軛效應使其活性較高,有可能被鹵素取代,導致溴的四氯化碳溶液顏色退去。
猜想2:醛基上的羰基與溴加成,導致溴的四氯化碳溶液退色。
由于鹵素是一個親電試劑,因此鹵素與羰基加成較難,可能性較小,這也是大多數教師認為溴不可能與乙醛加成而出現退色的原因。
5 乙醛使溴的四氯化碳溶液退色機理驗證實驗
5.1 用甲醛進行對比驗證是否與醛基有關
甲醛與乙醛的區別在于醛基上不存在α-H,如果是猜想1,則甲醛不能使溴的四氯化碳顏色退去。若為猜想2,則應與乙醛與溴的四氯化碳溶液反應現象完全相同。
分別取20mL 35%的甲醛溶液及20mL四氯化碳,在分液漏斗中混合振蕩靜置十分鐘后分液。將下層溶液置于裝有20g無水氯化鈣的試劑瓶中,放置30分鐘。取3mL溶液于試管中,向其中滴加0.5mL溴的四氯化碳溶液,溶液不退色。減少溴的四氯化碳溶液的用量,發現依然不退色。三小時后觀察,顏色仍然沒有退去。說明不是含有醛基就可以使溴的四氯化碳溶液退色,猜想2不成立。
5.2 對反應后是否有HBr氣體產生進行驗證
對3.2實驗中乙醛與溴的四氯化碳溶液反應時注射器中產生的無色氣體檢測發現,該氣體能使濕潤的藍色石蕊試紙變紅,將無色氣體導入硝酸銀溶液中發現溶液中出現淡黃色沉淀,說明乙醛與溴的四氯化碳溶液反應生成了溴化氫。
對比實驗結果說明乙醛使溴的四氯化碳溶液退色原因:發生了α-H溴代,并未發生醛基加成。
6 乙醛α-H取代機理
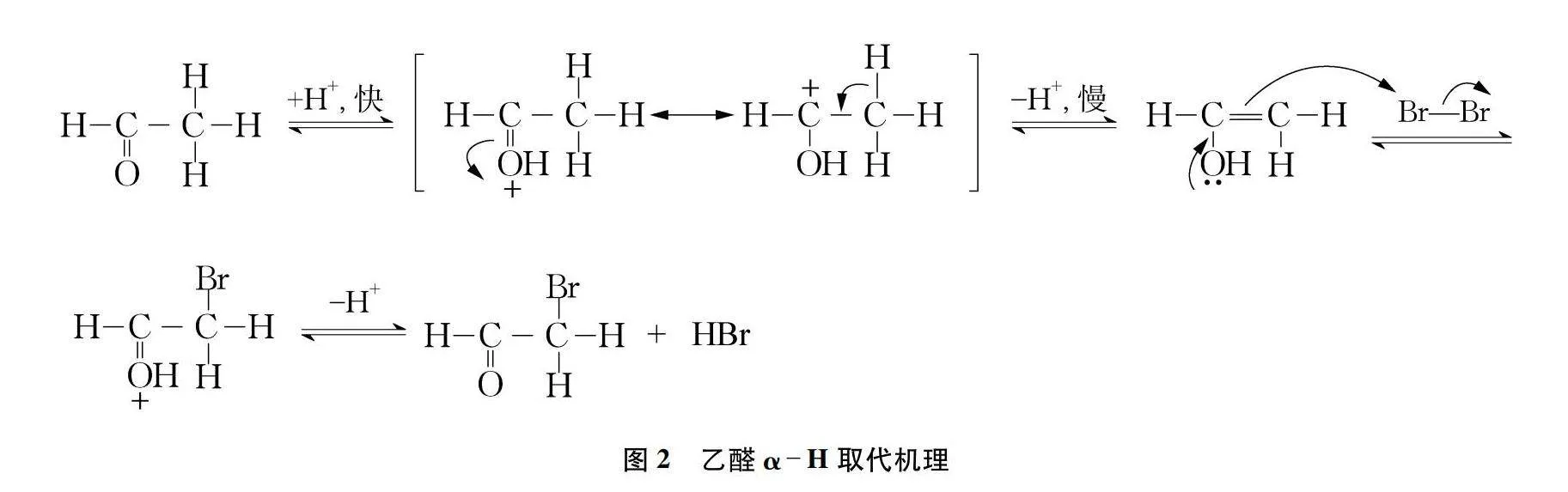
推斷上述猜想1的反應機理(見圖2):首先,酸催化下羰基質子化,繼而烯醇化,烯醇的π電子向溴單質進攻,形成碳溴鍵,再失去氧上的質子完成溴化反應[6]。
反應雖然要求酸性條件,但是在邢其毅《有機化學》第四版中對α-H鹵化反應中酸催化的表述為:所謂酸催化,通常不加酸,只要反應開始,就產生酸,此酸可自動發生催化反應[7]。反應時先進行一個誘導階段,乙醛α-H取代開始以后再產生大量的質子就可以使α-H溴代反應順利進行,實驗中沒有加酸而直接反應與此原理一致。
化學是基于實驗的學科,從以上實驗事實可以得出結論:乙醛能使溴的四氯化碳溶液退色。退色原因為發生α-H溴代——其實,在化工生產中用乙醛與氯氣直接混合制備一氯乙醛已有相當長的時間[8],說明鹵素與乙醛發生α-H取代是很容易的。
參考文獻:
[1]范夢怡,劉鸝.聚焦“證據推理與模型認知”:內涵探析及其培育案例——以“葡萄糖”教學為例[J].化學教學,2022,(5):33~39.
[2]董順.乙醇使溴水褪色的實驗探究[J].化學教學,2014,(10):55~56.
[3]肖中榮.四氯化碳在化學實驗中的妙用[J].化學教育,2012,33(5):63~64.
[4]王磊主編.普通高中課程標準實驗教科書·有機化學基礎(選修)教師用書(第4版)[M].濟南:山東科學技術出版社,2012:164.
[5]劉敏.提高乙醛收率及純度的改進方法的研究[D].長春:吉林大學碩士學位論文,2016.
[6][7]邢其毅,裴偉偉,徐瑞秋,裴堅.基礎有機化學(第4版)[M].北京:北京大學出版社,2016:480.
[8]梁誠.一氯乙醛生產與應用[J].中國氯堿,2000,(8):34~35.

