線粒體質量控制對畜禽氧化應激影響的研究進展
摘 要: 在畜牧生產中,氧化應激是一種常見的生理現象,可影響畜禽生長、健康和生產性能。線粒體作為細胞內主要的能量產生中心和氧化應激的主要靶標,其質量控制對于維持細胞內氧化還原平衡至關重要。本文綜述了線粒體質量控制對畜禽氧化應激影響的研究進展,包括作用機制、相關調節途徑以及在畜禽生產中的應用前景,旨在為畜禽養殖業中應對氧化應激問題提供參考。
關鍵詞: 線粒體;線粒體功能障礙;線粒體質量控制;氧化應激;抗氧化
中圖分類號:S852.5
文獻標志碼:A
文章編號: 0366-6964(2024)09-3769-08
Research Progress on the Impact of Mitochondrial Quality Control on Oxidative Stress
in Livestock and Poultry
YANG" Shuo, HUO" Min, SU" Zixuan, SHI" Yuxiang*
(College of Life Science and Food Engineering, Hebei University of Engineering, Handan 056038,
China)
Abstract: "In livestock and poultry production, oxidative stress is a common physiological phenomenon that can affect their growth, health, and productivity. Mitochondria, as the primary energy-generating centers within cells and the major targets of oxidative stress, play a crucial role in maintaining intracellular redox balance. This article provides a comprehensive review of the research progress on the impact of mitochondrial quality control on oxidative stress in livestock and poultry. The review includes discussions on molecular mechanisms, related regulatory pathways, and potential applications in livestock and poultry production. The aim is to provide valuable insights into oxidative stress management in the livestock and poultry industry.
Key words: mitochondria; mitochondrial dysfunction; mitochondrial quality control; oxidative stress; antioxidant
*Corresponding author: SHI Yuxiang,E-mail:hdyxshi@126.com
現代農業的集約化顯著提升了畜牧業的生產力和經濟效益。然而,畜禽的生理狀態受到多種因素的影響,如高飼養密度、高溫、衛生條件低、疾病刺激和管理不當等,這些因素容易觸發機體氧化應激反應,不僅直接影響畜禽的生長發育,還可能導致免疫系統功能的下降,增加疾病的發生率,從而對畜禽的健康狀況和生產性能構成威脅[1]。研究發現,線粒體作為細胞內的能量生產中心,其功能的穩定直接關系到畜禽的生理狀態,而且氧化應激可能通過影響線粒體的功能,進而干擾能量代謝和細胞穩態,加劇畜禽面臨的各種應激反應[2]。
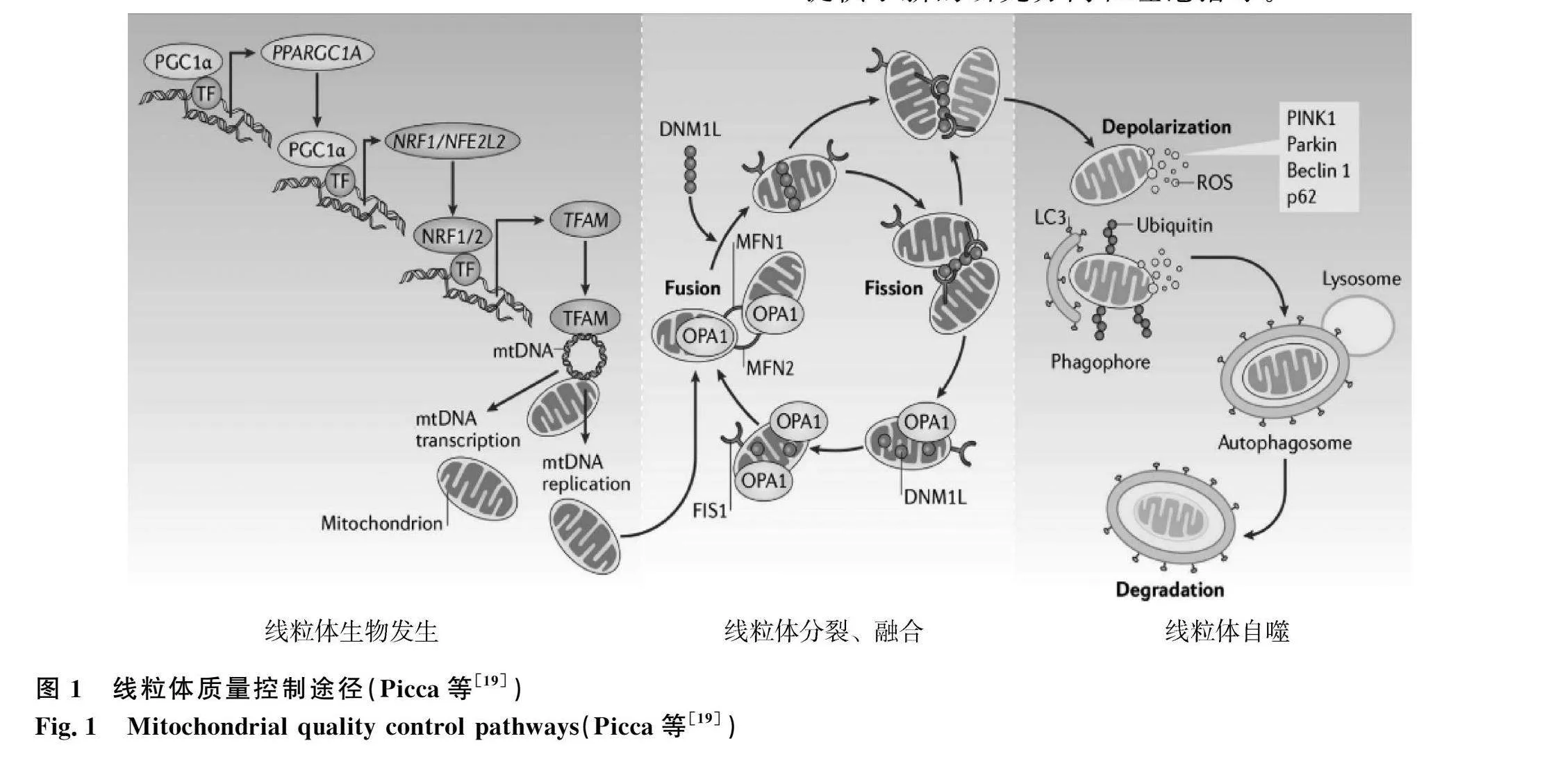
線粒體具有標志性的雙膜結構,其外膜(OMM)形成了線粒體與細胞質之間的物理屏障,有利于維持線粒體形態的完整性。線粒體內膜(IMM)承載著電子傳遞鏈、三磷酸腺苷合成酶、腺苷酸轉位酶等重要酶系統,能夠介導呼吸鏈復合物之間的電子轉移,最終促進ATP的合成[3-4]。作為細胞內的重要細胞器,線粒體在調控細胞凋亡、氧化還原平衡、信號轉導、能量代謝及其他代謝過程中發揮重要作用[5-6]。研究發現,受外界因素影響會造成畜禽細胞中大量線粒體結構異常,細胞中活性氧(ROS)過多積累,進一步損害線粒體DNA(mtDNA)及蛋白質,引起自身功能障礙[7]。線粒體質量控制是一種細胞內調節機制,主要包括線粒體生物發生、分裂與融合、線粒體自噬,是維持線粒體結構、生理功能和數量的核心。當細胞面臨各種應激時,通過自身一系列復雜的適應性反應,以確保線粒體正常參與細胞代謝和生存[8]。線粒體質量控制不僅能夠參與畜禽氧化應激、固有免疫和腸道健康等方面的調控,而且是維持線粒體正常功能的主要保障之一[7]。因此,維持線粒體健康穩態、緩解線粒體損傷已成為保障畜禽健康的重要手段。針對線粒體質量控制的研究策略對于畜禽養殖具有重要的現實意義。
1 氧化應激與線粒體質量控制的關系
近年來,氧化應激對畜禽健康養殖方面的不良影響逐漸得到關注。當機體產生過多的ROS或自身抗氧化能力不足時,ROS可引發細胞DNA、蛋白質及內源性脂質的氧化損傷,從而造成氧化應激反應[9]。諸多研究表明,當機體代謝異常導致ROS未能及時清除時,線粒體自身(mtDNA、線粒體蛋白或酶等)將最先受到損傷,誘發脂質過氧化,從而導致線粒體功能紊亂。這一狀況將引發級聯反應,包括產生更少的ATP和更多的ROS,最終進一步加劇氧化應激的程度,形成惡性循環,對細胞健康產生負面影響,導致細胞凋亡,影響畜禽健康狀況[10-12]。線粒體在調控機體緩解氧化應激損傷中發揮著關鍵性作用,其中線粒體生物發生是一個復雜的過程,是指線粒體通過生長和分化產生新的線粒體,以維持線粒體的數量和生理功能,并且能夠介導受損線粒體的清除,對細胞耗氧量及氧化應激產生影響[13]。線粒體生成后在機體細胞內形成復雜的網絡,連接更小的功能單位,用于維持線粒體的正常結構及功能。為了維持細胞的能量平衡、適應外界刺激并保持自身健康,線粒體通過調節分裂和融合的平衡來適應不同的生理狀態,這一過程被稱為線粒體動力學[14]。線粒體的分裂和融合有助于清除受損線粒體和降低ROS產生,從而在調節氧化應激方面發揮著重要作用[15]。自噬是一種通過溶酶體降解功能受損或失調的線粒體的過程,與多種病理過程相關,如炎癥、氧化應激、免疫反應等。當線粒體受損或出現功能障礙時,自噬起到了至關重要的作用,它能夠促進對生理性受損線粒體的清除[16]。這種自噬機制有助于維持線粒體的健康狀態,保護細胞免受應激條件的影響。研究表明,在生理或病理條件下,線粒體質量控制系統在蛋白質和細胞器水平上均發揮著積極的作用,致力于保護線粒體免受應激和損傷[17]。由此可見,該系統通過調控線粒體質量及數量,維持自身正常功能并滿足機體細胞生命活動,在調控細胞穩態方面具有重要作用。
1.1 線粒體生物發生與氧化應激
正常生理過程中,線粒體是一個動態變化的細胞器,其形態、數量及功能通過線粒體穩態來實現。研究發現,線粒體穩態的維持主要依賴于線粒體生物發生和線粒體自噬這兩個關鍵途徑的協同調控[18]。具體而言,線粒體生物發生調控過程受到多種轉錄因子的共同調節。這些關鍵因子包括過氧化物酶體增殖物激活受體-γ輔激活因子-1α(PGC-1α)、核呼吸因子1/2(NRF1、NRF2)及線粒體轉錄因子A(TFAM)等。它們通過調控mtDNA的復制和線粒體蛋白的合成,推動新線粒體的生成,從而維持線粒體的形態和功能的穩定[19]。研究發現,PGC-1α-Nrf1-TFAM信號通路是控制線粒體脫氧核糖核酸及新線粒體產生的主要信號途徑[20]。PGC-1α作為線粒體生物發生的核心調控因子,不僅參與調控線粒體的形成和功能,同時在細胞整體的能量代謝和氧化還原平衡中扮演著關鍵角色。其通過與其他轉錄因子和共激活因子形成復雜的網絡相互作用,調節細胞對線粒體數量和功能的適應[21]。在線粒體生物合成過程中,PGC-1α通過調控下游NRF1、NRF2和TFAM等轉錄因子的活性,引導PINK1激活受損線粒體中的蛋白質合成。此外,PGC-1α還與芳基烴受體等配體激活的轉錄因子相互作用,增強線粒體生物發生的過程[22]。這一調控機制不僅有助于維持線粒體的正常功能,而且在保護細胞免受氧化應激影響方面具有重要作用。
體外試驗研究發現,添加ZLN005(PGC-1α激活劑)處理后,PGC-1α、NRF1和TFAM蛋白的表達得到提高,從而緩解β-羥丁酸(BHBA)誘導的線粒體損傷。此外,添加ZLN005處理后激活了PGC-1α的表達,顯著降低BHBA誘導的ROS水平升高、線粒體膜電位的降低及凋亡率的上升。而經SR-18292(PGC-1α抑制劑)處理后則表現出與上述現象相反的結果。這一結果證實了PGC-1α在調控線粒體功能障礙中發揮著關鍵作用,且能夠有效緩解BHBA誘導的奶牛乳腺上皮細胞氧化應激反應[23]。歐陽經鑫[24]的研究發現,熱應激處理顯著增加機體ROS含量,并降低肉雞肝組織中PGC-1α和mtDNA的基因表達,引起線粒體氧化應激,生物合成功能受到影響。主要原因可能是,PGC-1α表達的降低會引起抗氧化酶SOD2、GSH-Px和CAT表達下調,破壞了細胞氧化還原平衡,導致細胞線粒體功能障礙。然而,當日糧中補充0.18%色氨酸時,可以顯著提高肉雞肝中線粒體結構的完整性,使其內部電子密度更均勻,有效緩解了熱應激引起的肉雞肝氧化損傷[24]。這可能是由于色氨酸能夠通過增加肝組織中PGC-1α、TFAM及mtDNA的基因表達,從而增強了線粒體的生物發生作用[25]。Baur等[26]研究發現,向高脂飲食小鼠飼糧中補充白藜蘆醇可顯著激活肝中PGC-1α的表達,進一步誘導線粒體數量增加,對緩解氧化應激有積極作用。據報道,在氧化應激的狀態下,mtDNA更容易成為ROS的攻擊目標。這一過程不僅使mtDNA 受損,還進一步加劇mtDNA 氧化的惡性循環,導致線粒體結構破壞、PGC-1α表達降低,最終引發線粒體的功能紊亂。通過調節與線粒體生物發生相關的因子,如PGC-1α等,可能為緩解氧化應激引起的線粒體損傷提供有力支持[27]。另外,NO作為一種信號分子可以通過調控可溶性鳥苷酸環化酶信號途徑激活PGC-1α,與羥基自由基反應減少對細胞的損傷,進而緩解因氧化應激造成的線粒體呼吸受損、細胞凋亡和壞死[28]。崔伶歌[29]研究發現,鄰苯二甲酸二(2-乙基己基)酯(DEHP)處理能夠造成鵪鶉小腦組織中線粒體生物發生相關因子的mRNA水平及蛋白表達量均有不同程度的降低,而且能夠抑制小鼠肝組織線粒體生物發生,進一步加劇肝氧化受損[30]。綜合以上研究表明,通過調節線粒體生物發生介導的線粒體質量控制有利于維持線粒體的數量和功能,從而達到緩解氧化損傷的目的。
1.2 線粒體動力學與氧化應激
線粒體動力學與氧化應激之間存在密切的關系。當細胞受到氧化應激影響時,線粒體形態、數量和位置等在動力學作用下發生一系列的調節,以此為細胞提供一種適應性的機制,從而維持線粒體的功能并減輕氧化應激對細胞的不良影響[31]。在線粒體分裂中,動力相關蛋白(Drp1)是一個關鍵的蛋白,它在分裂的起始階段發揮著重要作用。Drp1通過與線粒體外膜上的蛋白分裂蛋白1(Fis1)結合,形成螺旋形的結構,從而收縮并最終導致線粒體分裂[32]。這個過程不僅有助于清除受損的線粒體,還能夠產生新的、功能完整的線粒體結構。線粒體融合是一個復雜的細胞過程,其關鍵融合蛋白包括線粒體融合蛋白1(Mfn1)、Mfn2和視神經萎縮蛋白1(Opa1)。在線粒體融合過程中,Mfn1和Mfn2參與外膜的融合,而Opa1則在內膜上發揮關鍵作用。通過這種協同作用,受損線粒體和正常線粒體之間的物質和信息可以重新分布,有助于維持整體線粒體群的穩態[33]。線粒體融合與分裂之間的動態平衡在維持細胞內環境穩態以及應對各種應激反應中發揮關鍵性作用。當細胞面臨氧化應激時,細胞內的ROS水平顯著升高,這可能導致線粒體的功能受損。為了應對這種情況,線粒體通過調節融合和分裂的平衡來進行動態調整。線粒體融合有助于混合受損線粒體的內容物,從而提高其整體功能,同時分裂則能夠剔除功能受損的部分,以維持線粒體的健康狀態。
氧化應激引發的線粒體形態和數量的改變不僅僅是細胞內部的調節響應,更是畜禽對外部刺激的一種適應性反應。在氧化應激條件下,線粒體往往經歷著形態的變化,包括增大、膜結構的破裂以及線粒體的增生等,通過上述方式調整其結構以適應環境的變化。這種形態的靈活性是線粒體應對氧化應激的一種保護性機制,通過改變形態來優化線粒體的功能,提高對氧化應激的抵抗能力。如:鄰苯二甲酸二酯能夠誘導小鼠心臟線粒體動力學紊亂,造成小鼠線粒體疾病的發生,而日糧中添加番茄紅素可通過調節線粒體分裂、融合,最終實現對心臟的保護作用[34]。由此可見,番茄紅素有利于受損線粒體的融合過程,這一過程對于維持線粒體的完整性和功能至關重要;另一方面,在番茄紅素作用下,細胞通過促使線粒體分裂,將受損線粒體與正常線粒體分隔開,從而降低受損線粒體對細胞的有害影響。因此,番茄紅素可能成為線粒體相關疾病的潛在預防和治療手段。畜禽飼養過程常因飼料菌素(黃曲霉毒素、玉米赤霉烯酮等)的影響誘發腸道氧化應激損傷。添加具有抗氧化功能的添加劑,能夠通過維持機體線粒體動力學平衡,阻止毒素的毒性作用,最終緩解肝及腸道組織氧化損傷[35]。另有研究發現,犢牛缺硒情況下會造成肝組織氧化中間產物積累,肝線粒體Mfn2及Opa1表達顯著下調并促進線粒體過度分裂,進一步增加促凋亡基因的表達,最終導致犢牛肝損傷[36]。而當飼料中補充硒后,能夠有效緩解犢牛肝線粒體過度裂變,并上調Mfn2和Opa1基因的表達,使肝組織氧化應激反應得到緩解。馬冰珂[37]研究發現,二氫楊梅素能夠通過降低肝線粒體分裂蛋白Drp1、Fis1的基因表達,并顯著增加融合蛋白Mfn1、Mfn2及Opa1基因表達水平,使線粒體融合-分裂關鍵蛋白表達趨于正常,降低細胞內ROS的產生,增強機體抗氧化能力,進而有效緩解由脂多糖(LPS)誘導的雛雞肝氧化損傷。另外,受急性熱應激影響,蛋鴨卵巢細胞凋亡水平增加,在線粒體水平,關鍵融合蛋白Mfn1、Mfn2和OPA1的表達顯著降低,同時線粒體分裂蛋白Drp1增加[38]。因此推測,線粒體分裂和融合的紊亂可能是造成蛋鴨卵巢氧化應激進一步加重的關鍵因素之一。體外試驗結果進一步證實,LPS誘導的氧化應激能夠導致H9C2心肌細胞線粒體呼吸功能減弱,線粒體膜電位(MMP)水平降低,然而抑制Drp1/Fis1的相互作用可以緩解LPS介導的細胞氧化應激,改善線粒體功能[39]。由此推測,深入研究線粒體動力學與畜禽氧化應激之間的相互作用,不僅可以揭示細胞內部復雜的調控網絡,也有望為制定畜禽健康和疾病治療的策略提供更為準確和有效的指導。
1.3 線粒體自噬與氧化應激
當機體面臨氧化應激時,線粒體自噬是一種重要的細胞自我保護機制,旨在清除受損或異常的線粒體,從而維持整體細胞的健康狀態[40]。自噬過程中,細胞可以迅速清除存在潛在危害的線粒體,減少活性氧物質在細胞質中的釋放,從而有效緩解氧化應激和其他損傷,以維護細胞內的線粒體質量和功能。氧化應激導致細胞內產生大量的ROS,其中包括線粒體內部產生的ROS容易導致線粒體內膜的氧化損傷,影響線粒體的膜電位和通透性,進而引發線粒體的功能異常和結構破壞[41]。研究發現,過度的氧化應激可直接激活線粒體自噬,從而干擾正常的自噬程序。然而,自噬也可以為保持線粒體穩態提供能量,并緩解由氧化應激引起的損傷,從而有助于維持細胞內線粒體的質量和功能[42]。氧化應激條件下,細胞內的線粒體自噬過程會被啟動,這一過程通常受到多個信號通路的調控。PTEN誘導激酶1(PINK1)/帕金蛋白(Parkin)通路是線粒體自噬的主要調控途徑之一[43]。PINK1是一種蛋白激酶,其合成發生于細胞質。在正常的線粒體生物發生過程中,PINK1被合成后經由外膜轉運酶的作用,順利地轉運到線粒體膜間隙。然后,通過線粒體加工肽酶(MPP)和早老素相關菱形樣蛋白(PARL)的裂解作用,PINK1被切割形成剪切體,然后被迅速降解[44]。這一過程保證了線粒體的正常生物發生,同時避免了不必要的蛋白積累。然而,當細胞受到氧化應激的刺激時,線粒體膜電位會降低,導致PINK1無法正常向內膜轉運,其降解減緩,從而使PINK1在線粒體外膜聚集[45]。這種狀態下,PINK1的聚集作用將Parkin蛋白吸引到受損的線粒體上,發揮著線粒體損傷的傳感器作用。Parkin是一種E3泛素連接酶,一旦被招募或激活,它進一步誘導p62蛋白的聚集,并與微管相關蛋白1輕鏈3(LC3)特異性結合,從而介導線粒體的自噬[46]。通過PINK1和Parkin的協同作用,細胞可以有效地應對氧化應激等損傷,維持線粒體的正常功能和數量,從而確保細胞的健康和穩態[47]。
前期研究發現,敲除果蠅PINK1和Parkin基因會引起機體線粒體穩態的失衡,使細胞更容易受到氧化應激攻擊[48-49]。羅云彥[50]研究發現,通過介導豬空腸PINK1和Parkin等相關自噬蛋白的表達,可以激活線粒體自噬,提高腸道抗氧化酶(T-SOD、CAT和GSH-Px)基因表達及ATP產量,增強育肥豬抗氧化能力。郭紅等[51]研究表明,槲皮素預處理可以激活PINK1/Parkin依賴的線粒體自噬,降低阿霉素誘導的乳鼠心肌原代細胞ROS生成,促進線粒體ATP生成,緩解氧化應激誘導的DNA損傷。王春玲等[52]研究發現,烏梅總黃酮參與調控6-羥基多巴胺合溴化氫誘導的大鼠腦組織損傷中線粒體自噬水平,促進線粒體自噬,顯著修復腦線粒體功能損傷。在單胃動物中的研究發現,通過作用線粒體自噬 Parkin 信號通路可緩解仔豬腸道氧化應激損傷[53]。如:日糧中添加白藜蘆醇能顯著提高豬空腸中PINK1、Parkin、LC3 mRNA的表達水平及蛋白表達水平,并顯著降低了p62 mRNA及蛋白的表達水平[54],進一步激活線粒體自噬,這與之前的研究結果[2]一致。體外試驗結果表明,氧化應激顯著降低IPEC-J2細胞中PINK1、Parkin、LC3 mRNA和蛋白表達水平。通過干擾Parkin基因進一步研究發現,白藜蘆醇可顯著降低氧化應激條件下IPEC-J2細胞ROS含量,而干擾Parkin后白藜蘆醇降低ROS的作用被顯著抑制[55]。由此表明,線粒體自噬作為一種重要的細胞內調控機制復雜且精細,在應對氧化應激中發揮著重要的保護作用,從線粒體防御、修復、清除、更替等多個層面維護著細胞內環境穩態[56]。
2 展 望
本綜述旨在深入探討線粒體質量控制對氧化應激的調控機制,從而更全面地理解其在畜禽健康中的作用。線粒體質量控制作為一個復雜而龐大的系統,其內部不同信號通路之間相互交織、相互影響,構成了一個多層次的調控網絡。本文聚焦于線粒體質量控制的三個主要過程(圖1),闡述其與氧化應激之間的密切關系。這不僅有助于深入理解氧化應激對畜禽健康的影響機制,也為緩解畜禽氧化應激提供了新的研究方向和理論指導。
參考文獻(References):
[1] GONZALEZ-RIVAS P A,CHAUHAN S S,HA M,et al.Effects of heat stress on animal physiology,metabolism,and meat quality:a review[J].Meat Sci,2020,162:108025.
[2] ZHA C,XIAO H,SONG B,et al.Resveratrol promotes mammary cell proliferation and antioxidation capacity during pregnancy and lactation in mice[J].J Appl Microbiol,2021,130(2):450-463.
[3] KLECKER T,WESTERMANN B.Pathways shaping the mitochondrial inner membrane[J].Open Biol,2021,11(12):210238.
[4] 王 鑫,聶 桐,李阿群,等.橙皮苷通過氧化磷酸化途徑緩解高脂飼喂誘導的小鼠肝氧化應激[J].畜牧獸醫學報,2024,55(3):1302-1313.
WANG X,NIE T,LI A Q,et al.Hesperidin alleviates high-fat-diet induced hepatic oxidative stress in mice via oxidative phosphorylation pathway[J].Acta Veterinaria et Zootechnica Sinica,2024,55(3):1302-1313.(in Chinese)
[5] ROSSMANN M P,DUBOIS S M,AGARWAL S,et al.Mitochondrial function in development and disease[J].Dis Models Mech,2021,14(6):dmm048912.
[6] 楊 雪,楊 超,王 拙,等.日糧添加酵母硒對雞肉線粒體氧化損傷及細胞凋亡的影響[J].畜牧獸醫學報,2022,53(9):3079-3092.
YANG X,YANG C,WANG Z,et al.Effect of dietary supplementation of yeast selenium on mitochondrial oxidative damage and apoptosis of chicken[J].Acta Veterinaria et Zootechnica Sinica,2022,53(9):3079-3092.(in Chinese)
[7] MELSER S,LAVIE J,BNARD G.Mitochondrial degradation and energy metabolism[J].Biochim Biophys Acta Mol Cell Res,2015,1853(10):2812-2821.
[8] ZHONG J K,TAN Y,LU J H,et al.Therapeutic contribution of melatonin to the treatment of septic cardiomyopathy:a novel mechanism linking Ripk3-modified mitochondrial performance and endoplasmic reticulum function[J].Redox Biol,2019,26:101287.
[9] CHAUHAN S S,RASHAMOL V P,BAGATH M,et al.Impacts of heat stress on immune responses and oxidative stress in farm animals and nutritional strategies for amelioration[J].Int J Biometeorol,2021,65(7):1231-1244.
[10] HE Y L,SANG Z,ZHUO Y S,et al.Transport stress induces pig jejunum tissue oxidative damage and results in autophagy/mitophagy activation[J].J Anim Physiol Anim Nutr (Berl),2019,103(5):1521-1529.
[11] ZHANG Q,ZHANG C,GE J,et al.Ameliorative effects of resveratrol against cadmium-induced nephrotoxicity via modulating nuclear xenobiotic receptor response and PINK1/Parkin-mediated Mitophagy[J].Food Funct,2020,11(2):1856-1868.
[12] SUHN K,HYEYOUNG K.Inhibitory effect of Astaxanthin on oxidative stress-induced mitochondrial dysfunction-A mini-review[J].Nutrients, 2018, 10(9):1137-1151.
[13] POPOV L D.Mitochondrial biogenesis:an update[J].J Cell Mol Med,2020,24(9):4892-4899.
[14] YANG Q W, YANG J J, LIU X S,et al.Crosstalk between the mitochondrial dynamics and oxidative stress in Zinc-induced cytotoxicity[J].Biol Trace Elem Res. 2023,201(9):4419-4428.
[15] KILLACKEY S A,PHILPOTT D J,GIRARDIN S E.Mitophagy pathways in health and disease[J].J Cell Biol,2020,219(11):e202004029.
[16] D’ONOFRIO N,MARTINO E,MELE L,et al.Colorectal cancer apoptosis induced by dietary δ-valerobetaine involves PINK1/parkin dependent-mitophagy and SIRT3[J].Int J Mol Sci,2021,22(15):8117.
[17] YOO S M,JUNG Y K.A molecular approach to mitophagy and mitochondrial dynamics[J].Mol Cells,2018,41(1):18-26.
[18] PLOUMI C,DASKALAKI I,TAVERNARAKIS N.Mitochondrial biogenesis and clearance:a balancing act[J].FEBS J,2017,284(2):183-195.
[19] PICCA A,MANKOWSKI R T,BURMAN J L,et al.Mitochondrial quality control mechanisms as molecular targets in cardiac ageing[J].Nat Rev Cardiol,2018,15(9):543-554.
[20] KUCZYNSKA Z,METIN E,LIPUT M,et al.Covering the role of PGC-1α in the nervous system[J].Cells,2022,11(1):111.
[21] MOOTHA V K,LINDGREN C M,ERIKSSON K F,et al.PGC-1α-responsive genes involved in oxidative phosphorylation are coordinately downregulated in human diabetes[J].Nat Genet,2003,34(3):267-273.
[22] HASEGAWA K,YASUDA T,SHIRAISHI C,et al.Promotion of mitochondrial biogenesis by necdin protects neurons against mitochondrial insults[J].Nat Commun,2016,7:10943.
[23] 宋 倩.PGC-1α介導的線粒體功能紊亂對酮病奶牛乳腺組織凋亡的調節機制[D].大慶:黑龍江八一農墾大學,2023.
SONG Q.The regulatory mechanism of PGC-1α-mediated mitochondrial dysfunction on apoptosis of mammary gland tissues in ketotic cows[D].Daqing:Heilongjiang Bayi Agricultural University,2023.(in Chinese)
[24] 歐陽經鑫.飼糧添加色氨酸對熱應激肉雞抗氧化能力、線粒體生物合成作用及炎癥反應的影響[D].南昌:江西農業大學,2022.
OUYANG J X.Effects of dietary tryptophan supplementation on antioxidant capacity,mitochondrial biogenesis and inflammatory response of heat-stressed broilers[D].Nanchang:Jiangxi Agricultural University,2022.(in Chinese)
[25] ZHANG G M,DENG M T,ZHANG Y L,et al.Effect of PGC-1α overexpression or silencing on mitochondrial apoptosis of goat luteinized granulosa cells[J].J Bioenerg Biomembr,2016,48(5):493-507.
[26] BAUR J A,PEARSON K J,PRICE N L,et al.Resveratrol improves health and survival of mice on a high-calorie diet[J].Nature,2006,444(7117):337-342.
[27] VASILEIOU P V S,EVANGELOU K,VLASIS K,et al.Mitochondrial homeostasis and cellular senescence[J].Cells,2019,8(7):686.
[28] NISOLI E,CLEMENTI E,PAOLUCCI C,et al.Mitochondrial biogenesis in mammals:the role of endogenous nitric oxide[J].Science,2003,299(5608):896-899.
[29] 崔伶歌.DEHP通過誘導線粒體質量控制功能異常造成小腦毒性的研究[D].哈爾濱:東北農業大學,2022.
CUI L G.Study on DEHP-caused cerebellar toxicity via inducing abnormal mitochondrial quality control function[D].Harbin:Northeast Agricultural University,2022.(in Chinese)
[30] ZHAO Y,LI M Z,TALUKDER M,et al.Effect of mitochondrial quality control on the lycopene antagonizing DEHP-induced mitophagy in spermatogenic cells[J].Food Funct,2020,11(7):5815-5826.
[31] YANG Q Y,HAN B,XUE J D,et al.Hexavalent chromium induces mitochondrial dynamics disorder in rat liver by inhibiting AMPK/PGC-1α signaling pathway[J].Environ Pollut,2020,265:114855.
[32] PAGLIUSO A,COSSART P,STAVRU F.The ever-growing complexity of the mitochondrial fission machinery[J].Cell Mol Life Sci,2018,75(3):355-374.
[33] NI H M,WILLIAMS J A,DING W X.Mitochondrial dynamics and mitochondrial quality control[J].Redox Biol,2015,4:6-13.
[34] SHEN Y,LIU L,LI M Z,et al.Lycopene prevents Di-(2-ethylhexyl) phthalate-induced mitophagy and oxidative stress in mice heart via modulating mitochondrial homeostasis[J].J Nutr Biochem,2023,115:109285.
[35] ZHAO Y,CUI J G,ZHANG H,et al.Role of mitochondria-endoplasmic reticulum coupling in lycopene preventing DEHP-induced hepatotoxicity[J].Food Funct,2021,12(21):10741-10749.
[36] WANG S,LIU X Y,LEI L,et al.Selenium deficiency induces apoptosis,mitochondrial dynamic imbalance,and inflammatory responses in calf liver[J].Biol Trace Elem Res,2022,200(11):4678-4689.
[37] 馬冰珂.基于線粒體融合-分裂動態平衡研究二氫楊梅素對LPS致雞肝損傷的保護作用[D].哈爾濱:東北農業大學,2022.
MA B K.Protective effects of dihydromyricetin on LPS-induced chicken liver injury based on the dynamic balance of mitochondrial fusion and fission[D].Harbin:Northeast Agricultural University,2022.(in Chinese)
[38] 楊 晨.急性熱應激條件下線粒體自噬在鴨卵泡顆粒細胞中的作用與調控機制[D].廣州:仲愷農業工程學院,2022.
YANG C.Role and regulatory mechanism of mitophagy in duck follicle granulosa cells under acute heat stress[D].Guangzhou:Zhongkai University of Agriculture and Engineering,2022.(in Chinese)
[39] HAILESELASSIE B,MUKHERJEE R,JOSHI A U,et al.Drp1/Fis1 interaction mediates mitochondrial dysfunction in septic cardiomyopathy[J].J Mol Cell Cardiol,2019,130:160-169.
[40] HAN H L,TAN J Q,WANG R X,et al.PINK1 phosphorylates Drp1S616 to regulate mitophagy-independent mitochondrial dynamics[J].EMBO Rep,2020,21(8):e48686.
[41] GIACOMELLO M,PYAKUREL A,GLYTSOU C,et al.The cell biology of mitochondrial membrane dynamics[J].Nat Rev Mol Cell Biol,2020,21(4):204-224.
[42] FILOMENI G,DE ZIO D,CECCONI F.Oxidative stress and autophagy:the clash between damage and metabolic needs[J].Cell Death Differ,2015,22(3):377-388.
[43] XI J X,RONG Y Z,ZHAO Z F,et al.Scutellarin ameliorates high glucose-induced vascular endothelial cells injury by activating PINK1/Parkin-mediated mitophagy[J].J Ethnopharmacol,2021,271:113855.
[44] TANAKA K.The PINK1-parkin axis:an overview[J].Neurosci Res,2020,159:9-15.
[45] WANG Y,ZHU J F,LIU Z W,et al.The PINK1/PARK2/optineurin pathway of mitophagy is activated for protection in septic acute kidney injury[J].Redox Biol,2021,38:101767.
[46] EIYAMA A,OKAMOTO K.PINK1/parkin-mediated mitophagy in mammalian cells[J].Curr Opin Cell Biol,2015,33:95-101.
[47] YAN C J,GONG L L,CHEN L,et al.PHB2 (prohibitin 2) promotes PINK1-PRKN/Parkin-dependent mitophagy by the PARL-PGAM5-PINK1 axis[J].Autophagy,2020,16(3):419-434.
[48] WHITWORTH A J,PALLANCK L J.PINK1/Parkin mitophagy and neurodegeneration-what do we really know in vivo?[J].Curr Opin Genet Dev,2017,44:47-53.
[49] DAMIANO M,GAUTIER C A,BULTEAU A L,et al.Tissue- and cell-specific mitochondrial defect in Parkin-deficient mice[J].PLoS One,2014,9(6):e99898.
[50] 羅云彥.白藜蘆醇通過激活Parkin介導的線粒體自噬提高豬腸道抗氧化能力的作用及其機制[D].南寧:廣西大學,2022.
LUO Y Y.Effects of resveratrol on enhancing antioxidant capacity of porcine intestinal tract by activating Parkin-mediated mitochondrial autophagy and its mechanism[D].Nanning:Guangxi University,2022.(in Chinese)
[51] 郭 紅,王少瑋,謝文靜,等.槲皮素通過Pink1/Parkin信號通路減輕阿霉素心肌損傷的作用機制研究[J].中國比較醫學雜志,2022,32(7):1-9.
GUO H,WANG S W,XIE W J,et al.Protective role of Quercetin on Pink1/Parkin-dependent mitophagy against doxorubicin-induced cardiotoxicity[J].Chinese Journal of Comparative Medicine,2022,32(7):1-9.(in Chinese)
[52] 王春玲,羅 寧,文曉東,等.烏梅總黃酮通過線粒體自噬對帕金森病大鼠的保護作用[J].西部中醫藥,2022,35(12):72-76.
WANG C L,LUO N,WEN X D,et al.Protective effects of fructus mume total flavone on rat model with Parkinson’s disease through mitophagy[J].Western Journal of Traditional Chinese Medicine,2022,35(12):72-76.(in Chinese)
[53] WANG C C,CAO S T,ZHANG Q H,et al.Dietary tributyrin attenuates intestinal inflammation,enhances mitochondrial function,and induces mitophagy in piglets challenged with diquat[J].J Agric Food Chem,2019,67(5):1409-1417.
[54] ZHAO Y L,ZHOU C M,GUO X Q,et al.Exposed to mercury-induced oxidative stress,changes of intestinal microflora,and association between them in mice[J].Biol Trace Elem Res,2021,199(5):1900-1907.
[55] 張 昊.IUGR仔豬肝臟損傷與線粒體功能紊亂的機制研究及白藜蘆醇的保護作用[D].南京:南京農業大學,2017.
ZHANG H.Study of underlying mechanism of the hepatic damage and mitochondrial dysfunction of IUGR piglets and the protective effects by resveratrol[D].Nanjing:Nanjing Agricultural University,2017.(in Chinese)
[56] YU C,XIAO J H.The Keap1-Nrf2 system:a mediator between oxidative stress and aging[J].Oxid Med Cell Longev,2021,2021:6635460.
(編輯 范子娟)

