海水魚腸道中丁酸梭菌的篩選及發酵工藝優化


摘要:為對海水魚腸道中的丁酸梭菌進行分離篩選并且對其發酵工藝進行改良優化,首先利用含有RCM培養基篩選出厭氧菌株,通過革蘭氏染色、菌體形態、厭氧特性篩選出1株丁酸梭菌,對其進行16S rDNA序列和系統發育樹分析鑒定,進行單因素實驗并且在此基礎上進行正交試驗改良其發酵工藝。試驗結果顯示,經過鑒定菌株CBL1為丁酸梭菌,并確定菌株CBL1的發酵工藝最優條件為:發酵溫度為37℃、發酵時間為24 h、接種量3%、大豆蛋白胨40 g/L、葡萄糖35 g/L、碳酸氫鈉1.5 g/L、氯化鈉5 g/L、乙酸鈉3 g/L、鹽酸半胱氨酸0.5 g/L,在此條件下丁酸梭菌CBL1的發酵液活菌數為2.85×109 CFU/mL。本研究結果對水產養殖中丁酸梭菌制劑的開發具有一定的參考價值。
關鍵詞:海水魚腸道;丁酸梭菌;分離篩選;發酵工藝
中圖分類號:S965 文獻標識碼:A
水產養殖在促進全球糧食安全以及人們對優質蛋白、微量元素等營養的攝取中發揮著重要作用[1]。隨著人們對水產品的需求日益增長,水產養殖也逐漸向著集約化和多樣化的方向發展[2]。集約化的養殖方式雖然符合水產品養殖的發展方向,但是水產品的集約化養殖也導致了飼料的利用率低、環境污染嚴重、水體富營養化、疾病暴發、抗生素濫用等問題[3-6]。為了提高水產養殖的安全、促進水產品的生長,開發益生菌制劑促進水產品生長、減少疾病的暴發越來越重要[7]。
丁酸梭菌又名酪酸梭菌,是專性厭氧的革蘭氏陽性菌,廣泛存在于人類及動物腸道、糞便和土壤中,是重要的益生菌[8-9]。丁酸梭菌具備促進腸道營養物質吸收、保護腸道健康、抗氧化、抗炎、提高免疫力、抗腫瘤等功能[10-13]。目前已有研究將丁酸梭菌應用于水產養殖中以提高水產品的品質和安全,例如:徐創文等[14]發現丁酸梭菌可以提高花鱸幼魚的消化、免疫、抗氧化能力,促進幼魚生長;Meng等[15]發現丁酸梭菌可以調節鯉魚的腸道菌群,提高免疫力;Bi等[16]研究表明丁酸梭菌H129可以提高大菱鲆的免疫力,減少疾病的發生;Wang等[17]研究表明丁酸梭菌可以增強南美白對蝦對弧菌的抵抗能力。綜上所述,丁酸梭菌在水產養殖領域具有巨大的潛力和應用市場。
但目前有關從海水魚腸道分離丁酸梭菌的報道較少,從魚腸道分離的丁酸梭菌可能對水產養殖具有更好的適應性。本研究從海水魚腸道中分離篩選丁酸梭菌,并對其液體發酵工藝進行優化,為其在水產養殖中的應用提供支持。
1 材料與方法
1.1 材料
1.1.1 樣品
湛江市售的海水魚。
1.1.2 培養基、試劑
梭菌增菌肉湯(RCM肉湯)、梭菌增菌培養基(RCM培養基),北京陸橋技術股份有限公司;液體石蠟、HCl,化學純,西隴化工股份有限公司;胃蛋白酶,上海源葉生物科技有限公司;蔗糖、葡萄糖、果糖、乳糖、可溶性淀粉,分析純,西隴科學股份有限公司;蛋白胨、胰蛋白胨、大豆蛋白胨,生化試劑,上海源葉生物科技有限公司;牛肉膏、酵母膏、碳酸氫鈉,上海麥克林生化科技有限公司;2×MightyAmp Buffer Ver.2(Mg2+,dNTP plus)、MightyAmp DNA Polymerase Ver.2、DL 2000 DNA Marker,寶生物工程(大連)有限公司;50×TAE緩沖液,生工生物工程(上海)股份有限公司;Ultra GelRed(10000×),南京諾唯贊生物科技股份有限公司。
1.1.3 實驗儀器
C-32.5L型密封培養罐,日本三菱MGC公司;Genbag型厭氧產氣袋,法國梅里埃集團;SW-CJ-2F型潔凈工作臺,博訊實業有限公司醫療設備廠;SPX-250-II型生化培養箱,上海躍進醫療器械有限公司;Varioskan型全自動酶標儀,賽默飛世爾科技公司;DYY-8C型電泳儀,北京六一生物科技有限公司;A300型基因擴增儀,由杭州朗基科學儀器有限公司生產;ZF-20D型暗箱式紫外分析儀,由鞏義市予華儀器有限責任公司生產;DYY-8C型電泳儀,由北京六一生物科技有限公司生產。
1.2 方法
1.2.1 丁酸梭菌的篩選
用無菌剪刀剪碎海水魚腸道,混合均勻,取10 g海水魚腸道樣品加入100 mL RCM肉湯(液體石蠟液封,封口膜隔絕氧氣)中,于37℃厭氧富集培養24 h。采用梯度稀釋法依次稀釋至10-5、10-6、10-7,分別取100 μL涂布于RCM培養基中,用封口膜隔絕氧氣,放入厭氧袋中,37℃恒溫培養箱靜置培養24 h。挑取單菌落采用四區劃線法進行分離純化直至得到純化單菌落,于4℃保存備用。
1.2.2 丁酸梭菌的鑒定
1.2.1.1丁酸梭菌的菌落形態鑒定
挑取丁酸梭菌單菌落點種于RCM培養基上,37℃厭氧培養24 h,觀察其菌落顏色、形態、透明度、大小、氣味等,并且進行革蘭氏染色。
1.2.1.2丁酸梭菌的分子鑒定
用牙簽挑取純化后單菌落的丁酸梭菌進行16S rDNA序列擴增。引物為細菌通用引物1492R和27F。PCR反應體系(30 μL):15 μL 2×MightyAmp buffer、0.75 μL MightyAmp DNA聚合酶、上下游引物各0.75 μL和12.75 μL ddH2O。PCR擴增程序:94℃預變性5 min,94℃變性30 s;55℃退火20 s,72℃延伸110 s,共循環30次;72℃終延伸10 min。取4 μL PCR 產物于1.0%的瓊脂糖凝膠中電泳,觀察結果并判斷分子質量。選擇檢測合格的PCR產物,交由生工生物工程(上海)股份有限公司完成測序工作。隨后,將測序結果上傳至EZBioCloud和NCBI進行同源性檢索,并構建系統發育樹。
1.2.3 丁酸梭菌種子液制備
從RCM培養基中挑取丁酸梭菌單菌落接種到100 mL滅菌后的強化梭菌肉湯(液體石蠟液封),37℃生化培養箱中培養24 h,作為種子液備用。
1.2.4 丁酸梭菌培養基的優化
1.2.4.1 碳源優化
以RCM肉湯為基礎,選取乳糖、蔗糖、可溶性淀粉、葡萄糖、果糖作為碳源,其余成分不變,丁酸梭菌接種量為3%,37℃厭氧發酵24 h,測定OD600 nm的吸光值。
1.2.4.2 碳源添加量優化
以RCM肉湯為基礎,葡萄糖作為碳源,選取15 g/L、20 g/L、25 g/L、30 g/L、35 g/L的添加量,其余成分不變,丁酸梭菌的接種量為3%,37℃厭氧發酵24 h,測定OD600 nm的吸光值。
1.2.4.3 有機氮源的優化
以RCM肉湯為基礎,選取牛肉膏、蛋白胨、酵母膏、胰蛋白胨、大豆蛋白胨作為氮源,其余成分不變,丁酸梭菌接種量為3%,37℃厭氧發酵24 h,測定OD600 nm的吸光值。
1.2.4.4 氮源添加量優化
以RCM肉湯為基礎,根據有機氮源優化的結果,選取大豆蛋白胨作為氮源,添加量分別為10 g/L、15 g/L、20 g/L、25 g/L、30 g/L、35 g/L、40 g/L,其余成分不變,丁酸梭菌接種量為3%,37℃厭氧發酵24 h,測定OD600 nm的吸光值。
1.2.4.5 碳酸氫鈉添加量優化
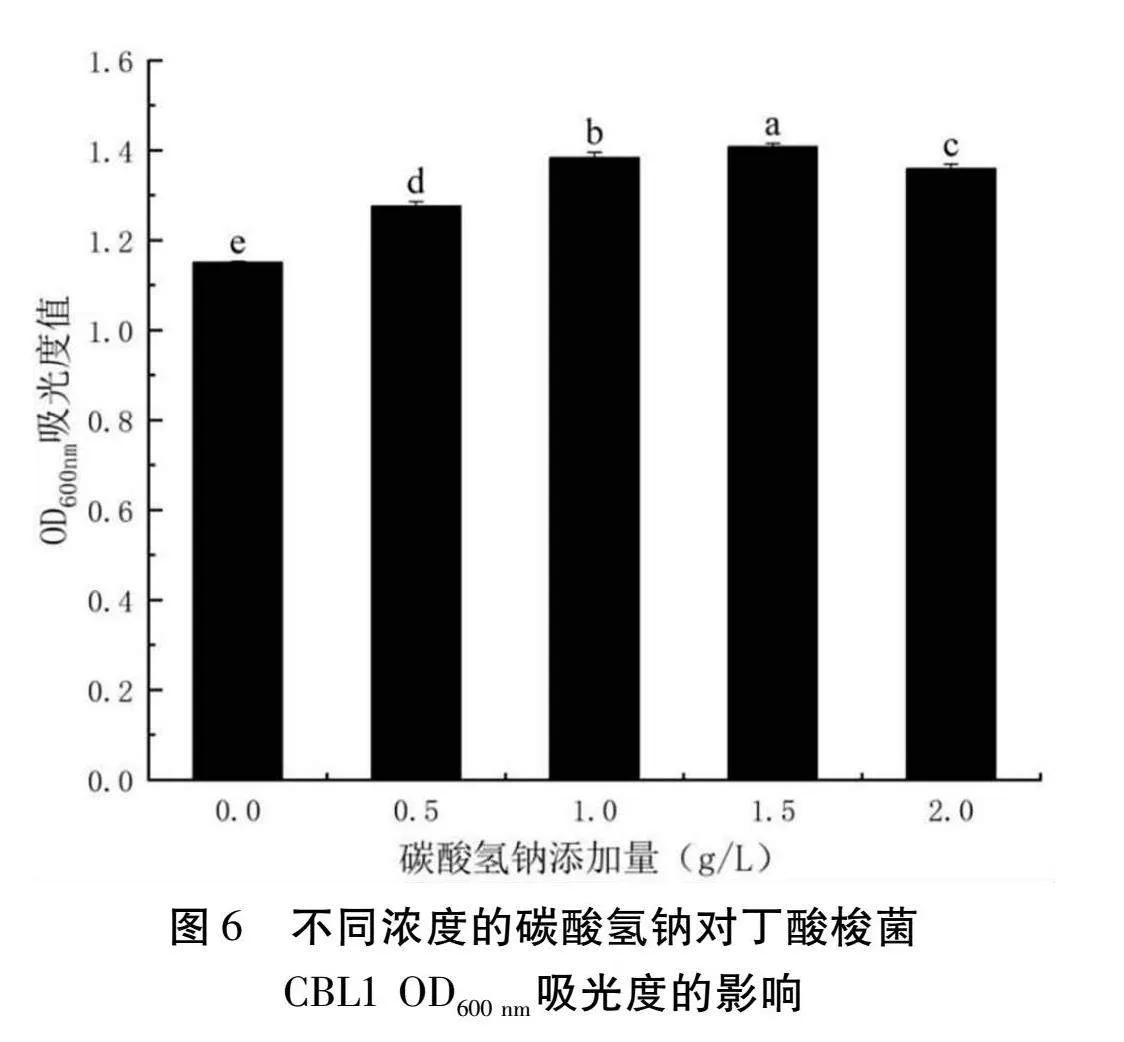
以RCM肉湯為基礎,碳酸氫鈉添加量選取0 g/L、0.5 g/L、1 g/L、1.5 g/L、2 g/L,其余成分不變,丁酸梭菌的接種量為3%,37℃厭氧發酵24 h,測定OD600 nm的吸光值。
1.2.4.6 硫酸鎂添加量優化
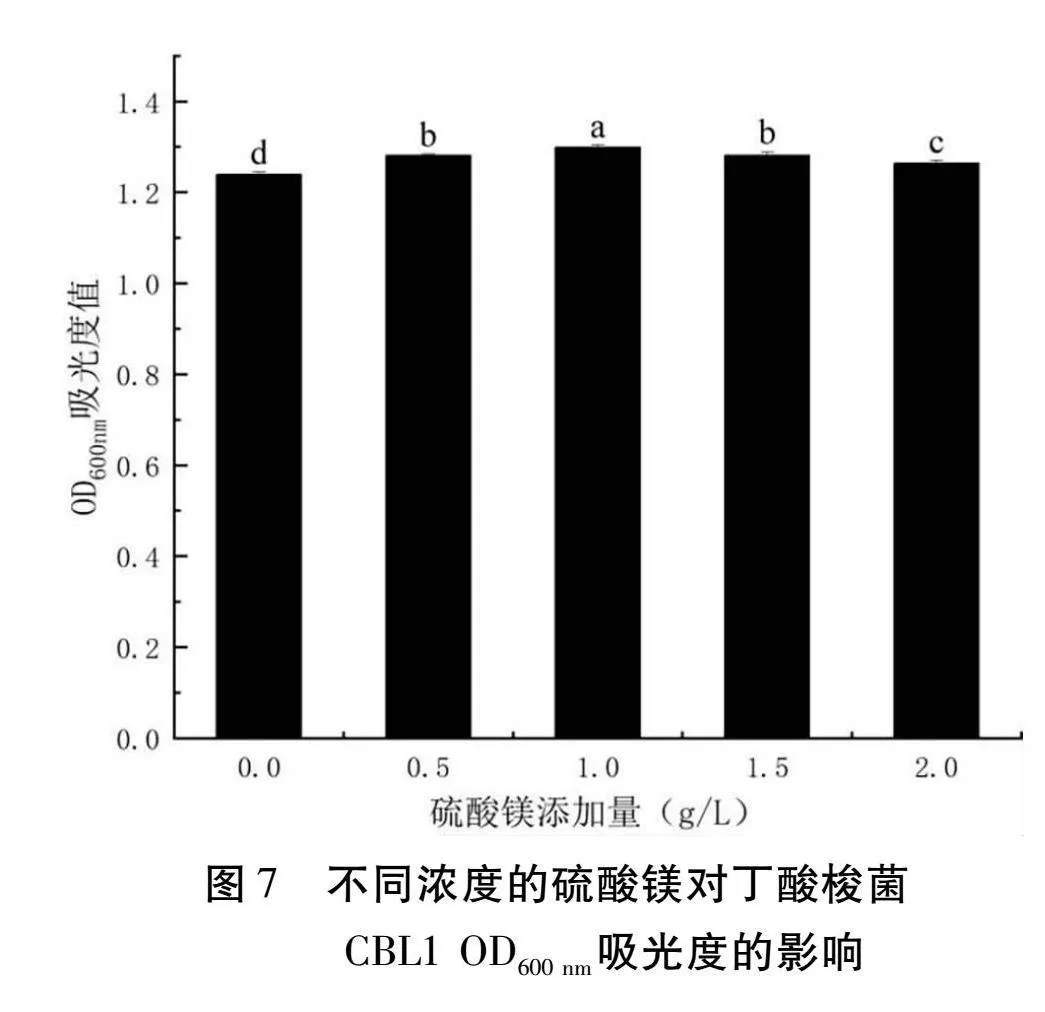
以RCM肉湯為基礎,硫酸鎂添加量選取0 g/L、0.5 g/L、1 g/L、1.5 g/L、2 g/L,其余成分不變,丁酸梭菌的接種量為3%,37℃厭氧發酵24 h,測定OD600 nm的吸光值。
1.2.4.7 磷酸氫二鉀添加量優化
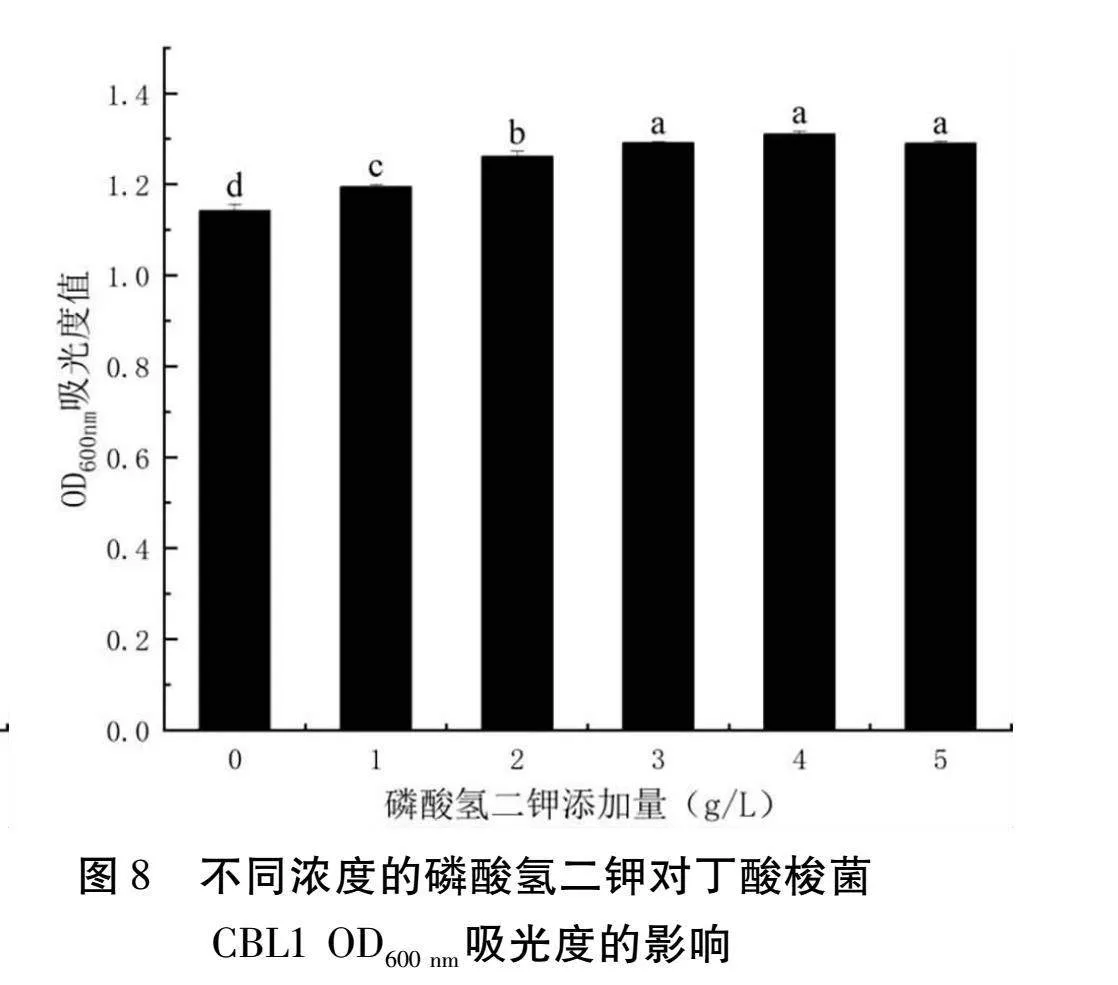
以RCM肉湯為基礎,磷酸氫二鉀添加量選取0 g/L、1 g/L、2 g/L、3 g/L、4 g/L、5 g/L,其余成分不變,丁酸梭菌的接種量為3%,37℃厭氧發酵24 h,測定OD600 nm的吸光值。
1.2.4.8 發酵培養基正交實驗優化
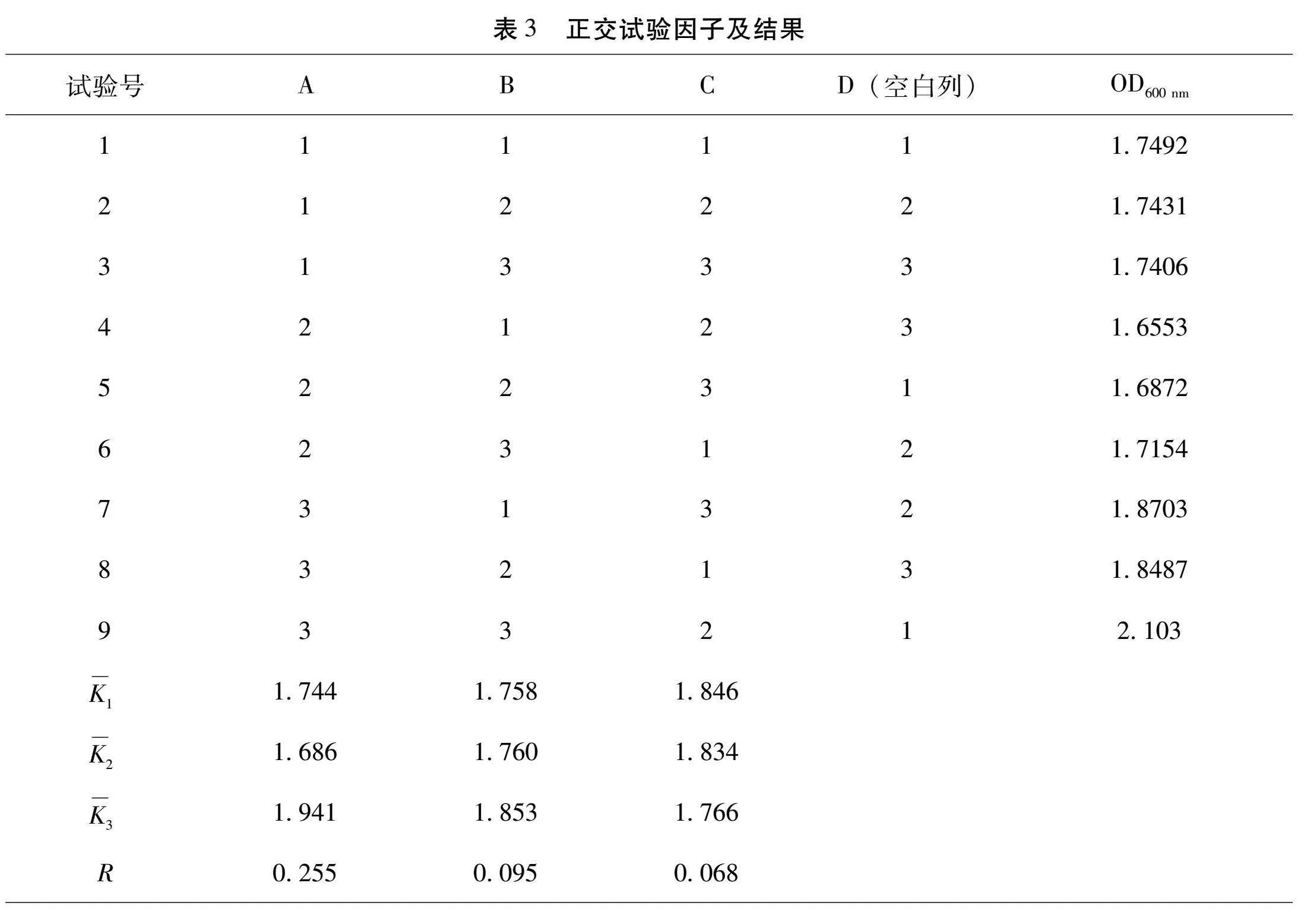
根據單因素實驗結果,選取影響最為顯著的3個因素(葡萄糖、大豆蛋白胨、碳酸氫鈉)進行正交實驗優化,其余因素以單因子實驗優化的水平為準,采用L9(3^4)正交表。
1.3 數據處理
所有實驗結果均為測定3次,采用 SPSS 22.0 軟件進行數據分析,采用單因素方差分析(P<0.05)分析數據之間的顯著性,并用 Origin 2021 軟件進行繪圖。
2 結果與分析
2.1 丁酸梭菌的分離篩選
通過RCM培養基從海水魚腸道中分離出16株厭氧菌株,根據菌落形態、菌體、嚴格厭氧特性初步判斷其中1株符合丁酸梭菌特征。結果如表2所示。
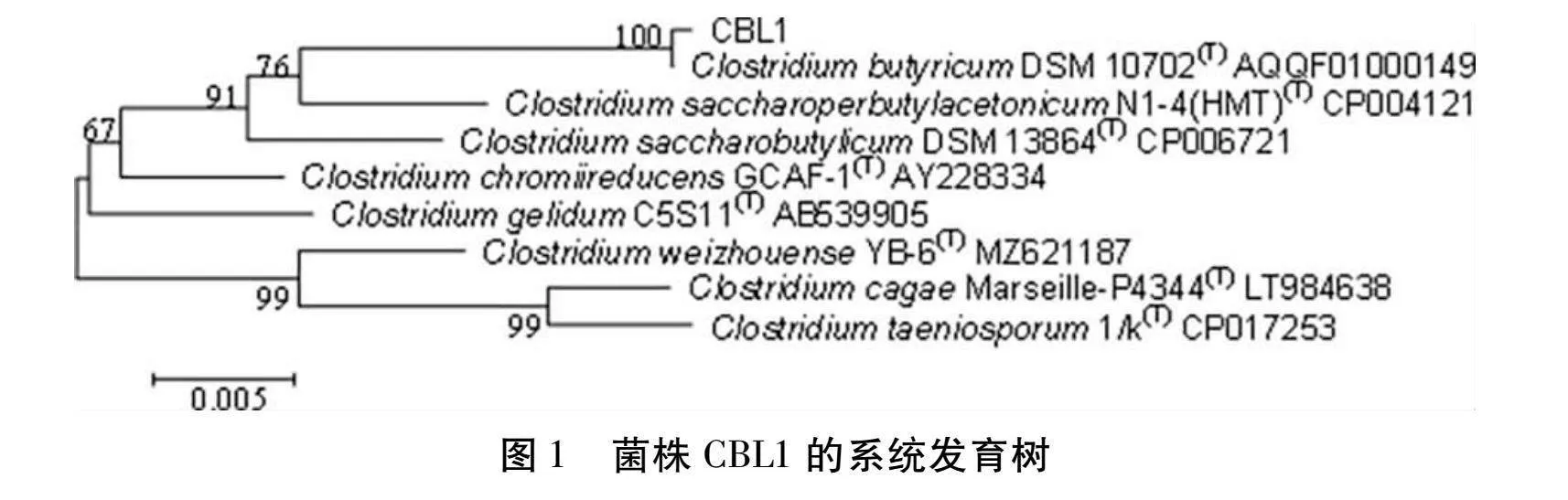
2.2 丁酸梭菌的分子鑒定
將CBL1的測序結果與EzBioCloud和NCBI數據庫的數據進行核酸序列相似性對比,結果CBL1與模式菌中的丁酸梭菌的16S rDNA基因相似度最高。選擇相似度最高的模式菌株用軟件MEGA5軟件制作系統發育樹,結果如圖1所示。CBL1與標準菌株Clostridium butyricum DSM 10702關系最近,聚同一支系上。綜合分析,可以得出菌株CBL1鑒定為丁酸梭菌。
2.3 丁酸梭菌培養基的優化
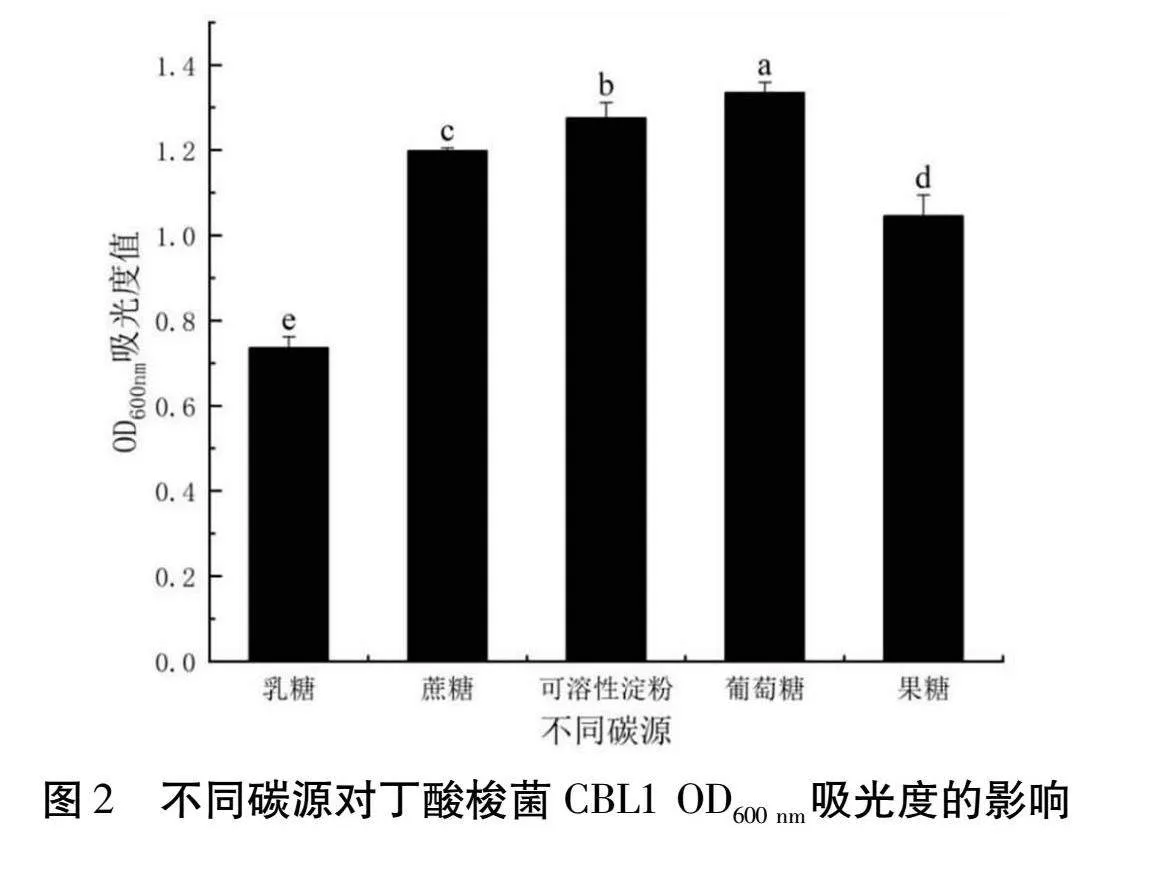
2.3.1 不同碳源添加對丁酸梭菌CBL1發酵的影響
由圖2可以得知,在接種量為3%,發酵時間為24 h的條件下,分別添加30 g/L的乳糖、蔗糖、可溶性淀粉、葡萄糖、果糖。其中添加葡萄糖時丁酸梭菌CBL1生長最好,而添加乳糖時丁酸梭菌CBL1生長最差。它們在OD600 nm處的吸光度值分別為1.3350和0.7365,因此選擇葡萄糖進行后續的添加量優化實驗。
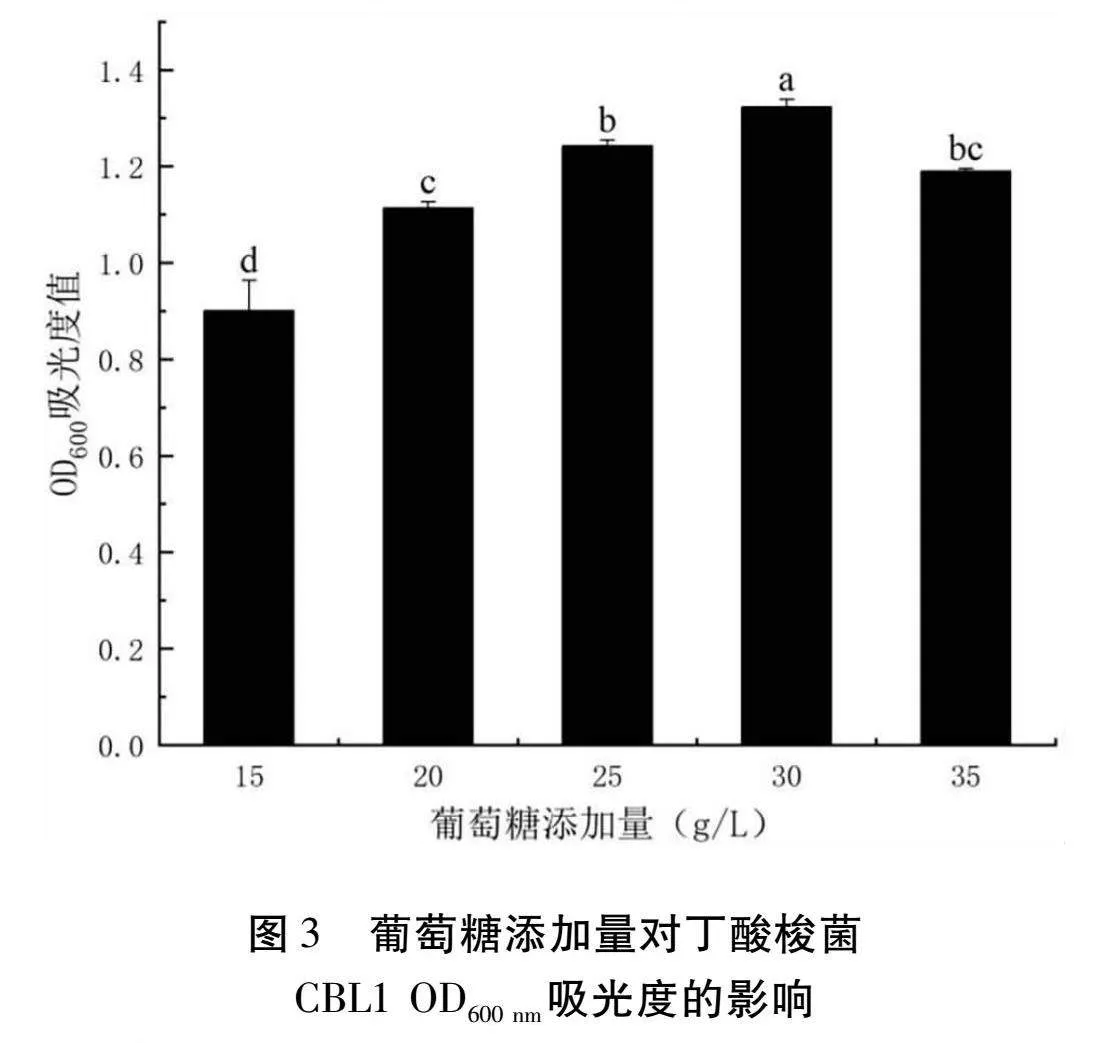
2.3.2 葡萄糖添加量對丁酸梭菌CBL1發酵的影響
由圖3可以得知,在接種量為3%,發酵時間為24 h的條件下,隨著葡萄糖添加量的增加,OD600 nm處的吸光度先增加后減少,當添加量為30 g/L時吸光度達到最大值為1.3235。這可能是因為隨著葡萄糖的添加丁酸梭菌快速生長,但當葡萄糖的含量過高后反而使其細胞失水,生長受到抑制。由此可以得知丁酸梭菌CBL1的最適葡萄糖添加量為30 g/L。
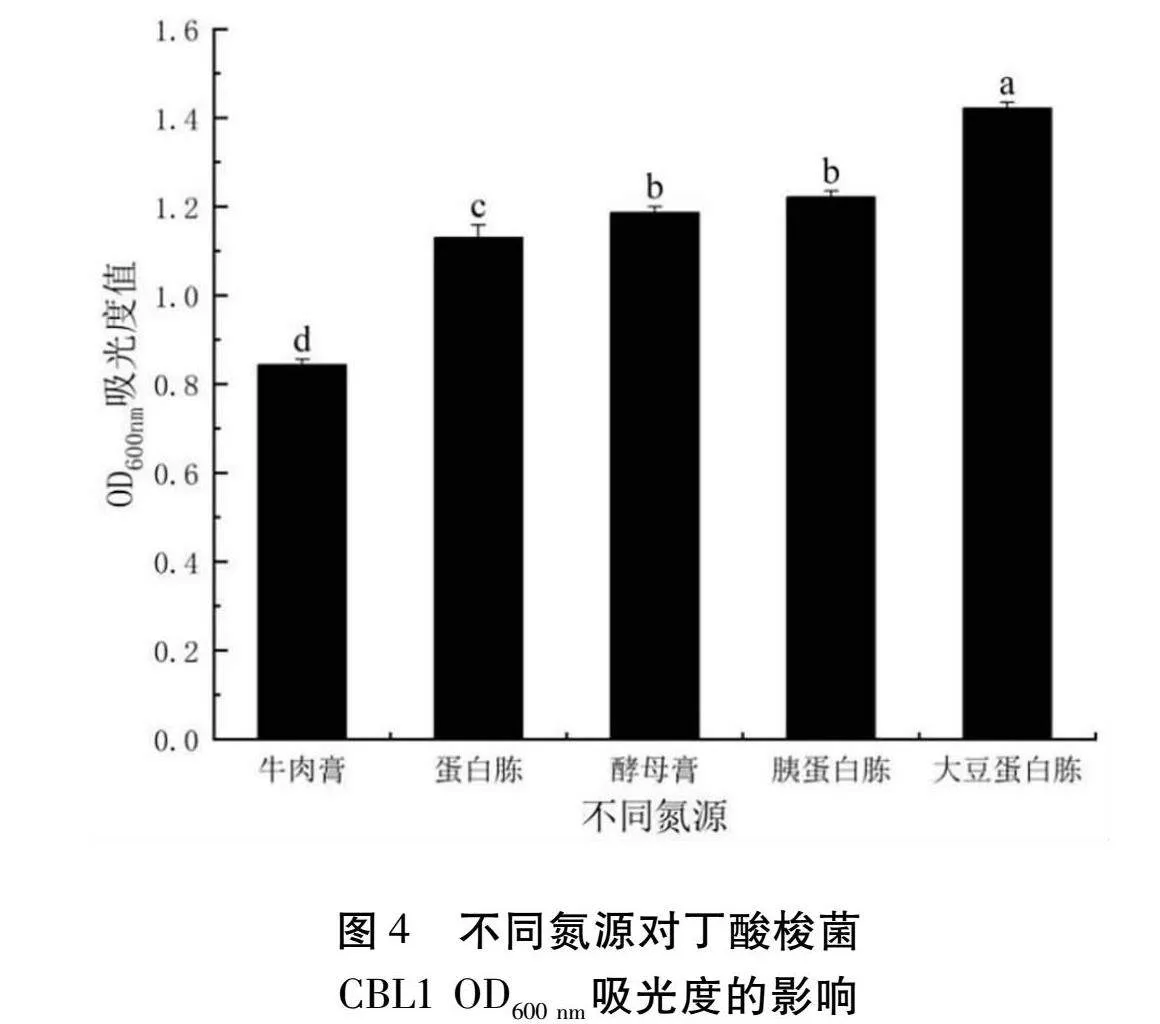
2.3.3 不同氮源添加對丁酸梭菌CBL1發酵的影響
由圖4可以得知,選取牛肉膏、蛋白胨、酵母膏、胰蛋白胨、大豆蛋白胨作為有機氮源,接種量為3%,發酵24 h。丁酸梭菌CBL1受大豆蛋白胨的影響較為顯著,在OD600 nm處的吸光度為1.4215。因此選擇大豆蛋白胨進行氮源添加量優化。
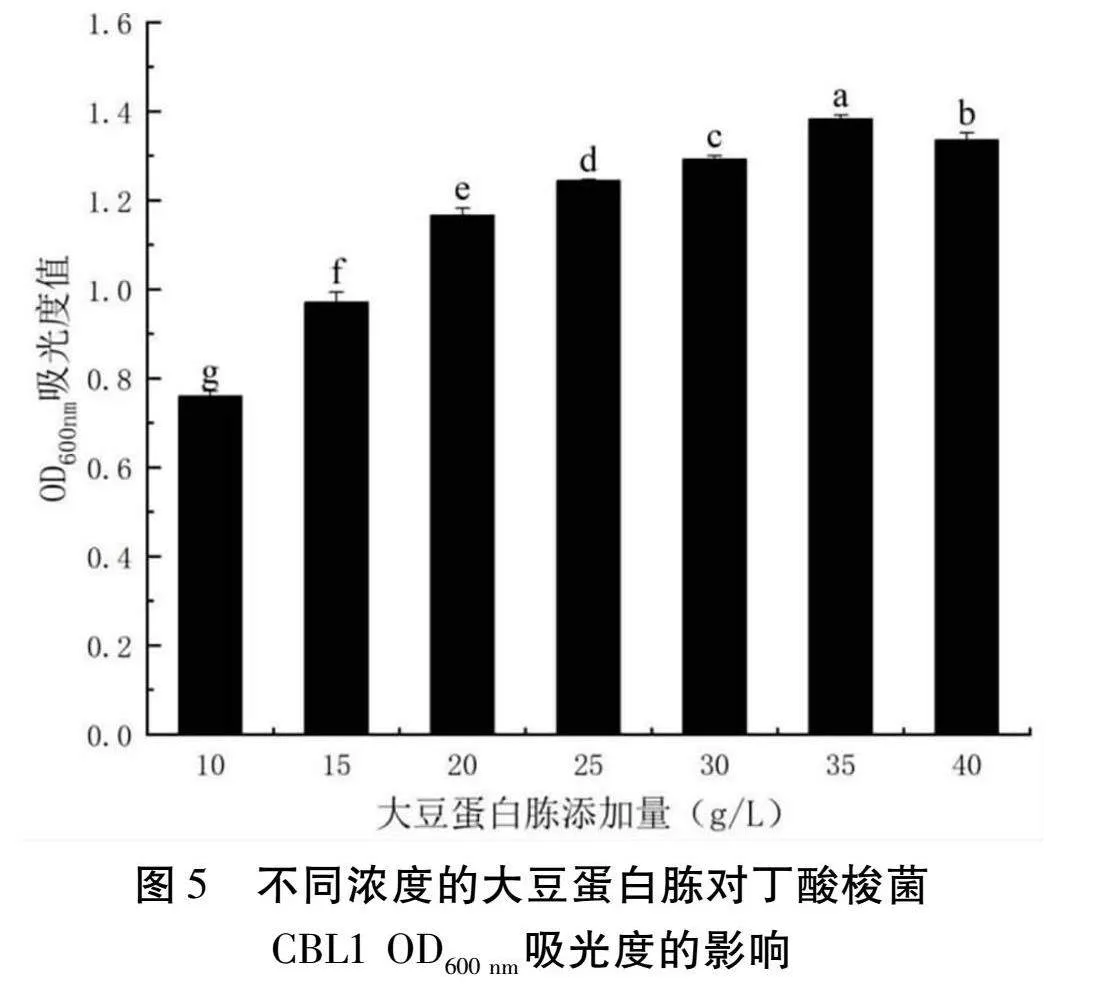
2.3.4 大豆蛋白胨添加量對丁酸梭菌CBL1發酵的影響
由圖5可以得知,以大豆蛋白胨作為氮源,隨著大豆蛋白胨添加量的增加,OD600 nm處的吸光度先增加后減少,在添加量為35 g/L時吸光度達到最大值為1.3825。因此大豆蛋白胨添加量為35 g/L時最適合丁酸梭菌CBL1的生長。
2.3.5 碳酸氫鈉添加量對丁酸梭菌CBL1發酵的影響
由圖6可以得知,隨著碳酸氫鈉添加量的增加,OD600 nm處的吸光度先增加后減少,在添加量為1.5 g/L時吸光度達到最大值為1.4075。因此碳酸氫鈉添加量為1.5 g/L時最適合丁酸梭菌CBL1的生長。
2.3.6 硫酸鎂添加量優化
由圖7可以得知,隨著硫酸鎂添加量的增加,OD600 nm處的吸光度先增加后減少,在添加量為1 g/L時吸光度達到最大值為1.2985。因此硫酸鎂添加量為1 g/L時最適合丁酸梭菌CBL1的生長。
2.3.7 磷酸氫二鉀添加量優化
由圖8可以得知,隨著磷酸氫二鉀添加量的增加,OD600 nm處的吸光度先增加后減少,在添加量為4 g/L時吸光度達到最大值為1.3105。因此磷酸氫二鉀添加量為4 g/L時最適合丁酸梭菌CBL1的生長。
2.3.8 正交試驗
根據單因素實驗結果,選擇葡萄糖、大豆蛋白胨、碳酸氫鈉進行正交試驗。結果如表3所示,極差順序為A(葡萄糖)>B(大豆蛋白胨)>C(碳酸氫鈉),可以得出對丁酸梭菌CBL1影響最大的單因子是葡萄糖,其次是大豆蛋白胨和碳酸氫鈉,各單因子水平的最優組合為A3B3C2,即葡萄糖添加量為35 g/L,大豆蛋白胨添加量為40 g/L,碳酸氫鈉的添加量為1.5 g/L,該組合A3B3C2的OD600 nm處吸光度值為2.103,其活菌數為2.85×109 CFU/mL。
3 結論
本研究從海水魚腸道中篩選出16株厭氧菌株,通過菌落形態、菌體、嚴格厭氧特性確定其中1株為丁酸梭菌,通過鑒定CBL1與Clostridium butyricum DSM 10702親緣關系相近,確定為丁酸梭菌。通過控制變量法和正交試驗,得出丁酸梭菌CBL1的最佳培養基為大豆蛋白胨40 g/L、葡萄糖35 g/L、碳酸氫鈉1.5 g/L、氯化鈉5 g/L、乙酸鈉3 g/L、鹽酸半胱氨酸0.5 g/L,在此條件下丁酸梭菌CBL1的發酵液活菌數為2.85×109 CFU/mL。本研究可以為丁酸梭菌益生菌制劑的研發提供參考,為其在水產養殖領域的推廣和應用提供基礎。
參考文獻
[1]張翔,王祖峰,王虹人,等.發展綠色高質量水產養殖對助力糧食和營養安全的思考[J].河北漁業,2022(1):41-44.
[2]Zhang K, Yu D G, Li Z F, et al.Influence of eco-substrate addition on organic carbon, nitrogen and phosphorus budgets of intensive aquaculture ponds of the Pearl River, China[J].Aquaculture, 2020, 520: 734868.
[3]Van Doan H, Prakash P, Hoseinifar S H, et al.Marine-derived products as functional feed additives in aquaculture: a review[J].Aquaculture Reports, 2023, 31: 101679.
[4]李明政,方鑫,鄭澤奮,等.水產養殖業存在的問題及對策分析[J].廣東蠶業, 2023, 57(3): 89-91+104.
[5]付翠梅.集約化淡水養殖對水環境的影響[J].吉林畜牧獸醫,2020,41(4):63+65.
[6]王漢玉.水產養殖自身污染及其防治的探討[J].農民致富之友, 2018(16): 242.
[7]趙勇,段為旦,王友成,等.益生菌在水產可持續養殖中的研究進展及展望[J/OL].水產學報,1-10[2024-05-18].
[8]林思雨,魏建宏,馬洪福,等.丁酸梭菌在家禽生產中的應用研究進展[J].飼料研究,2024,47(8):156-160.
[9]曹佳綺,張明,何騫,等.益生菌丁酸梭菌防治肺部疾病的研究進展[J].中國醫院藥學雜志, 2023, 43(21): 2448-2452.
[10]李正猛,楊毅,卜登攀,等.丁酸梭菌對哺乳犢牛生長性能、血清抗氧化指標及腹瀉頻率的影響[J].動物營養學報,2024,36(6):3772-3780.
[11]Jiao P X, Wang Z W, Zhang X L, et al.Dietary supplementation of Clostridium butyricum and rumen protected fat alters immune responses, rumen fermentation, and bacterial communities of goats[J].Animal Feed Science and Technology, 2024, 314: 116014.
[12]Hagihara M, Kuroki Y, Ariyoshi T, et al.Clostridium butyricum modulates the microbiome to protect intestinal barrier function in mice with antibiotic-induced dysbiosis[J].Iscience, 2020, 23(1): 100772.
[13]Liu M, Xie W J, Wan X Y, et al.Clostridium butyricum modulates gut microbiota and reduces colitis associated colon cancer in mice[J].International Immunopharmacology, 2020, 88: 106862.
[14]徐創文,蔣魁,虞為,等.丁酸梭菌對花鱸幼魚生長性能、免疫消化及腸道菌群的影響[J].南方農業學報, 2024, 55(2): 366-377.
[15]Meng X L, Wu S K, Hu W P, et al.Clostridium butyricum improves immune responses and remodels the intestinal microbiota of common carp(Cyprinus carpio L.)[J].Aquaculture, 2021, 530: 735753.
[16]Bi X J, Lv C J, Wang M M, et al.Effects of dietary supplementation of Clostridium butyricum H129 on growth performance and intestinal health of turbot, Scophthalmus maximus[J].Aquaculture Reports, 2023, 30: 101544.
[17]Wang C, Li P F, Hu D G, et al.Effect of Clostridium butyricum on intestinal microbiota and resistance to Vibrio alginolyticus of Penaeus vannamei[J].Fish & Shellfish Immunology, 2023, 138: 108790.

