藜麥抗性淀粉的制備及性質研究

摘 要:采用微波法制備藜麥抗性淀粉,并比較藜麥淀粉與抗性淀粉的理化性質。結果顯示:微波法制備的藜麥抗性淀粉與藜麥淀粉相比,結構發生改變,擁有更多的雙螺旋結構;藜麥淀粉與抗性淀粉的溶解度都隨溫度的升高而增大,兩者的膨脹度也隨溫度的升高快速增大,但抗性淀粉膨脹度的增大趨勢較為平緩。凝沉穩定性實驗說明抗性淀粉晶體結構更為穩定,抗性淀粉的透明度高于藜麥淀粉。這表明藜麥抗性淀粉具有更好的理化性質。
關鍵詞:藜麥抗性淀粉;理化性質;制備過程
中圖分類號:TS231 文獻標志碼:B 文章編號:2095–3305(2024)08–00-03
近年來,隨著社會經濟的發展和生活質量的提高,人們的飲食習慣和結構發生了顯著變化,這也促使了“三高”(高血壓、高血脂、高血糖)、糖尿病等疾病發病率逐年攀升[1]。作為食品工業中的核心原料之一,淀粉在人體內被消化、分解為葡萄糖后,被迅速吸收,這一特性常導致餐后血糖急劇上升,進而可能誘發肥胖、高血糖等慢性健康問題。然而,淀粉在提高食品加工性能、優化食品口感和質構方面發揮著不可替代的作用。鑒于此,對淀粉進行改性處理,減緩其消化吸收速度,成為當前研究的重點。1982年,Englyst等[2]發現了包埋在不溶性膳食纖維中的淀粉成分,因其具有良好的抗酶解性能,故將其命名為抗性淀粉(Resistant Starch,RS)。抗性淀粉是改性淀粉的一種,能夠降低人體胰島素分泌,減少熱量產生及脂肪的形成,對人類健康具有重要意義。
藜麥是原產自印第安地區的一種莧科藜亞科藜屬一年生雙子葉植物,籽粒呈扁圓形,顏色以紅色、黑色、白色和灰色為主。淀粉是藜麥的主要組成成分,占藜麥干物質總量的50%以上[3]。當前,我國對藜麥的研究主要集中在營養成分和初級加工階段,缺少對藜麥深加工的探索。研究藜麥抗性淀粉的制備方法及其理化性質,獲得功能與性質較好的抗性淀粉產品,對拓寬藜麥淀粉深加工途徑,提升藜麥淀粉價值具有積極的意義。因此,試驗主要采用微波法制備藜麥抗性淀粉,并對其理化性質進行測定,旨在為藜麥的利用提供一定的參考。
1 材料與方法
1.1 材料和試劑
白藜麥,產于青海;耐高溫α-淀粉酶,阿拉丁公司;葡萄糖淀粉酶,食品級;其他試劑均為國產分析純。
1.2 主要儀器和設備
歐普T6新世紀型紫外可見分光光度計;科恒101型電熱鼓風干燥箱;梅特勒MS 105型電子分析天平;蔡司Sigma 300型掃描電子顯微鏡等。
1.3 微波法制備藜麥抗性淀粉
1.3.1 藜麥淀粉的制備
取一定量的藜麥烘干,粉碎后過80目篩,按照1∶10(g/mL)的固液比添加0.25%氫氧化鈉溶液,置于磁力攪拌器上,53 ℃浸泡攪拌6 h,4 000 rpm離心
15 min,棄去上清液,數次洗滌至呈中性,用雙縮脲試劑測試無蛋白質后,過200目濾布,經50 ℃烘箱干燥后粉碎過60目篩,石油醚回流12 h脫脂,干燥密封
儲存[4]。
1.3.2 藜麥抗性淀粉的制備
取一定質量的藜麥淀粉置于離心管中,加入蒸餾水配制成10%的淀粉乳,充分攪拌后于560 W功率微波3 min。微波后將淀粉糊冷卻至室溫,4 ℃冷藏12 h回生。取出后放入干燥箱50 ℃烘干,將其粉碎并過80目篩,得到粗制藜麥抗性淀粉。取粗制抗性淀粉加入蒸餾水,依次使用過量耐高溫α-淀粉酶、過量葡萄糖淀粉酶充分酶解。酶解后,離心保留沉淀,用蒸餾水洗滌2次后得到純化藜麥抗性淀粉[5]。
1.4 藜麥抗性淀粉結構及性質研究
1.4.1 淀粉顆粒形態觀察
淀粉樣品經鍍金處理后通過蔡司Sigma 300型掃描電子顯微鏡測定微觀形貌,測試電壓為3.0 kV,放大倍數為1 500倍。
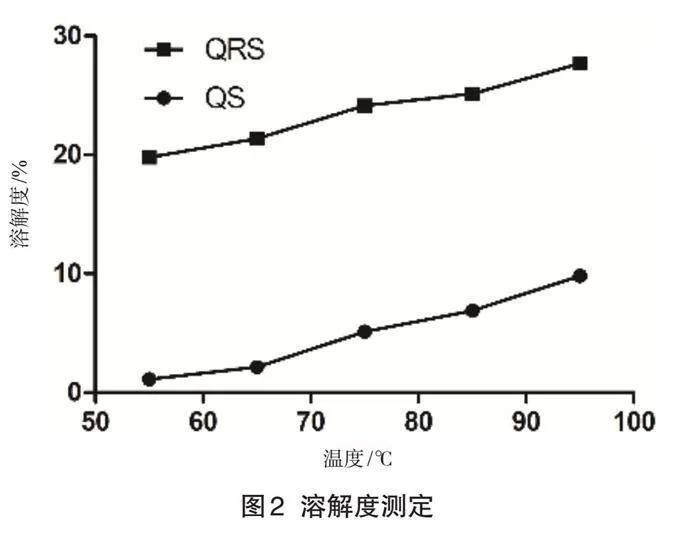
1.4.2 溶解度測定
精確稱量兩種淀粉樣品并添加蒸餾水制備成1%淀粉懸浮液。在不同溫度下對懸浮液加熱40 min,此期間每5 min使用渦旋振蕩儀進行混合。離心后將上層清液傾倒入預先恒重的稱量瓶中,并于105 ℃烘干至恒重。此時,稱量的質量即為被溶解的淀粉質量,根據稱量結果計算出淀粉的溶解度[6]。
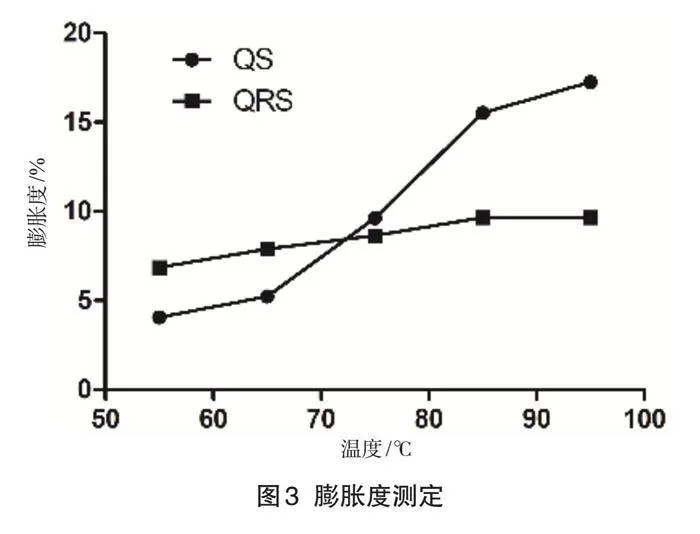
1.4.3 膨脹度測定
精確稱取兩種淀粉樣品,并添加蒸餾水制備成1%淀粉懸浮液。在設定的溫度梯度(55、65、75、85、95 ℃)
中對懸浮液加熱40 min,此期間每5 min使用渦旋振蕩儀混合懸浮液。之后,在3 000 r/min下離心30 min,稱取離心后的沉淀物質量,這即為膨脹淀粉的質量。根據稱量結果計算出淀粉的膨脹度。
1.4.4 凝沉穩定性測定
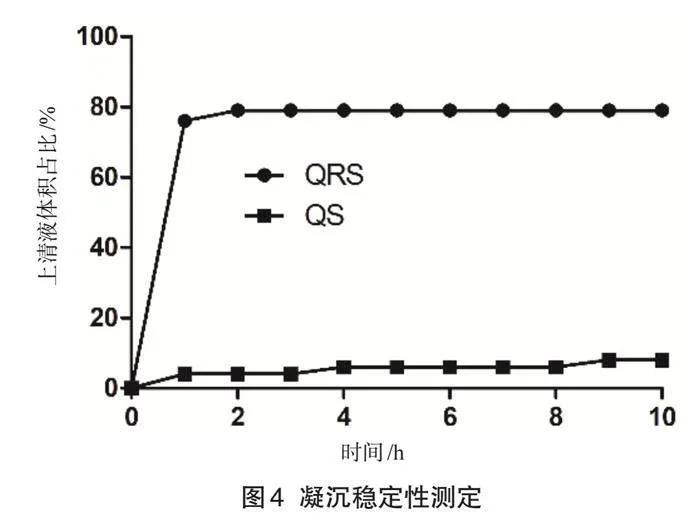
為測定淀粉的凝沉穩定性,首先精確稱量了兩種淀粉樣品,并將它們分別與蒸餾水混合,制備成濃度為1%的淀粉乳。隨后,在沸水浴中將1%的淀粉乳攪拌糊化30 min,冷卻至室溫,并移至帶有塞子的試管中均勻搖晃。之后,試管放置在室溫下靜置,并且每隔1 h記錄上清液的體積變化。以時間為橫坐標,上清液體積占總體積的百分比為縱坐標,繪制凝沉穩定性的變化曲線。
1.4.5 透明度測定
為了對淀粉的透明度進行評估,稱取一定量的淀粉,并與蒸餾水混合制成1%的淀粉乳。然后,在沸水浴中將淀粉乳加熱20 min以確保充分糊化。在此過程中,不斷加入蒸餾水以保持原有體積的穩定。糊化完成后,樣品冷卻至室溫,并以蒸餾水作為參照,使用分光光度計在620 nm的波長下測量淀粉糊的透光率。這個透光率值即代表了淀粉的透明度。
2 結果與分析
2.1 淀粉顆粒形態觀察
采用掃描電鏡觀察藜麥淀粉與微波法制備的藜麥抗性淀粉的形態。由圖1a可以看出,藜麥原淀粉呈較小的多邊形顆粒狀,顆粒聚集緊密;圖1b結果表明,藜麥抗性淀粉的結構已經完全被破壞,原有的形態消失,失去了獨立性和完整性,形成整體較為光滑的片狀結構。這可能是因為用微波法制備藜麥抗性淀粉的過程中,微波能快速作用于藜麥淀粉,且作用時間較短,直鏈淀粉無法完全從顆粒中溢出,并且微波會導致熱量集中于分子而不易散去,發生過度降解,從而減少了游離的適宜長度的直鏈淀粉形成雙螺旋
結構[7]。
圖1 藜麥淀粉(a)、藜麥抗性淀粉(b)掃描電鏡照片
2.2 溶解度測定
溶解度是在一定溫度下已溶解的淀粉樣品的質量分數,指直鏈淀粉分子從有序態,擴散至溶液中轉變為無序態的過程,能夠反映結晶結構和無定形結構含量比率[8]。溶解度的測定結果如圖2所示,藜麥淀粉與藜麥抗性淀粉的溶解度均呈現出隨溫度升高而增大的趨勢,這一現象表明,在加熱過程中,淀粉的晶體分子結構遭受破壞,導致水分子能夠通過氫鍵作用與直鏈淀粉及支鏈淀粉的羥基發生結合,此變化增強了淀粉與水分子的結合能力,促使其溶解度得到增大。在所有溫度下抗性淀粉溶解度均高于淀粉,可能是因為抗性淀粉的晶體結構在加熱過程中被瓦解,導致直鏈淀粉解離擴散至水中,這也說明抗性淀粉無定型區的含量更高。
圖2 溶解度測定
2.3 膨脹度測定
膨脹度是指每克干淀粉在一定溫度下吸收水分的質量,體現了無定型區和結晶區淀粉鏈的結合程度[9]。膨脹度的結果如圖3所示,藜麥淀粉的膨脹度隨溫度升高而快速增大,而抗性淀粉的膨脹度上升趨勢較為平緩,但隨著溫度升高,膨脹度也持續增大。抗性淀粉展現出較低的膨脹度并保持相對穩定性,這一現象歸因于淀粉顆粒的膨脹主要發生在移動的無定形區域,抗性淀粉所吸收的能量不足以使該無定形區域迅速糊化,并且在微波處理過程中,抗性淀粉的分子鏈會重組,形成更多的雙螺旋結構,這些緊密的雙螺旋結構進一步限制淀粉的膨脹能力。
2.4 凝沉穩定性測定
淀粉的凝沉現象是與糊化相對應的過程,描述的是已經糊化的淀粉分子由混亂狀態重新排列成有序狀態,并出現凝結沉降的現象。這種凝沉性質被視為評估淀粉老化特性的關鍵指標。具體來說,淀粉經過加熱糊化后,在冷卻過程中,其分子的熱運動會逐漸減弱,這致使淀粉分子鏈趨向于有序排列,尤其是平行排列,從而觸發凝沉現象。同時,凝沉性的強弱也可以反映淀粉與水結合能力的強弱[10]。凝沉穩定性結果如圖4所示,由于抗性淀粉屬于老化淀粉,糊化過程對其淀粉顆粒不會產生影響,因此置于室溫后未糊化的淀粉顆粒均迅速沉降隨后趨于平穩。與藜麥淀粉相比,藜麥抗性淀粉經過重結晶,形成了穩定的晶體結構。
圖3 膨脹度測定
圖4 凝沉穩定性測定
2.5 透明度測定
透明度這一概念,可以通過測量光線穿透特定濃度的淀粉糊時的透光率來量化。因此,透光率可以作為透明度的衡量指標,較高的透光率即意味著淀粉糊的透明度更優。透明度受多個核心要素影響,如淀粉顆粒的尺寸、膨脹程度,以及直鏈淀粉與支鏈淀粉之間的比率等。此外,在淀粉糊化過程中,未充分膨脹的殘余顆粒和未完全破裂的淀粉顆粒數量,同樣對透明度有顯著影響。試驗結果顯示,藜麥淀粉的透光度為5.8%,相比之下,抗性淀粉的透光度高達58.9%,顯示出抗性淀粉具有更高的透明度。這一差異產生的原因在于抗性淀粉是一種老化淀粉,在加熱溫度低于
100 ℃時,不會發生糊化。通過分析凝沉穩定性曲線可以發現,一旦淀粉發生糊化并處于室溫條件下,抗性淀粉顆粒會迅速沉降,這導致溶液中淀粉顆粒的數量顯著減少,從而使溶液呈現出較高的透明度;相反,藜麥淀粉的沉降速度較慢,糊化后大量的淀粉顆粒仍然懸浮于淀粉溶液中,因此其透明度相對較低。
3 結束語
淀粉的理化性質和功能主要取決于淀粉的顆粒特性和分子特性,研究了微波法處理對藜麥淀粉和藜麥抗性淀粉的顆粒形貌、溶解度、膨脹度、凝沉穩定性和透光率的影響,并利用掃描電子顯微鏡對藜麥淀粉、藜麥抗性淀粉的顆粒大小、形態進行研究。結果表明,藜麥淀粉呈不規則的多邊形,淀粉顆粒聚集緊密,而藜麥抗性淀粉的結構已經完全被破壞,原有的形態消失,整體形成較為光滑的片狀結構,擁有更多的雙螺旋結構。藜麥抗性淀粉溶解度高于藜麥淀粉,膨脹度低于藜麥淀粉,兩者的溶解度均隨溫度升高而增大,膨脹度也隨溫度升高而快速增大。但抗性淀粉膨脹度的增大趨勢較為平緩,這表明抗性淀粉已形成較為穩定的晶體結構,不易被糊化。凝沉穩定性結果表明糊化過程對藜麥抗性淀粉的顆粒不會產生影響,未糊化的淀粉顆粒能夠迅速沉降隨后趨于平穩,與藜麥淀粉相比,其具有更穩定的晶體結構。透明度測定結果表明,藜麥抗性淀粉顆粒迅速沉降,透明度高于藜麥淀粉。在此基礎上,可以進一步研究藜麥抗性淀粉的功能,探究藜麥抗性淀粉功能與結構的關系,為藜麥抗性淀粉的加工與利用提供一定理論依據。
參考文獻
[1] 劉佳,曾英男,李瑞,等.抗性淀粉的制備研究進展[J].糧食問題研究,2020(5):47-50.
[2] Englyst H, Wiggins H S, Cummings J H. Determination of the non-starch polysaccharides in plant foods by gas-liquid chromatography of constituent sugars as alditol acetates [J]. Analyst, 1982, 107(1272): 307-318.
[3] 汪曉璇,張妤,錢澄,等.藜麥的營養及其淀粉特性的研究進展[J].糧油食品科技,2021,29(4):12-19.
[4] 丁瑞瑞,羅陽,陳歡,等.藜麥淀粉提取工藝優化及性質表征[J].林農業大學學報,2022,44(1):117-126.
[5] 吳小婷.不同方法制備的蓮子抗性淀粉性質及其體外益生元作用的研究[D].福州:福建農林大學,2015.
[6] 汪穎.蓮子抗性淀粉制備、性質及其對雙歧桿菌增殖效應的研究[D].福州:福建農林大學,2013.
[7] 楊光,楊波,丁霄霖.微波輻射對抗性淀粉形成的影響[J].食品科學,2008(10):118-120.
[8] 邵秀芝,肖永霞.小麥抗性淀粉物理性質研究[J].糧食與油脂,2009(9):11-13.
[9] 夏強.基于高靜壓技術調控全谷物糙米理化品質特性的研究[D].上海:上海交通大學,2018.
[10] Singh N, Inouchi N, Nishinari K. Structural, thermal and viscoelastic characteristics of starches separated from normal, sugary and waxy maize[J]. Food Hydrocolloids, 2006, 20(6): 923-935.

