臍帶間充質干細胞外泌體對心肌梗死小鼠心肌損傷的保護作用
【摘要】目的 探討臍帶間充質干細胞(UCMSCs)來源的外泌體(Exos)對心肌梗死(MI)小鼠心功能、心肌細胞凋亡蛋白及心肌組織損傷的影響。方法 將UCMSCs培養至第3~9代,分離UCMSCs中的Exos,應用蛋白質免疫印跡法(WB)鑒定其表面標志物CD63、CD81蛋白,應用實時熒光定量聚合酶鏈式反應(RT-PCR)檢測miR-152-3p的相對表達量。取C57BL/6雄性小鼠15只,以隨機數字表法分為sham組(5只)、MI組(5只)、MI+UCMSCs-Exos組(5只),采用冠狀動脈左前降支結扎術構建MI模型小鼠,其中MI+UCMSCs-Exos組小鼠造模成功后將50 μL Exos均分為4份,注射至小鼠梗死區域周圍4點,并于術后第2、5、7、9、12天行尾靜脈注射50 μLExos,sham組與MI組小鼠于同時間點以等量的磷酸鹽緩沖溶液(PBS)處理。3組小鼠術后均觀察14 d。比較術后14 d 3組小鼠的心功能、血清miR-152-3p表達、心臟質量(HW)/脛骨長度(TL)、心肌組織病理形態學及心肌細胞中B淋巴細胞瘤-2(Bcl-2)蛋白、Bcl-2相關X蛋白(Bax)表達水平。結果 UCMSCs-Exos中的CD63、CD81蛋白表達量及miR-152-3p的相對表達量均高于UCMSCs;術后14 d,與sham組比,MI組與MI+UCMSCs-Exos組小鼠血清miR-152-3p、左室射血分數(LVEF)、左心室縮短分數(LVFS)水平均下降,HW/TL水平均升高,與MI組比,MI+UCMSCs-Exos組小鼠血清miR-152-3p、LVEF、LVFS水平均升高,HW/TL水平下降;術后14 d,與sham組比,MI組與MI+UCMSCs-Exos組小鼠心肌細胞受損、細胞排列紊亂、心肌纖維增生、細胞間隙增大、炎癥細胞浸潤,與MI組比,MI+UCMSCs-Exos組小鼠心肌細胞受損減輕、細胞排列稍紊亂、心肌纖維增生較少、細胞間隙的變化較小、炎癥細胞浸潤較少;術后14 d,與sham組比,MI組與MI+UCMSCs-Exos組小鼠心肌細胞中Bcl-2蛋白表達水平下降,Bax蛋白表達水平升高,與MI組比,MI+UCMSCs-Exos組小鼠心肌細胞中Bcl-2蛋白表達水平升高,Bax蛋白表達水平下降(均P<0.05)。結論 UCMSCs來源的Exos可改善MI小鼠的心功能,抑制心肌細胞凋亡,減輕心臟組織病理改變,且Exos在MI中發揮保護作用可能與高表達miR-152-3p有關。
【關鍵詞】心肌梗死 ; 臍帶間充質干細胞 ; 外泌體
【中圖分類號】R541 【文獻標識碼】A 【文章編號】2096-3718.2024.23.0026.04
DOI:10.3969/j.issn.2096-3718.2024.23.009
心肌梗死(myocardial infarct,MI)是臨床上較嚴重的一種心肌缺血性疾病,主要是由于心肌細胞凋亡和心肌重塑對心臟功能造成了不可逆的損傷。現階段,臨床上主要采取介入手術和溶栓治療MI,但其對壞死心肌組織的治療效果不甚理想[1]。臍帶間充質干細胞(UCMSCs)是新生兒臍帶組織中具有自我更新能力和多向分化潛能的多功能干細胞,在研究中被證實可以有效改善MI模型動物的心功能,且其外泌體(Exos)中的微小RNA(miRNA)可抑制MI后心肌細胞凋亡,減輕心肌缺血再灌注損傷[2]。研究表明,UCMSCs來源的Exos中表達量較大的miRNA之一為miR-152-3p,其在缺氧誘導的人臍靜脈內皮細胞中高表達,可調節內皮細胞的通透性,并提高細胞存活率[3]。基于此,本研究旨在探討UCMSCs來源的Exos對MI小鼠心肌損傷的保護作用及其作用機制,現報道如下。
1 材料與方法
1.1 實驗動物、細胞、主要試劑及儀器
1.1.1 實驗動物 C57BL/6雄性小鼠[湖北省實驗動物研究中心,實驗動物生產許可證號:SYXK(鄂)2024-0013],雄性小鼠6~8周齡,平均(7.35±0.64)周;體質量18~22 g,平均(20.46±1.48)g。飼養于廣州醫科大學附屬第二人民醫院動物實驗室中,無特定病原體環境,溫度20~26 °C,濕度40%~70%,所有小鼠均可自由獲取水和食物,適應性飼養7 d,無不良反應后納入實驗。本研究經華南理工大學附屬第六醫院(佛山市南海區人民醫院)動物醫學倫理委員會批準。
1.1.2 實驗細胞 UCMSCs(武漢普諾賽生命科技有限公司)。
1.1.3 主要試劑與儀器 miR-152-3p與U6引物(廣州銳博生物科技公司)。胎牛血清、TRIzol試劑[賽默飛世爾科技(中國)有限公司];One Step PrimeScript miRNA cDNA逆轉錄試劑盒(TaKaRa);SYBR GreenPCR試劑(MedChemExpress);CD63、CD81、B淋巴細胞瘤-2(Bcl-2)、Bcl-2相關X蛋白(Bax)一抗與羊抗兔免疫球蛋白G[辣根過氧化物酶(HRP)標記]二抗(Abcam);放射免疫沉淀測定(RIPA)裂解液、二辛可寧酸(BCA)試劑盒及增強化學發光(ECL)試劑盒(上海碧云天生物公司)。分光光度計[賽默飛世爾科技(中國)有限公司,型號:NanoDrop 2000];超聲成像系統(加拿大VisualSonics,型號:Vevo 2000);倒置顯微鏡(Olympus,型號:CKX31)。
1.2 研究方法
1.2.1 UCMSCs培養 UCMSCs用含有10%胎牛血清的DMEM培養基置于5% CO2、37 °C的加濕培養箱中培養,選取培養至第3~9代中生長良好的細胞用于后續實驗。
1.2.2 Exos分離與鑒定 UCMSCs用磷酸鹽緩沖溶液(PBS)洗滌,隨后在不含Exos的DMEM培養基上培養48 h,收集條件培養基,離心(1 500 r/min,30 min)后取上清液,使用分離試劑收集上清液中的Exos。分別應用RIPA裂解液提取細胞、Exos總蛋白,以BCA法定量檢測其蛋白濃度。采用蛋白質免疫印跡法(WB)鑒定Exos表面標志物(CD63和CD81),蛋白樣品經聚丙烯酰胺凝膠電泳分離后,轉移至聚偏二氟乙烯(PVDF)膜上,加入CD63(1∶1 000)和CD81(1∶1 000)一抗,于4 °C下孵育過夜。洗膜后加入羊抗兔免疫球蛋白G(HRP標記)二抗(1∶2 000),于37 ℃下孵育1 h,以ECL法顯影。以β-肌動蛋白(β-actin)為內參,應用ImageJ軟件計算目的蛋白的相對灰度值。
1.2.3 實時熒光定量聚合酶鏈式反應(RT-PCR)檢測Exos中miR-152-3p的表達 分別提取UCMSCs與Exos總RNA,應用分光光度計測定其濃度和純度,反轉錄為cDNA,以cDNA為模板進行RT-PCR擴增。反應體系:cDNA模板5 μL,正向引物與反向引物各0.5 μL、SYBR GreenPCR 10μL、加水補足至20 μL。反應條件:95 °C預變性2 min,95 °C變性15 s、60 °C退火30 s、72 °C延伸15 s。應用2-ΔΔCT法計算miR-152-3p的相對表達量。進行3次獨立實驗,取其平均值。
1.2.4 動物分組與造模 選取C57BL/6小鼠15只,以隨機數字表法分為sham組(5只)、MI組(5只)、MI+UCMSCs-Exos組(5只)。sham組小鼠僅打開胸腔,不進行冠狀動脈結扎處理,MI組與MI+UCMSCs-Exos組小鼠均進行造模處理。小鼠麻醉后,常規備皮并消毒,在心臟搏動最明顯處,作一長約2.5 cm的切口,鈍性分離皮膚與皮下肌肉層,暴露肋骨,剪斷第三、四根肋骨及肋間肌,打開胸腔,剪開心包膜,在左心耳下方2~3 mm處由右向左穿過心肌,結扎冠狀動脈,觀察左心室壁變得蒼白,關閉胸腔并縫合。心電圖檢測出現ST段上抬或T波倒置提示造模成功。MI建模成功后,取1.2.2中已鑒定的50 μL Exos,將其均分為4份,注射至MI+UCMSCs-Exos組小鼠梗死區域周圍4點處,sham組與MI組小鼠注射等量PBS。于術后第2、5、7、9、12天時,MI+UCMSCs-Exos組小鼠行尾靜脈注射50 μL Exos治療,sham組與MI組小鼠注射等量的PBS。術后14 d,對3組小鼠實施安樂死,分離其心臟組織。
1.2.5 WB法檢測心肌細胞凋亡蛋白 取各組小鼠適量心臟組織,應用RIPA裂解液提取細胞總蛋白,以BCA法定量檢測蛋白濃度。應用WB法檢測心肌細胞Bcl-2、Bax蛋白的表達水平,取每組小鼠25 μg蛋白樣品,10%聚丙烯酰胺凝膠電泳進行分離,轉移至PVDF膜上,5%脫脂牛奶封閉2 h。加入Bcl-2(1∶2 000)和Bax(1∶1 000)一抗后孵育,經洗膜、二抗孵育、顯影處理后,應用ImageJ軟件計算目的蛋白的相對灰度值。
1.2.6 蘇木精 - 伊紅(HE)染色 將各組小鼠心臟組織用4%多聚甲醛固定,石蠟包埋后進行切片,厚度5 μm,切片脫蠟至水化,行常規HE染色,經脫水、透明、中性樹脂封片處理,在顯微鏡下觀察心臟組織的形態變化。
1.3 觀察指標 ⑴UCMSCs分泌的Exos的鑒定及其miR-152-3p的表達量。應用WB法檢測CD63、CD81蛋白表達量;應用RT-PCR法檢測miR-152-3p的相對表達量。⑵心功能。術后14 d,抽取小鼠腹主動脈血1 mL,離心(2 000 r/min,20 min),取上層血清,應用RT-PCR法檢測血清中miR-152-3p的相對表達量;應用經胸超聲心動圖測定小鼠左室射血分數(LVEF)、左室縮短分數(LVFS);分離心臟組織后,測定心臟質量(HW),測量小鼠脛骨長度(TL),并計算HW/TL。⑶HE染色。術后14 d,比較3組小鼠心肌組織病理形態學。⑷凋亡蛋白表達。術后14 d,應用WB法測定3組小鼠心肌細胞凋亡Bcl-2、Bax蛋白表達水平。
1.4 統計學方法 應用GraphPad Prism 8.0軟件進行統計學分析,計量資料經S-W檢驗符合正態分布,以( x ±s)表示,兩組間比較采用獨立樣本t檢驗,多組間比較采用單因素方差分析,多組間兩兩比較采用SNK-q檢驗。P<0.05為差異有統計學意義。
2 結果
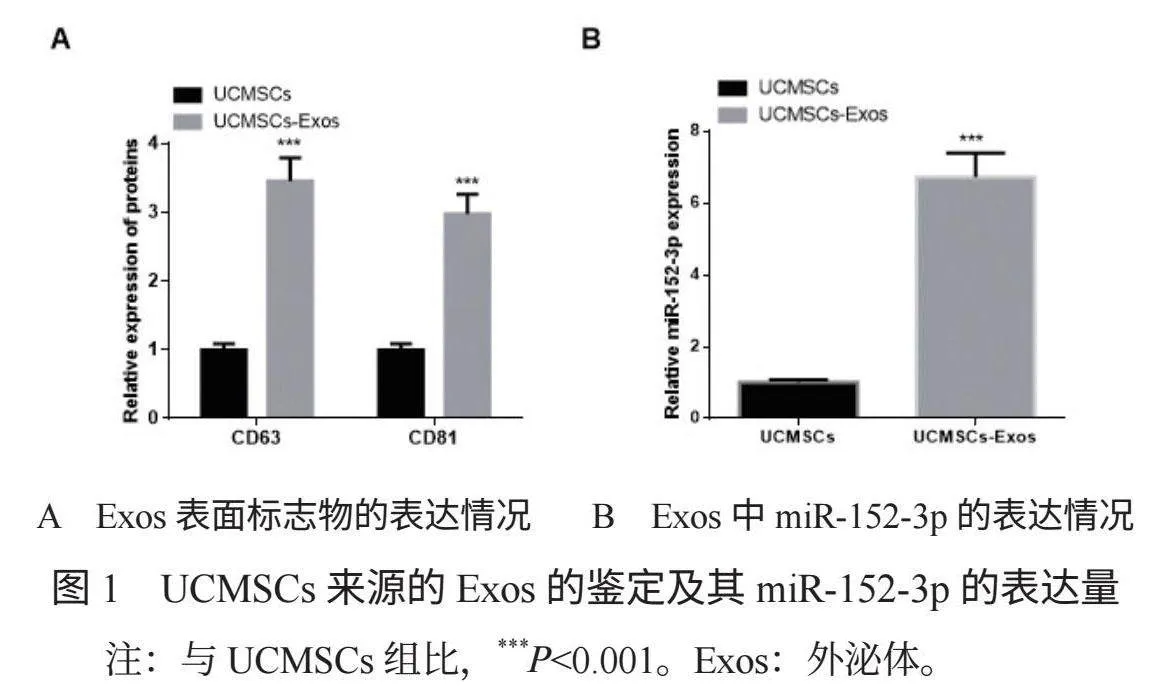
2.1 UCMSCs來源的Exos的鑒定及其miR-152-3p的表達量 UCMSCs-Exos中CD63、CD81蛋白的表達量分別為(3.46±0.37)、(2.98±0.31),miR-152-3p的相對表達量為(6.72±0.78),均高于UCMSCs的(1.00±0.09)、(1.00±0.09)、(1.00±0.09),差異均有統計學意義(t=11.190、10.620、12.840,均P<0.05),見圖1。
2.2 3組小鼠心功能比較 術后14 d,與sham組比,MI組與MI+UCMSCs-Exos組小鼠血清miR-152-3p、LVEF、LVFS水平均下降,MI+UCMSCs-Exos 組高于MI組;HW/TL水平均升高,MI+UCMSCs-Exos 組低于MI組,差異均有統計學意義(均P<0.05),見表1。
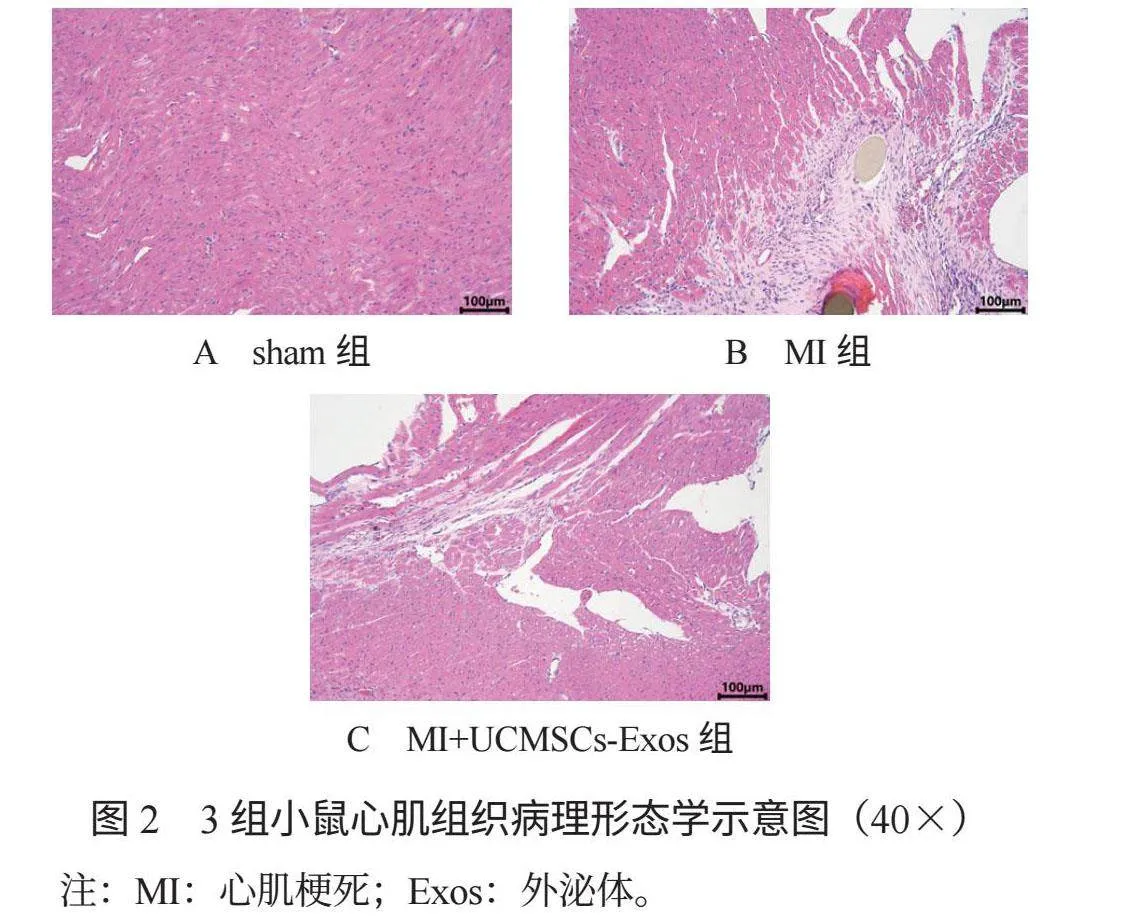
2.3 3組小鼠心肌組織病理形態學比較 術后14 d,與sham組比,MI組與MI+UCMSCs-Exos組小鼠心肌細胞受損、細胞排列紊亂、心肌纖維增生、細胞間隙增大、炎癥細胞浸潤;與MI組比,MI+UCMSCs-Exos組小鼠心肌細胞受損減輕、細胞排列稍紊亂、心肌纖維增生較少、細胞間隙的變化相對較小、炎癥細胞浸潤較少,見圖2。
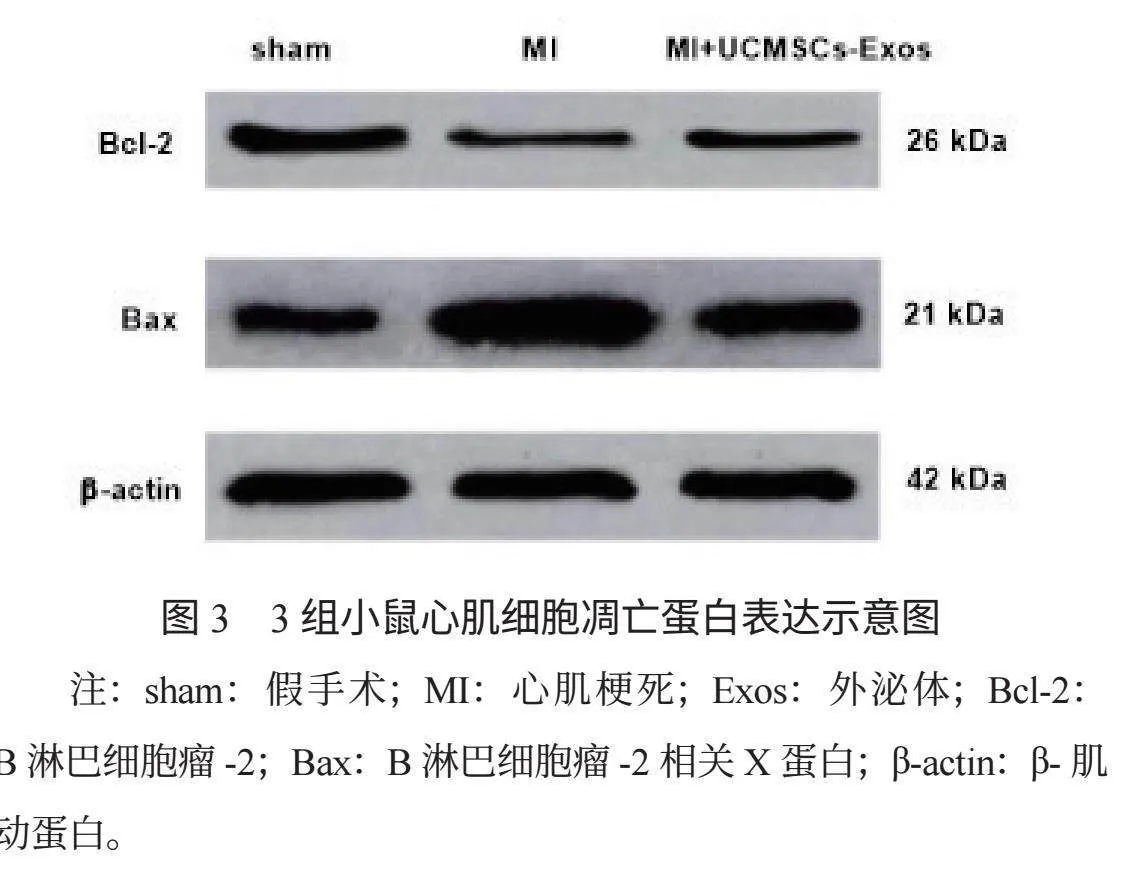
2.4 3組小鼠心肌細胞凋亡蛋白表達水平比較 術后14 d,與sham組比,MI組與MI+UCMSCs-Exos組小鼠心肌細胞中Bcl-2蛋白表達水平下降, MI+UCMSCs-Exos 組高于MI組,Bax蛋白表達水平升高, MI+UCMSCs-Exos 組低于MI組,差異均有統計學意義(均P<0.05),見表2、圖3。
3 討論
MI是臨床上常見的心血管疾病,由MI引起的氧化應激和炎癥反應會導致心肌細胞壞死,最終導致心室重構、心功能受損,影響患者生命安全,且近年來,其發病率呈升高趨勢,加重社會的經濟負擔[4]。藥物治療、介入手術等傳統治療方法可有效降低MI患者的死亡率,但因心室重構無法逆轉,部分患者治療后仍會引起心力衰竭,因此,仍需探索新的治療方法以提高MI的治療效果。
Exos是一類由細胞分泌到胞外的微小囊泡,直徑在30~50 nm之間,其內含有多種活性成分,如蛋白質、miRNA,可參與調節細胞增殖、凋亡、自噬、基因表達等多種生物學過程,目前在神經系統疾病、心血管疾病等多種疾病的治療中受到廣泛關注[5]。Exos可由多種不同細胞分泌而來,其來源不同,在MI中發揮心臟保護的作用機制不同,其中充質干細胞來源的Exos可通過調控下游靶基因的表達影響心肌細胞增殖,從而抑制細胞凋亡,減輕心肌損傷[6]。miRNA是Exos中的關鍵組分,可通過旁分泌作用調節相鄰靶細胞,其中miR-152-3p是由前體miR-152產生的成熟miRNA,可抑制缺氧誘導的大鼠心肌細胞凋亡,縮小心肌梗死區域,有助于促進心肌組織修復[7]。CD63、CD81是UCMSCs分泌的Exos的特異性表面標志物,其表達水平較高表明UCMSCs分泌的Exos含量較高。本研究結果顯示,UCMSCs-Exos組CD63、CD81蛋白表達量及miR-152-3p的相對表達量均高于UCMSCs組,這提示從UCMSCs中成功分離出Exos,且UCMSCs分泌的Exos中的miR-152-3p呈高表達。
LVEF可反映左心室收縮功能,LVFS可反映左心室收縮過程的運動速率,兩者水平下降表明左心室收縮功能減弱;HW/TL是反映心臟肥大程度的重要指標,其比值越大表明心臟肥大越嚴重。本研究結果顯示,術后14 d,與MI組比,MI+UCMSCs-Exos組小鼠血清miR-152-3p、LVEF、LVFS水平均升高,HW/TL水平下降,這提示UCMSCs分泌的Exos可發揮治療作用,改善MI小鼠心功能。分析其原因為,UCMSCs分泌的Exos能夠調節血管內皮細胞的增殖,促進新生血管,有助于抑制心肌纖維化;同時,Exos高表達miR-152-3p,可抑制促凋亡基因的表達,并激活抗凋亡基因,阻斷凋亡信號的傳導,從而抑制心肌細胞的凋亡,有助于改善心功能[8]。本研究中,術后14 d,與MI組比,MI+UCMSCs-Exos組小鼠心肌細胞受損減輕、細胞排列稍紊亂、心肌纖維增生較少、細胞間隙的變化相對較小、炎癥細胞浸潤較少,這提示MI小鼠經UCMSCs分泌的Exos治療后,可減輕炎癥反應,抑制心肌纖維化進程,有效減輕心肌細胞損傷。分析其原因為,UCMSCs分泌的Exos與纖維化疾病的發生、發展有關,其在心肌細胞中表達水平上調,可抑制心肌纖維化蛋白的表達,進而延緩心肌纖維化進程,減輕心肌細胞損傷;同時,Exos中可提高超氧化物歧化酶和過氧化氫酶的活性,降低氧化應激反應,從而減輕氧化損傷,并抑制白細胞介素-6、腫瘤壞死因子-α等多種促炎因子的表達,進一步減輕心肌細胞損傷[9]。本研究中,術后14 d,與MI組比,MI+UCMSCs-Exos組小鼠心肌細胞中Bcl-2蛋白表達水平升高,Bax蛋白表達水平下降,這提示UCMSCs分泌的Exos可抑制MI小鼠心肌細胞凋亡。分析其原因可能為,UCMSCs分泌的Exos可調節下游基因的表達,影響血管平滑肌細胞的增殖,還可抑制硫氧還蛋白結合蛋白的活性,調節氧化應激反應,減輕氧化損傷,從而降低促凋亡蛋白Bax的活性,有助于抑制血管內皮細胞的凋亡[10]。
綜上,UCMSCs來源的Exos可在MI小鼠中發揮保護作用,可抑制心肌細胞凋亡,并減輕心臟組織病理改變,且Exos高表達miR-152-3p,能夠參與調控細胞凋亡過程,有助于改善其心功能。但本研究仍存在一定局限性,未明確Exos對心肌損傷的作用機制,以及與miR-152-3p的關系,后續有待進一步研究。
參考文獻
侯永波, 余駿馬, 朱海娟. 外泌體在心肌梗死治療中的研究新進展[J]. 天津醫藥, 2023, 51(9): 1016-1020.
胡珍艷, 尕永梅, 麥迪乃姆·努爾麥麥提. 間充質干細胞來源的外泌體中miR-143-3p抑制自噬并逆轉心肌缺血再灌注損傷的機制研究[J]. 實用臨床醫藥雜志, 2022, 26(17): 46-52.
ZHAO Z, WU C, HE X, et al. miR-152-3p aggravates vascular endothelial cell dysfunction by targeting DEAD-box helicase 6(DDX6) under hypoxia[J]. Bioengineered, 2021, 12(1): 4899-4910.
張蘋, 郭瑩, 高亞杰, 等. 低氧預處理人臍帶間充質干細胞促進其源性外泌體對心肌梗死后心肌損傷的修復[J]. 中國組織工程研究, 2019, 23(17): 2630-2636.
郝媛媛, 馬愛群, 吳冠吉, 等. 間充質干細胞來源外泌體通過microRNA-210發揮對H2O2誘導的心肌損傷的保護作用[J]. 臨床和實驗醫學雜志, 2020, 19(24): 2577-2581.
劉紐,田振軍,甄志平.外泌體miRNAs在缺血性心臟保護及其運動干預中作用研究進展[J]. 生理科學進展, 2023, 54(5): 375-382.
梁麗英, 陳晶. 外泌體miRNA治療心肌梗死的研究進展[J]. 海南醫學, 2022, 33(24): 3252-3255.
孫鈴, 朱文武, 張健, 等. miR-133a-3p修飾的間充質干細胞外泌體促進心肌梗死后大鼠心肌修復[J]. 中華心血管病雜志, 2024, 52(1): 72-78.
王鑫洋, 陶輝, 丁季飛, 等. miR-152調控糖尿病心肌病心肌成纖維細胞增殖的作用[J]. 中國藥理學通報, 2020, 36(1): 92-96.
吳清權, 張勇, 鐘書輝, 等. miR-152-3p調控硫氧還蛋白結合蛋白表達對過氧化氫誘導的內皮祖細胞凋亡的影響[J]. 中國動脈硬化雜志, 2022, 30(12): 1033-1039.

