油莎豆水通道蛋白基因CeTIP2;1的克隆與分析
摘""要:油莎豆起源于非洲和地中海沿岸,是一種在塊莖中高水平積累油脂的新型草本油料作物。水分平衡對于塊莖的發育與代謝至關重要。液泡膜內在蛋白(TIP)是一類液泡膜定位并具有高效水分轉運活性的水通道蛋白,包含TIP1~5等5個亞類。本研究基于油莎豆的基因組和轉錄組數據,采用RT-PCR技術對1個塊莖高水平表達的TIP基因CeTIP2;1進行克隆。序列分析表明:CeTIP2;1的基因全長3323"bp,含有2個內含子,編碼區長747"bp,編碼248個氨基酸,理論分子量為24.73"kDa,等電點為5.09,總平均疏水指數為0.948,脂肪族指數為114.60,不穩定系數為21.76,屬于穩定的酸性疏水型蛋白,與其液泡膜定位一致;該蛋白含有保守的MIP結構域,其中包括6個跨膜螺旋、2個半螺旋以及2個典型的NPA基序。CeTIP2;1與AtTIP2;1的序列相似性高達87.20%,遠高于與SoPIP2;1的46.23%。進化分析進一步證實,CeTIP2;1隸屬于TIP2亞類,是AtTIP2;1的直系同源基因。進化分析同時顯示TIP2亞類早在單、雙子葉植物分化之前就已經進化出2個小組。表達分析顯示:CeTIP2;1在葉片、葉鞘、根、芽尖、匍匐莖、塊莖等主要組織中均有較高水平的表達,豐度最高的是塊莖和匍匐莖,最低的為芽尖;在塊莖的發育過程中,呈現先升后降的鐘形趨勢,峰值出現在膨大中期,最低的為成熟期。此外,CeTIP2;1還在塊莖的蛋白組中被檢測到,表明其功能的重要性。這些結果為進一步揭示油莎豆的塊莖水分平衡機制奠定堅實的基礎。
關鍵詞:油料作物;塊莖;液泡膜內在蛋白;進化分析;表達模式
中圖分類號:S565.9""""""文獻標志碼:A
Molecular"Cloning"and"Characterization"of"CeTIP2;1,"an"Aquaporin"Gene"from"Tigernut"(Cyperus"esculentus"L.)
ZOU"Zhi,"ZHENG"Yujiao
National"Key"Laboratory"for"Tropical"Crop"Breeding"/"Institute"of"Tropical"Biosciences"and"Biotechnology,"Chinese"Academy"of"Tropical"Agricultural"Sciences"/"Sanya"Research"Institute,"Chinese"Academy"of"Tropical"Agricultural"Sciences,"Haikou,"Hainan"571101,"China
Abstract:"Tigernut"(Cyperus"esculentus"L.),"most"likely"originated"from"Africa"and"Mediterranean,"represents"a"novel"herbaceous"oil"crop"accumulating"high"levels"of"oil"in"its"underground"tubers."Water"balance"is"essential"for"tuber"development"and"metabolism"in"tigernut."Tonoplast"intrinsic"proteins"(TIPs),"which"include"five"phylogenetic"groups"(i.e."TIP1–5),"constitute"a"subfamily"of"aquaporin"facilitating"the"fast"and"passive"transport"of"water"across"vacuolar"membranes."Based"on"available"genome"and"transcriptome"data,"one"TIP"gene"named"CeTIP2;1"was"isolated"from"tigernut"tubers"by"using"the"RT-PCR"technique."Sequence"analysis"showed"that"the"full"gene"length"of"CeTIP2;1"is"3323"bp,"including"two"introns"with"a"coding"sequence"of"747"bp;"the"gene"was"predicted"to"encode"248"amino"acids"with"the"theoretical"molecular"weight"of"24.73"kDa,"the"isoelectric"point"of"5.09,"the"grand"average"of"hydropathicitynbsp;of"0.948,"the"aliphatic"index"of"114.60,"and"the"instability"index"of"21.76,"implying"its"stable,"acidic,"and"hydrophobic"features,"which"is"consistent"with"its"tonoplast-localization;"presencenbsp;of"one"conservative"MIP"domain"was"observed,"which"possesses"six"transmembrane"helices,"two"half"helices,"and"two"typical"NPA"motifs."CeTIP2;1"was"shown"to"exhibit"the"sequence"similarity"of"87.20%"with"AtTIP2;1,"which"was"considerably"higher"than"46.23%"with"SoPIP2;1."Further"phylogenetic"analysis"revealed"that"CeTIP2;1"belongs"to"the"TIP2"group"and"is"a"true"ortholog"of"AtTIP2;1."Interestingly,"the"phylogenetic"analysis"also"supported"that"TIP2"has"diverged"into"two"subgroups"sometime"before"monocot-eudicot"divergence."Tissue-specific"expression"analysis"showed"that"CeTIP2;1"was"highly"expressed"in"all"tissues"examined"in"this"study,"i.e.,"leaf,"sheath,"root,"shoot"apex,"rhizome,"and"tuber,"with"most"in"tuber/rhizome"and"lowest"in"shoot"apex."A"bell-like"expression"pattern"was"observed"during"tuber"development,"peaking"at"the"medium"stage"of"swelling"and"lowest"in"maturation."Moreover,"CeTIP2;1"was"also"detected"in"the"tuber"proteomes,"implying"its"high"abundance"and"key"roles."These"findings"would"lay"a"solid"foundation"for"further"uncovering"the"mechanism"of"water"balance"in"tigernut"tubers.
Keywords:"oil"crop;"tuber;"tonoplast"intrinsic"protein;"phylogenetic"analysis;"expression"profile
DOI:"10.3969/j.issn.1000-2561.2024.08.004
水通道蛋白(aquaporin,"AQP)是一類廣泛存在于生物體內的膜內在蛋白,因其高效的水分轉運活性而得名[1-2]。與動物和微生物相比,植物AQP家族出現了明顯的擴張,主要包含液泡膜內在蛋白(tonoplast"intrinsic"protein,"TIP)、質膜內在蛋白(plasma"membrane"intrinsic"protein,"PIP)、類根瘤26膜內在蛋白(NOD26-like"intrinsic"protein,"NIP)、小分子堿性膜內在蛋白(small"basic"intrinsic"protein,"SIP)和未鑒定膜內在蛋白(X"intrinsic"protein,"XIP)等5大類[2-7]。其中,TIP定位在液泡膜,是介導細胞內水分平衡的關鍵AQP類型[8-12]。根據進化關系,TIP可進一步分為TIP1~5等5個亞類[3-7]。
油莎豆(Cyperus"esculentus"L.),又名油莎草或虎堅果,是一種起源于非洲和地中海沿岸的新型草本油料作物[13]。系統分析顯示,油莎豆隸屬于禾本目莎草科,其單套染色體的基因組大小約為225.6"Mb[14-18]。相比于傳統油料作物在種子中積累油脂,油莎豆是迄今唯一已知在塊莖中高水平積累油脂(24%~35%)的作物,這使其成為研究營養組織油脂代謝與調控的理想模型[14,"19-21]。油莎豆具有適應性廣、抗逆性強、產量高、適合機械化等特點,這有助于在不擠占現有耕地的情況下充分利用沙化邊際土地額外增加我國食用油供給,減少對國外大豆的剛性需求,進而服務國家的戰略需求[22]。作為主要的經濟器官,積極開展塊莖的發育生物學研究具有重要的理論意義和現實價值。本研究報道1個在塊莖中高水平表達的TIP基因CeTIP2;1,其中包括基因結構、序列特征、進化關系及表達特性,以期為下一步的功能分析及塊莖水分平衡機制的闡釋奠定基礎。
1""材料與方法
1.1""材料
1.1.1""植物材料""本研究所用油莎豆品系為熱研3號[14],其中,起始期(起始后1"d)、膨大中期(起始后20"d)、膨大晚期(起始后25"d)和成熟期(起始后35"d)等不同發育時期的塊莖采集于中國熱帶農業科學院熱帶生物技術研究所文昌試驗基地[23]。
1.1.2""菌株、載體及試劑耗材""大腸桿菌(Esc h eri chia"coli)DH5α感受態和植物過表達載體pCAMBIA1301由本實驗室制備和保存;酶、試劑盒及生化試劑購自相應的試劑公司。
1.2""方法
1.2.1""塊莖總RNA的提取和反轉錄""參照文獻[14],采用天根植物多糖多酚RNA提取試劑盒分別提取不同發育時期塊莖的總RNA,并采用賽默飛反轉錄試劑盒合成cDNA第一鏈。
1.2.2""CeTIP2;1基因的克隆與載體構建""為鑒定油莎豆中AtTIP2;1的直系同源基因,首先從CNGBdb(https://db.cngb.org/search/assembl y/CN A 0 051961/)和NCBI(https://www.ncbi.nlm.nih.g ov/"bi o project/703731)數據庫分別下載油莎豆的基因組和轉錄組數據;以AtTIP2;1作為種子,采用本地TBLASTN程序(E值設為1e–10)搜索油莎豆的基因組,并利用StringTie(v2.2.0)將轉錄組數據比對到基因組以界定轉錄區域;根據基因序列設計引物對CeTIP2;1F/R(AAACG GAGACC CA A CAAGCAAAAC/CAACCAAACAAC A TCAG G A A ACCA)和CeTIP2;1HF/R(A G TGGTC TCT G T CCAGTCCTATGGCAGGCATTGCTTTTGG/GGT CTCAGCAGACCACAAGTTTAGTACTCGCTGC TGGACACTGG),分別用于全長cDNA的分離和植物過表達載體的構建,具體的PCR反應和載體構建流程詳見文獻[15]。
1.2.3""序列分析""采用在線軟件GSDS(v2.0)(http://gsds.gao-lab.org/)分析基因結構,并分別用Protparam(https://web.expasy.org/protparam/)、CDD(https://www.ncbi.nlm.nih.gov/cdd)、Plant-"mPLoc"(http://www.csbio.sjtu.edu.cn/bioinf/pla nt-"m ulti/)、SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin /"np sa_automat.pl?"page=/NPSA/npsa_sopma.html)和SWISS-MODEL(https://swissmodel.expasy.org/"interactive)等在線軟件分析蛋白的理化特性、保守結構域、亞細胞定位、二級結構和三級結構。
1.2.4""多序列比對與進化分析""采用MEGA(v6.06)軟件中的MUSCLE進行蛋白多序列比對,其中,跨膜螺旋區和保守殘基根據與已結晶AtTIP2;1[12]和菠菜(Spinacia"oleracea)SoPIP2;1[24]的序列比對進行鑒定;進化樹的構建采用MEGA軟件中的鄰接法以及1000次自舉重復。
1.2.5""轉錄譜分析""轉錄組讀段的比對采用StringTie軟件,并用FKPM(fragments"per"kilobase"of"exon"per"million"fragments"mapped)法均一化基因在不同樣本中的相對表達水平。
1.2.6""蛋白譜分析""油莎豆的蛋白組數據下載于ProteomeXchange/PRIDE(https://www.ebi.ac.uk/"pride/archive/projects/PXD021894),質譜數據的檢索與分析采用Proteome"Discoverer(v2.4.1.15)軟件。
1.2.7""熒光定量分析""參照文獻[17],以CeUCE2作為內參,應用引物對CeTIP2;1Fq/Rq(TCG TCATATTCAGCCCGGTGC/GGGTGCTTACCGGTAAGGTACTTG)進行熒光定量分析,每樣本3次生物學重復。
1.3""數據處理
采用SPSS"20軟件進行統計分析,采用鄧肯單因素多樣本差異顯著性進行方差分析。
2""結果與分析
2.1""CeTIP2;1基因的克隆與序列分析
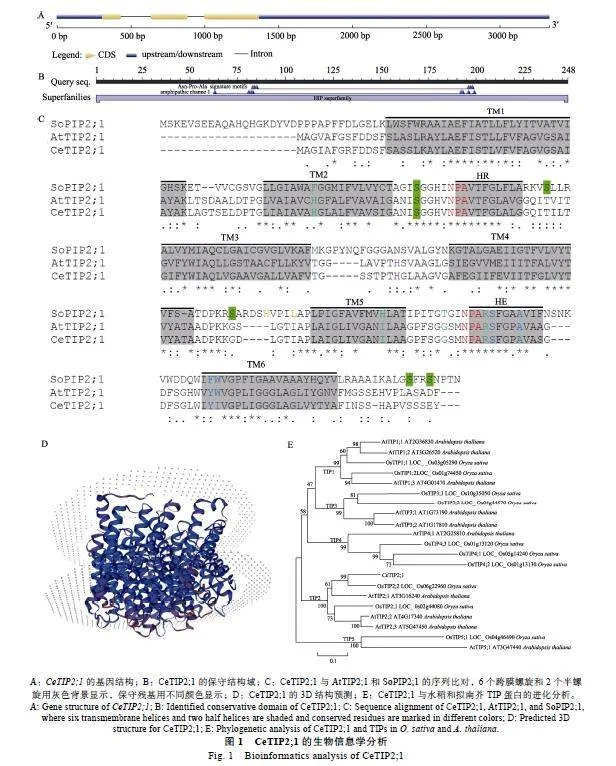
通過同源搜索,從油莎豆基因組的Scaffold27鑒定1個AtTIP2;1同源基因,二者在蛋白水平的序列相似性高達87.20%,將其命名為CeTIP2;1。CeTIP2;1基因的全長為3323"bp,包含2個內含子,5'和3'"UTR分別為307"bp和1956"bp(圖1A)。隨后,采用RT-PCR技術對其747"bp的編碼區序列進行分離,并成功構建了植物過表達載體pCAMBIA1301-CeTIP2;1,桑格測序未發現堿基差異。進一步的序列分析顯示,CeTIP2;1編碼區的GC含量為56.76%,編碼248個氨基酸,理論分子量為24.73"kDa,等電點為5.09,總平均疏水指數為0.948,脂肪族指數為114.60,不穩定系數為21.76,屬于穩定的酸性疏水型蛋白,這與AtTIP2;1類似,但不同于SoPIP2;1的堿性特性(表1)。CDD分析顯示,CeTIP2;1的14~231位為保守的MIP結構域(圖1B)。雖然CeTIP2;1與SoPIP2;1的序列相似性僅為46.23%,但都擁有如圖1C所示的6個跨膜螺旋(TM1~6)、2個半螺旋(HB和HE)以及2個典型的NPA基序。CeTIP2;1的ar/R選擇性濾器為H-I-G-R,與AtTIP2;1一致,但不同于SoPIP2;1的F-H-T-R;CeTIP2;1的Froger位點為T-S-A-Y-I,不同于AtTIP2;1的T-S-A-Y-W和SoPIP2;1的M-S-A-F-W。與SoPIP2;1相比,CeTIP2;1和AtTIP2;1具有較短的N端,且僅含有對應于SoPIP2;1"S96的磷酸化位點;CeTIP2;1的連環C含有1個對應于AtTIP2;1"H131的組氨酸,而SoPIP2;1的相應位點為N(圖1C)。亞細胞定位預測顯示,CeTIP2;1定位在液泡膜。CeTIP2;1的二級結構以無規則卷曲和α-螺旋為主,分別占37.90%和36.29%,這與AtTIP2;1和SoPIP2;1類似(表1)。基于AtTIP2;1的同源建模顯示,CeTIP2;1可形成同源四聚體,每個單體含有6個跨膜螺旋(圖1D)。
2.2""進化分析
為進一步鑒定CeTIP2;1的進化關系,本研究將其與已報道的10個OsTIP和10個AtTIP構建了無根進化樹。如圖1E所示,21個TIP被聚為5組,即TIP1~5。TIP1明顯聚成2個分支,其中一支包括OsTIP1;1、AtTIP1;1和AtTIP1;2,另一支包括OsTIP1;2和AtTIP1;3;TIP2也聚成2個分支,其中一支包括CeTIP2;1、OsTIP2;2和AtTIP2;1,另一支包括OsTIP2;1、AtTIP2;2和AtTIP2;3,表明TIP1和TIP2早在單、雙子葉植物分化之前就已經進化成2個小組。與此相反,TIP3按物種聚在一起,這與AtTIP1;1/1;2、AtTIP2;2/-2;3和OsTIP4-1/4-2/4-3類似,表明這些基因在單雙子葉植物分化之后產生。綜上,這些結果表明CeTIP2;1屬于AtTIP2;1和OsTIP2;2的直系同源基因。
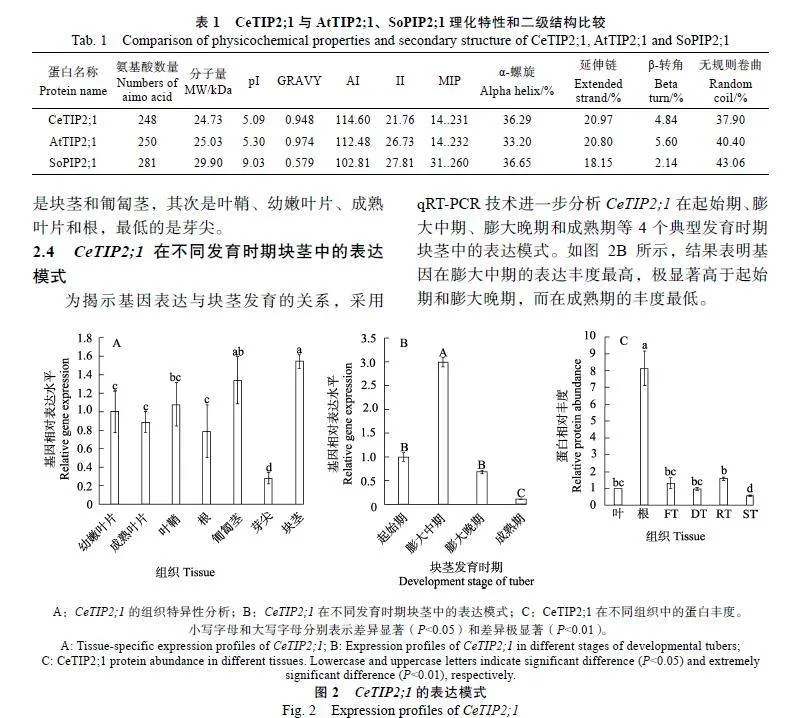
2.3""CeTIP2;1的組織特異性分析
為揭示CeTIP2;1在不同組織中的表達特性,利用轉錄組數據分析其在幼嫩葉片、成熟葉片、葉鞘、根、芽尖、匍匐莖、塊莖等主要組織中的表達模式。如圖2A所示,CeTIP2;1在所有組織中均有較高水平的表達,其中,表達豐度最高的是塊莖和匍匐莖,其次是葉鞘、幼嫩葉片、成熟葉片和根,最低的是芽尖。
2.4""CeTIP2;1在不同發育時期塊莖中的表達模式
為揭示基因表達與塊莖發育的關系,采用qRT-PCR技術進一步分析CeTIP2;1在起始期、膨大中期、膨大晚期和成熟期等4個典型發育時期塊莖中的表達模式。如圖2B所示,結果表明基因在膨大中期的表達豐度最高,極顯著高于起始期和膨大晚期,而在成熟期的豐度最低。
2.5""CeTIP2;1在不同組織中的蛋白定量
為揭示CeTIP2;1在不同組織中的蛋白豐度,研究進一步分析了油莎豆的蛋白組數據,即葉片、根、新鮮收獲的成熟塊莖(RT)、脫水塊莖(DT)、吸水48"h塊莖(RT)和萌發塊莖(ST)。如圖2C所示,結果表明CeTIP2;1在根中的豐度最高,顯著高于吸水48"h塊莖,而在萌發塊莖中的豐度最低;蛋白在塊莖的脫水、吸水過程中差異不顯著,豐度與葉片相當。
3""討論
細胞膜定位的PIP和液泡膜定位的TIP是調控植物細胞水分平衡的主要AQP類型[2,"8]。相比于PIP,TIP高度分化,其在高等植物中至少存在5個亞類,且其決定底物特異性的ar/R選擇性濾器明顯呈現多樣化[3-7]。根據ar/R選擇性濾器的類型及殘基特性,BANSAL等[25]將擬南芥、水稻和玉米中的TIP歸為三大主要類型,第一類包含TIP1(H-I-A-V),第二類包含TIP2、TIP3和TIP4(H-I/M/V-G/A/S-R),第三類包含TIP5(N-V-G-C)。
本研究報道了在油莎豆塊莖中高水平表達的TIP基因CeTIP2;1,其編碼蛋白包含AQP家族特有的MIP結構域,理化特性與AtTIP2;1高度相似,屬于穩定的酸性疏水型蛋白。CeTIP2;1可歸為TIP2亞類,主要依據如下:首先,CeTIP2;1與AtTIP2;1和OsTIP2;2的序列相似性在87%以上;其次,3個蛋白在進化分析中聚在一起,并獨立于OsTIP2;1、AtTIP2;2和AtTIP2;3。這些證據表明CeTIP2;1是AtTIP2;1的直系同源基因,而非AtTIP2;2和AtTIP2;3。根據先前的比較基因組學分析,與AtTIP3;1和AtTIP3;2一樣,AtTIP2;2和AtTIP2;3起源于蕓薹屬特有的α全基因組重復[5,"26]。因為AtTIP2;1和AtTIP2;2/-2;3在水稻中都存在直系同源基因,暗示基因分化發生在單、雙子葉植物分化之前,這與TIP1類似[27]。也就是說,在目前鑒定的5個TIP亞類中,TIP1和TIP2早在單、雙子葉植物分化之前就發生了進一步的分化,因此,從進化角度講,單、雙子葉植物中的TIP分為7個亞類更為適合。基因結構分析顯示,CeTIP2;1含有2個內含子,其內含子數量和位置與AtTIP2;1和OsTIP2;2完全一致[3-4],表明進化的保守性。CeTIP2;1含有2個典型的NPA基序,ar/R選擇性濾器為H-I-G-R,且其連環C含有1個保守的H殘基,這與AtTIP2;1和OsTIP2;2完全一致,表明其具有類似的生物學功能。在蟾蜍卵母細胞和酵母體系中功能分析顯示,AtTIP2;1和OsTIP2;2可轉運水分、尿素和氨[10,"12,"28-29]。CeTIP2;1的重要性還體現在其泛組織、高水平表達。由于現有蛋白組技術的靈敏性,一般只有較高豐度的蛋白才能檢測到。先前研究表明,NIEMEYER等[30]采用nanoLC-MS/MS技術對45個樣本進行了蛋白組分析,合計僅檢測到2257個蛋白。本研究的定量分析顯示,CeTIP2;1在葉片、根和4個時期的塊莖中均被檢測到,表明其在這些組織中的高水平表達。事實上,組織特異性分析顯示CeTIP2;1是1個泛組織表達基因,其在塊莖中的高水平表達與塊莖的高含水量及活躍的生理代謝是相適應的。據前期研究結果表明,油莎豆塊莖發育早期的含水量一致維持在85%左右,在膨大晚期和成熟期逐漸降低到75%和45%[23]。CeTIP2;1在塊莖發育過程中的表達模式與水分含量趨勢基本一致,峰值出現在膨大中期,而在膨大晚期和成熟期逐漸降低。CeTIP2;1在成熟期的顯著下調可能與其蛋白組中豐度低于根組織有關。
綜上,本研究報道了1個油莎豆TIP2基因CeTIP2;1,該基因含有2個內含子,屬于AtTIP2;1的直系同源基因。該基因在不同組織中均高水平表達,與這些組織特別是塊莖的水分平衡密切相關,這為下一步的功能分析及油莎豆水分平衡機制的闡釋奠定基礎。
參考文獻
[1]"PRESTON"G"M,"CARROLL"T"P,"GUGGINO"W"B,"AGRE"P."Appearance"of"water"channels"in"Xenopus"oocytes"express ing"red"cell"CHIP28"protein[J]."Science,"1992,"256(5055):"385-387.
[2]"MAUREL"C,"VERDOUCQ"L,"LUU"D"T,"SANTONI"V."Plant"aquaporins:"membrane"channels"with"multiple"integrated"functions[J]."Annual"Review"of"Plant"Biology,"2008,"59:"595-624.
[3]"JOHANSON"U,"KARLSSON"M,"JOHANSSON"I,"GUSTAVSSON"S,"SJ?VALL"S,"FRAYSSE"L,"WEIG"A"R,"KJELLBOM"P."The"complete"set"of"genes"encoding"major"intrinsic"proteins"in"Arabidopsis"provides"a"framework"for"a"new"nomenclature"for"major"intrinsic"proteins"in"plants[J]."Plant"Physiology,"2001,"126(4):"1358-1369.
[4]"SAKURAI"J,"ISHIKAWA"F,"YAMAGUCHI"T,"UEMURA"M,"MAESHIMA"M."Identification"of"33"rice"aquaporin"genes"and"analysis"of"their"expression"and"function[J]."Plant"and"Cell"Physiology,"2005,"46(9):"1568-1577.
[5]"ZOU"Z,"GONG"J,"HUANG"Q,"MO"Y"Y,"YANG"L"F,"XIE"G"S."Gene"structures,"evolution,"classification"and"expression"profiles"of"the"aquaporin"gene"family"in"castor"bean"(Ricinus"communis"L.)[J]."PLoS"One,"2015,"10(10):"e0141022.
[6]"ZOU"Z,"YANG"L"F,"GONG"J,"MO"Y"Y,"WANG"J"K,"CAO"J"H,"AN"F,"XIE"G"S."Genome-wide"identification"of"Jatropha"curcas"aquaporin"genes"and"the"comparative"analysis"provides"insights"into"the"gene"family"expansion"and"evolution"in"Hevea"brasiliensis[J]."Frontiers"in"Plant"Science,"2016,"7:"395.
[7]"ZOU"Z,"YANG"J"H."Genome-wide"comparison"reveals"divergence"of"cassava"and"rubber"aquaporin"familynbsp;genes"after"the"recent"whole-genome"duplication[J]."BMC"Genomics,"2019,"20:"380.
[8]"WUDICK"M"M,"LUU"D"T,"MAUREL"C."A"look"inside:"localization"patterns"and"functions"of"intracellular"plant"aquaporins[J]."New"Phytologist,"2009,"184(2):"289-302.
[9]"MAUREL"C,"REIZER"J,"SCHROEDER"J"I,"CHRISP EE LS"M"J."The"vacuolar"membrane"protein"γ-TIP"creates"water"specific"channels"in"Xenopus"oocytes[J]."EMBO"Journal,"1993,"12(6):"2241-2247.
[10]"LOQUé"D,"LUDEWIG"U,"YUAN"L,"VON"WIRéN"N."Tonoplast"intrinsic"proteins"AtTIP2;1"and"AtTIP2;3"facilitate"NH3"transport"into"the"vacuole[J]."Plant"Physiology,"2005,"137(2):"671-680.
[11]"CHU"T"T"H,"HOANG"T"G,"TRINH"D"C,"BUREAU"C,"MEYNARD"D,"VERNET"A,"INGOUFF"M,"DO"N"V,"PéRIN"C,"GUIDERDONI"E,"GANTET"P,"MAUREL"C,"LUU"D"T."Sub-cellular"markers"highlight"intracellular"dynamics"of"membrane"proteins"in"response"to"abiotic"treatments"in"rice[J]."Rice"(N"Y),"2018,"11(1):"23.
- KIRSCHT"A,"KAPTAN"S"S,"BIENERT"G"P,"CHAUMONT"F,"NISSEN"P,"DE"GROOT"B"L,"KJELLBOM"P,"GOURDON"P,"JOHANSON"U."Crystal"structure"of"an"ammonia-permeable"aquaporin[J]."PLoS"Biology,"2016,"14(3):"e1002411.
- DE"CASTRO"O,"GARGIULO"R,"DEL"GUACCHIO"E,"CAPUTO"P,"DE"LUCA"P."A"molecular"survey"concerning"the"origin"of"Cyperus"esculentus"(Cyperaceae,"Poales):"two"sides"of"the"same"coin"(weed"vs."crop)[J]."Annals"of"Botany,"2015,"115(5):"733-745.
- 鄒智,"趙永國,"張麗,"孔華,"郭運玲,"郭安平."基于單分子實時測序的油莎豆全長轉錄組分析[J]."中國油料作物學報,"2021,"42(2):"229-235.
ZOU"Z,"ZHAO"Y"G,"ZHANG"L,"KONG"H,"GUO"Y"L,"GUO"A"P."Single-molecule"real-time"(SMRT)-based"full-length"transcriptome"analysis"of"tigernut"(Cyperus"esculentus"L.)[J]."Chinese"Journal"of"Oil"Crop"Sciences,"2021,"43(2):"229-235."(in"Chinese)
- 肖艷華,"鄒智,"趙永國,"郭安平,"張麗."油莎豆乙酰乳酸合酶基因CeALS的克隆與分析[J]."生物技術通報,"2022,"38(4):"184-192.XIAO"Y"H,"ZOU"Z,"ZHAO"Y"G,"GUO"A"P,"ZHANG"L."Molecular"cloning"and"characterization"ofnbsp;an"acetolactate"synthase"gene"(CeALS)"from"tigernut"(Cyperus"esculentus"L.)[J]."Biotechnology"Bulletin,"2022,"38(4):"184-192."(in"Chinese)
- 鄒智,"肖艷華,"張麗,"趙永國."油莎豆5-烯醇式丙酮酰莽草酸-3-磷酸合酶基因CeEPSPS的克隆與分析[J]."熱帶作物學報,"2023,"44(1):"26-34.ZOU"Z,"XIAO"Y"H,"ZHANG"L,"ZHAO"Y"G."Cloning"and"characterization"of"CeEPSPS,"a"gene"encoding"5-enolpyru vyl shikimate-3-phosphate"synthase"from"tigernut"(Cyperus"esculentus"L.)[J]."Chinese"Journal"of"Tropical"Crops,"2023,"44(1):"26-34."(in"Chinese)
- ZOU"Z,"XIAO"Y"H,"ZHANG"L,"ZHAO"Y"G."Analysis"of"Lhc"family"genes"reveals"development"regulation"and"diurnal"fluctuation"expression"patterns"in"Cyperus"esculentus,"a"Cyperaceae"plant[J]."Planta,"2023,"257(3):"59.
- ZHAO"X,"YI"L,"REN"Y,"LI"J,"REN"W,"HOU"Z,"SU"S,"WANG"J,"ZHANG"Y,"DONG"Q,"YANG"X,"CHENG"Y,"LU"Z."Chromosome-scale"genome"assembly"of"the"yellow"nutsedge"(Cyperus"esculentus)[J]."Genome"Biology"Evolution,"2023,"15(3):"evad027.
- TURESSON"H,"MARTTILA"S,"GUSTAVSSON"K"E,"HOFVANDER"P,"OLSSON"M"E,"BüLOW"L,"STYMNE"S,"CARLSSON"A"S."Characterization"of"oil"and"starch"accumulation"in"tubers"of"Cyperus"esculentus"var."sativus"(Cyperaceae):"A"novel"model"system"to"study"oil"reserves"in"nonseed"tissues[J]."American"Journal"of"Botany,"2010,"97(11):"1884-1893.
- 徐碩,"鄒智,"肖艷華,"張麗,"孔華,"郭靜遠,"郭安平."油莎豆塊莖油脂積累相關基因CeWRI1的克隆與功能分析[J]."熱帶作物學報,"2022,"43(5):"923-929.XU"S,"ZOU"Z,"XIAO"Y"H,"ZHANG"L,"KONG"H,"GUO"J"Y,"GUO"A"P."Cloning"and"functional"characterization"of"CeWRI1,"a"gene"involved"in"oil"accumulation"from"tigernut"(Cyperus"esculentus"L.)"tubers[J]."Chinese"Journal"of"Tropical"Crops,"2022,"43(5):"923-929."(in"Chinese)
- ZOU"Z,"ZHENG"Y"J,"ZHANG"Z"T,"XIAO"Y"H,"XIE"Z"N,"CHANG"L"L,"ZHANG"L,"ZHAO"Y"G."Molecular"characterization"of"oleosin"genes"in"Cyperus"esculentus,"a"Cyperaceae"plant"producing"oil"in"underground"tubers[J]."Plant"Cell"Reports,"2023,"42(11):"1791-1808.
- 張學昆."我國油莎豆產業研發進展報告[J]."中國農村科技,"2019(287):"67-69.ZHANG"X"K."Research"progress"of"the"tigernut"industry"in"China[J]."China"Rural"Science"Technology,"2019(287):"67-69."(in"Chinese)
- ZOU"Z,"ZHAO"Y"G,"ZHANG"L,"XIAO"Y"H,"GUO"A"P."Analysis"of"Cyperus"esculentus"SMP"family"genes"reveals"lineage-specific"evolution"and"seed"desiccation-like"transcript"accumulation"during"tuber"maturation[J]."Industrial"Crops"and"Products,"2022,"187:"115382.
- TORNROTH-HORSEFIELD"S,"WANG"Y,"HEDFALK"K,"JOHANSON"U,"KARLSSON"M,"TAJKHORSHID"E,"NEUTZE"R,"KJELLBOM"P."Structural"mechanism"of"plant"aquaporin"gating[J]."Nature,"2006,"439(7077):"688-694."
- BANSAL"A,"SANKARARAMAKRISHNAN"R."Homology"modeling"of"major"intrinsic"proteins"in"rice,"maize"and"Arabidopsis:"comparative"analysis"of"transmembrane"helix"association"and"aromatic/arginine"selectivity"filters[J]."BMC"Structural"Biology,"2007,"7:"27.
- ZOU"Z,"ZHENG"Y"J,"XIE"Z"N."Analysis"of"Carica"papaya"informs"lineage-specific"evolution"of"the"aquaporin"(AQP)"family"in"Brassicales[J]."Plants"(Basel),"2023,"12(22):"3847.
- 鄭玉皎,"趙永國,"常麗麗,"鄒智."油莎豆液泡膜內在蛋白基因CeTIP1;1的克隆與分析[J]."中國油料作物學報,"2024,"39(4):"184-192."ZHENG"Y"J,"ZHAO"Y"G,"CHANG"L"L,"ZOU"Z."Molecular"cloning"and"characterization"of"CeTIP1;1,"a"gene"encoding"tonoplast"intrinsic"protein"from"Cyperus"esculentus"tubers[J]."Chinese"Journal"of"Oil"Crop"Sciences,"2024,"39(4):"184-192."(in"Chinese)
- LIU"L"H,"LUDEWIG"U,"GASSERT"B,"FROMMER"W"B,"VON"WIRéN"N."Urea"transport"by"nitrogen-regulated"tonoplast"intrinsic"proteins"in"Arabidopsis[J]."Plant"Physiology,"2003,"133(3):"1220-1228.
[29]"LI"G"W,"PENG"Y"H,"YU"X,"ZHANG"M"H,"CAI"W"M,"SUN"W"N,"SU"W"A."Transport"functions"and"expression"analysis"of"vacuolar"membrane"aquaporins"in"response"to"various"stresses"in"rice[J]."Journal"of"Plant"Physiology,"2008,"165(18):"1879-1888.
[30]"NIEMEYER"P"W,"IRISARRI"I,"SCHOLZ"P,"SCHMITT"K,"VALERIUS"O,"BRAUS"G"H,"HERRFURTH"C,"FEUSSNER"I,"SHARMA"S,"CARLSSON"A"S,"DE"VRIES"J,"HOFVA NDER"P,"ISCHEBECK"T."A"seed-like"proteome"in"oil-rich"tubers[J]."The"Plant"Journal,"2022,"112(2):"518-534.

