西瓜對低氮脅迫響應的轉錄組分析



摘要:氮是植物必需的大量元素之一,對于西瓜生長發育至關重要。為闡明西瓜響應低氮脅迫的作用機制,對連續低氮脅迫下西瓜的表型變化進行分析,并利用Illumina Novaseq平臺對3個氮素水平(CK、N1、N3)處理下第15天的西瓜葉片進行轉錄組測序。結果表明,低氮處理促進了西瓜地下根系伸長,但對地上植株長度和地上鮮重有明顯抑制作用,處理后植株表現出地上部矮小的癥狀。轉錄組測序結果顯示,在CK/N1、N1/N3、CK/N3對比中,分別鑒定出121、1 184、516個差異表達基因(differentially expressed genes,DEGs),其中共有的DEGs有12個,上調1個和下調11個,下調表達基因主要通過煙酰胺合成酶、bHLH轉錄因子、糖轉運蛋白、葉綠素代謝等通路來響應低氮脅迫,而上調表達基因與酪氨酸代謝有關。綜上,西瓜響應低氮脅迫是個復雜的過程,經轉錄組鑒定的與氮脅迫相關的關鍵基因在提高西瓜對低氮脅迫的耐受性以及提高西瓜的氮利用效率方面有重要作用。以上研究結果為深入研究西瓜低氮脅迫響應機理奠定了基礎。
關鍵詞:西瓜;響應;低氮脅迫;轉錄組分析doi:10.13304/j.nykjdb.2024.0156
中圖分類號:S651 文獻標志碼:A 文章編號:10080864(2024)12003009
氮是植物體內蛋白質、核酸以及磷脂的重要組成部分,也是植物生長發育必需的大量元素之一,氮素缺乏會嚴重影響植物的生長發育、物質代謝和產量形成等[12]。土壤中可供植物吸收的氮素是有限的,人們經常通過施用過量氮肥來達到高產的目的。我國氮肥的平均利用率僅為33%[3]。高氮投入和低氮素利用效率(nitrogen useefficiency,NUE)不僅會增加作物生產成本,還會破壞生態環境,導致土壤酸化[4]、水體富營養化[56]、溫室效應和大氣污染[78]等,進而威脅人類健康。當前,減少氮肥投入、提高作物NUE是農業生產中亟需解決的問題。闡明作物對低氮耐受性的作用機制并選育耐低氮、氮高效利用的種質資源是實現“減氮增效”、降低環境污染最經濟有效的途徑,對于實現農業生產綠色和可持續發展也具有十分重要的意義。
植物吸收氮素最常見的形式是硝酸鹽(NO? 3)和銨鹽(NH+ 4),其中NO?3 是主要形式[9]。氮以NO?3 和NH+4 的形式通過其轉運體被根系吸收。對大多數植物來說,根部同化吸收NO?3 后大部分被運送到地上莖部[10]。在同化過程中,NO?3 在葉片細胞質中先由硝酸還原酶(nitrate reductase,NR)還原為亞硝酸鹽;然后,在葉綠體中亞硝酸鹽還原酶(nitritereductase,NIR)和細胞質中谷氨酰胺合成酶(glutamine synthetase,GS)作用下被還原為NH+4[11-12]。這些合成的含氮化合物作為氨基酸、蛋白質和其他含氮代謝物的前體參與植物的生長發育[1314]。氮素供應不足時,植物會出現生長緩慢、葉片變黃、產量降低等癥狀[15-17],植株的光合能力也會減弱,導致生長不良[18-20]。研究證明,氮代謝過程中的關鍵基因對于促進植物的耐低氮程度、提高NUE具有十分重要的作用[21-23]。
RNA-Seq高通量測序技術被廣泛用于多種作物的轉錄組分析,如油菜、小麥、水稻等,目的在于檢測與缺氮有關的基因,并研究氮脅迫下可能的調控機制[24-26]。在低氮處理下, 甘藍型油菜可以通過調控 BnaNRTs、BnaGN1s、BnaNIAs 家族基因提高NUE, 同時調控BnaMYBs、BnaWRKYs 家族和可變剪接積極適應低氮脅迫[24]。小麥響應低氮脅迫的重要途徑有3條,即鈣介導的植物?病原體相互作用、MAPK 信號通路和磷脂酰肌醇信號通路[25]。在水稻響應低氮脅迫過程中,根系通過調控與氮吸收利用、碳代謝和根系生長發育相關的基因來適應低氮環境[26]。
西瓜是我國重要的經濟作物。研究表明,氮對西瓜生長具有十分重要的作用,它能顯著促進西瓜生長發育,提高光合速率、產量、果實品質和水分利用效率[27];而氮素不足會嚴重影響西瓜生長,如缺氮會影響西瓜幼苗葉綠素熒光特性,進而降低生物量,不利于果實發育期果實膨大等[28]。由此可見,西瓜生長受低氮脅迫影響較大,但目前關于低氮脅迫影響西瓜生長的調控機制仍認識有限。因此,研究低氮脅迫對西瓜生長及其基因表達的影響對提高西瓜的NUE、獲得高品質西瓜具有重要意義。本研究利用轉錄組測序技術分析西瓜生長過程對低氮脅迫的響應,鑒定與低氮脅迫相關的差異表達基因,為進一步研究西瓜生長響應低氮脅迫的分子機制奠定基礎。
1 材料與方法
1.1 試驗材料
供試西瓜品種為‘滿春’,由開封市農林科學研究院提供。經前期試驗篩選,該材料對低氮條件適應性較好。
1.2 試驗方法
挑選出大小一致、籽粒飽滿的西瓜種子,用蒸餾水清洗干凈后,平鋪于濾紙上瀝干水分后,用紗布包好放置在28 ℃恒溫培養箱中催芽。待催芽結束,將種子播種于72孔穴盤中,放置在人工氣候室培養(25 ℃/14 h光照,18 ℃/10 h黑暗);培養至3葉1心,挑選長勢均勻的幼苗,清洗干凈根部基質,注意保護根系的完整性,轉移至含氮量分別為0.750 0(N1)、0.075 0 mmol·L?1 (N2)和0.007 5 mmol·L?1(N3)的營養液(改良的1/2 Hoagland配方,pH 7.0)進行低氮脅迫處理,以含氮量為7.500 0 mmol·L?1為對照(CK),連續培養22 d,每3 d更換1次營養液。各處理營養液配制如下。
1.3 西瓜幼苗表型測定
分別在脅迫第8、第15和第22天測定幼苗的地上部長度和鮮重、地下部長度和鮮重。每處理6株,3次重復。
1.4 西瓜幼苗響應低氮脅迫的轉錄組測序
1.4.1 樣品獲取 在脅迫第15天分別取CK、N1、N3處理的葉片,提取總RNA,質量檢測合格后送北京果殼生物科技有限公司利用Illumina Novaseq平臺進行轉錄組測序。每處理3株, 2次重復。
1.4.2 樣品檢測與文庫構建 測序后獲得的原始數據(raw data),經過濾后得到有效數據(cleandata),與西瓜參考基因組(http://cucurbitgenomics.org/ftp/genome/watermelon/97103/v2/)進行序列比對,得到比對數據(mapped data),用于新基因挖掘、差異表達分析、差異表達基因(differentiallyexpressed genes,DEGs)功能注釋和功能富集等生物信息學分析。
1.4.3 差異基因篩選 各樣本基因表達量用每千個堿基的轉錄每百萬映射讀取的片段數(fragments per kilobase of transcript per million"mapped reads,FPKM)算法[1]進行歸一化處理。
利用差異倍數(fold change,FC)和錯誤發現率(1 discovery rate,FDR)篩選DEGs,將FC≥2.00 且FDRlt;0.05 作為篩選標準。對DEGs 進行GO(gene ontology)功能注釋和富集分析,利用KEGG(Kyoto encyclopedia of genes and genomes)數據庫進行通路注釋分析,應用STRING軟件對DEGs進行蛋白質互作分析。
1.5 數據分析
利用Excel 2010 軟件進行數據處理和繪圖,采用SPSS 22.0 軟件進行數據分析,利用Duncan’s 多重比較法進行差異顯著性比較。
2 結果與分析
2.1 低氮脅迫條件下對西瓜生長表型的影響
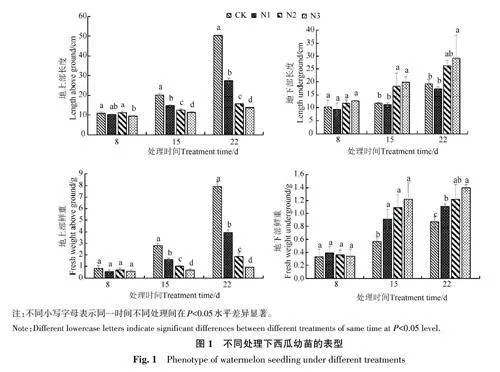
在連續低氮脅迫處理下,幼苗生長發育受阻,表現出植株矮小等癥狀(圖1)。在第8天,幼苗地上部鮮重、地下部鮮重和地下部長度在4個處理間均無顯著差異,但N3 處理的地上部長度顯著低于CK和N2處理;隨著處理時間的延長,CK處理的地上部長度、地上部鮮重、地下部長度和地下部鮮重均呈逐漸增加趨勢,N1和N2處理也有類似趨勢;在第15和第22天,幼苗的地上部長度和地上部鮮重隨著氮脅迫的加強顯著降低,其中N2和N3處理的地下部長度均大于CK。此外,在第8、第15和第22天時,N1處理的地下部鮮重均高于CK,其中在第15和第22天顯著高于CK。由此表明,低氮脅迫初期,西瓜幼苗在不同氮素水平處理下的表型變化較小;隨著低氮脅迫時間的延長,脅迫程度越強,對幼苗表型的影響越大,低氮脅迫促進根系的伸長,但對于地上部生長有明顯抑制作用。
2.2 西瓜響應低氮脅迫的轉錄組分析
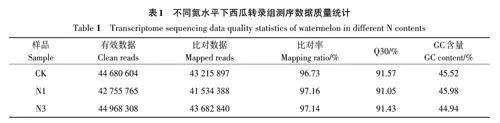
2.2.1 轉錄組測序數據分析 對CK、N1和N3處理第15 天的葉片進行轉錄組測序,結果(表1)表明,檢測到的有效數據分別為44 680 604、42 755 765和44 968 308,獲得比對基因組的數據分別為43 215 897、41 534 388和43 682 840,比對效率分別為96.73%、97.14% 和97.16%,Q30堿基百分比分別是91.05、91.43和91.57,GC含量分別為44.94%、45.52%和45.98%。
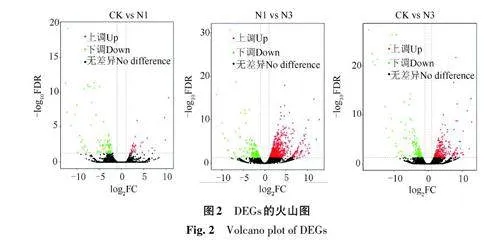
2.2.2 DEGs分析 由表2和圖2可知,CK 與N1相比,共發現121 個DEGs,其中上調34 個,下調87個;N1與N3相比,DEGs共1 184個,其中上調843 個,下調341 個;CK 與N3 相比,DEGs 共516個,其中上調327個,下調189個。
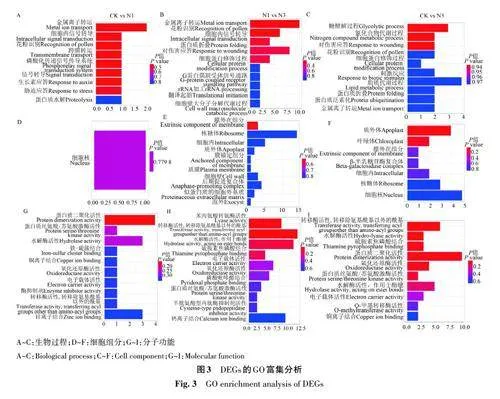
2.2.3 DEGs的GO富集分析 對CK與N1、N1與N3、CK 與N3 間的DEGs 分別進行GO 富集分析(圖3)發現,均包括生物學過程(biological process)、細胞組分(cellular component)和分子功能(molecularfunction),GO 注釋數量分別是110、1 134、484個。富集顯著的生物學過程均包括花粉識別、金屬離子轉運和蛋白質代謝相關過程;富集顯著的分子功能均包括電子載體活性、轉移酶活性、轉移除氨基酰基以外的酰基、氧化還原酶活性、蛋白質絲氨酸/蘇氨酸激酶活性、水解酶活性;由于CK/N1富集顯著的細胞組分只有細胞核,因此在3組對比中暫未發現均顯著的細胞組分。以上結果表明,低氮脅迫對西瓜特定生長發育階段的花粉發育、金屬離子轉運以及與之有關的分子功能影響較大。
2.2.4 DEGs 的KEGG 通路富集分析 對CK 與N1、N1與N3、CK與N3間的DEGs分別進行KEGG通路富集分析(圖4)發現,富集最為顯著的20個代謝通路均包括苯丙烷類物質生物合成、類黃酮生物合成、酪氨酸代謝、異喹啉生物堿的生物合成,其中苯丙烷類物質生物合成在3組對比中的DEGs數量分別為7、26、22個,這些基因有上調表達,也有下調表達;類黃酮生物合成在3 組對比中的DEGs數量分別為1、8、7個,這些基因在CK與N1對比中,均為下調表達,在N1與N3、CK與N3對比中,有上調表達,也有下調表達;酪氨酸代謝在3組對比中的DEGs數量分別是2、9、7個,且均為上調表達;異喹啉生物堿的生物合成在3組對比中的DEGs數量分別為1、7、5個,均為上調表達。綜上表明,低氮脅迫下DEGs可能主要通過這些代謝通路上調或者下調影響西瓜的生長發育。
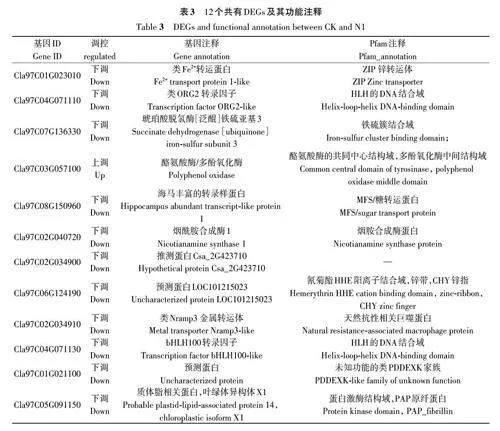
2.2.5 關鍵DEGs分析 為進一步分析西瓜幼苗響應低氮脅迫的關鍵基因,以 FDR≤0.01 且FC≥2.00 為標準,從CK 與N1、N1 與N3、CK 與N3 的DEGs中查找共有基因,結果(表3)發現,3組對比的DEGs 中共有12 個共有的DEGs,其中有11 個下調表達,這11個基因有4個(Cla97C01G023010、Cla97C07G136330、Cla97C02G040720、Cla97C02G0-34910)編碼鐵、鋅、鐵-硫等轉運蛋白、金屬轉運體以及與金屬離子轉運相關的煙酰胺合成酶基因,有2 個(Cla97C04G071110、 Cla97C04G071130)編碼bHLH 轉錄因子,有1個(Cla97C08G150960)編碼糖轉運蛋白,還有1個(Cla97C05G091150)與葉綠素代謝有關,有3 個(Cla97C06G124190、Cla97C01G021100、Cla97C02G034900)未注釋到功能,為推測蛋白;Cla97C03G057100在3組對比中均為上調表達,該基因編碼多酚氧化酶,與酪氨酸代謝有關。以上結果表明,這12 個共同的DEGs可能在西瓜響應低氮脅迫過程中發揮重要作用,主要通過煙酰胺合成酶、bHLH 轉錄因子、糖轉運蛋白、葉綠素代謝相關蛋白、酪氨酸代謝相關蛋白的下調或上調來響應低氮脅迫。
3 討論
氮是植物生長發育過程的重要營養元素。研究表明,氮供應不足,植物表現出明顯的應答反應,如水稻、玉米、煙草及地毯草等在缺氮條件下生長受到嚴重抑制,表現生長慢、葉片黃、產量低、干物質量少等癥狀,植株會通過根系伸長來吸收深層土壤中的硝態氮,以便獲得更高的NUE[15-17]。本研究表明,連續的低氮脅迫使西瓜幼苗根系伸長,但地上部生長受到顯著抑制,由此表明,提高植株NUE對促進植物生長發育具有重要意義。
本研究利用轉錄組測序技術對低氮脅迫15 d的西瓜幼苗葉片進行分析發現,CK 與N1、N1與N3、CK 與N3 對比的DEGs 分別有121、1 184、516個,與大麥[10]、小麥[25]、水稻[26]、馬鈴薯[29]等作物中DEGs數量差異較大,說明不同物種對低氮脅迫的響應程度不同。GO富集分析顯示,CK與N1的DEGs主要參與金屬離子轉運、信號轉導、花粉識別等過程;N1與N3的DEGs主要參與金屬離子轉運、信號轉導、花粉識別、蛋白質代謝等過程;CK 與N3 的DEGs 主要參與糖酵解、氮代謝等過程,與前人研究結果[10,25,29]類似;但在3組對比中,均有DEGs參與蛋白質代謝、花粉識別和金屬離子轉運,行使電子載體活性、轉移酶活性、氧化還原酶活性、蛋白質絲氨酸/蘇氨酸激酶活性、水解酶活性等功能,說明西瓜幼苗響應低氮脅迫除了主要通過參與光合作用、氮代謝、蛋白質代謝等關鍵基因外,參與花粉識別和金屬離子轉運的基因也起重要作用。KEGG富集通路分析顯示,CK與N1、N1與N3、CK與N3對比中均包含多種代謝通路,如光合生物鐘的碳固定、光合作用,天線蛋白、乙醛酸鹽和二羧酸鹽代謝、碳代謝、氨基酸的生物合成、氮代謝等,與大麥中的結果[10]類似;在3組對比中,均包括的代謝通路有苯丙烷類物質生物合成、類黃酮生物合成、酪氨酸代謝和異喹啉生物堿的生物合成,說明低氮脅迫下西瓜DEGs可能通過多種代謝通路起作用。
為了響應土壤中有效氮水平的變化,植物進化出了復雜的適應策略。前人對植物響應低氮脅迫的分子調控機制進行了較多研究,證明植物響應低氮脅迫的關鍵調控基因與植物對低氮脅迫的耐受性和獲得較高NUE密切相關。Zhang等[21]利用全基因組分析方法在大豆中發現了1個特異的GATA 基因(GmGATA44),該基因具有抗低氮脅迫的功能。He等[30]在小麥中過表達TaNAC2-5A 可促進根系生長,提高硝酸鹽流入速率,從而提高根系獲取氮的能力。Tang 等[23]在水稻中過表達玉米 C4-PEPC 基因,可提高低氮脅迫下的光呼吸通路,從而增強轉基因株系對低氮脅迫的耐受性、提高產量。Wang 等[31]在玉米中過表達玉米內源2-烯醛還原酶ZmAER 基因,顯著提高了轉基因植物對低氮脅迫的耐受性。本研究基于轉錄組測序技術,對CK與N1、N1與N3、CK與N3進行對比,發現共同的關鍵DEGs 12個,其中11個下調表達,1個上調表達。在下調表達基因中有 4 個(Cla97C01-G023010、Cla97C07G136330、Cla97C02G040720、Cla97C02G034910)是編碼鐵、鋅、鐵-硫等轉運蛋白以及與金屬離子轉運相關的煙酰胺合成酶(nicotianamine synthase, NAS),其他下調基因主要是通過bHLH轉錄因子、糖轉運蛋白、葉綠素代謝等通路來響應低氮脅迫;上調表達基因則與酪氨酸代謝有關。這些基因可能在增強西瓜對低氮脅迫的耐受性以及提高西瓜NUE方面有重要作用,為進一步深入研究西瓜低氮脅迫響應機制奠定了基礎。
參考文獻
[1] DU Q G, YANG J, SYED MUHAMMAD SADIQ S, et al ..Comparative transcriptome analysis of different nitrogen responses in low-nitrogen sensitive and tolerant maize genotypes [J]. J. Integr. Agric., 2021,20(8):2043-2055.
[2] SHIN S Y, JEONG J S, LIM J Y, et al .. Transcriptomic analyses of rice (Oryza sativa) genes and non-coding RNAs under nitrogen starvation using multiple omics technologies [J].BMC Genom., 2018,19(1):1-20.
[3] PENG S B, BURESH R J, HUANG J L, et al .. Improving nitrogen fertilization in rice by sitespecific N management. a review [J]. Agron. Sustain. Dev., 2010,30(3):649-656.
[4] YANG F, ZHANG Z L, BARBERáN A, et al .. Nitrogeninduced acidification plays a vital role driving ecosystem functions: insights from a 6-year nitrogen enrichment experiment in a Tibetan alpine meadow [J/OL]. Soil Biol.Biochem., 2021, 153: 108107 [2024-02-20]. https://doi.org/10.1016/j.soilbio.2020.108107.
[5] GAUDINIER A, RODRIGUEZ-MEDINA J, ZHANG L F, et al..Transcriptional regulation of nitrogen-associated metabolism and growth [J]. Nature, 2018,563:259-264.
[6] SHI X L, CUI F, HAN X Y, et al .. Comparative genomic and transcriptomic analyses uncover the molecular basis of high nitrogen-use efficiency in the wheat cultivar Kenong 9204 [J].Mol. Plant, 2022,15(9):1440-1456.
[7] ZHOU Z H, WANG C K, ZHENG M H, et al .. Patterns and mechanisms of responses by soil microbial communities to nitrogen addition [J]. Soil Biol. Biochem., 2017,115:433-441.
[8] LUO L, RAN L, RASOOL Q Z, et al .. Integrated modeling of U.S. agricultural soil emissions of reactive nitrogen and associated impacts on air pollution, health, and climate [J].Environ. Sci. Technol., 2022,56(13):9265-9276.
[9] LIU Q, CHEN X B, WU K, et al .. Nitrogen signaling and use efficiency in plants: what’s new? [J]. Curr. Opin. Plant Biol.,2015,27:192-198.
[10] WANG G, WANG J, YAO L, et al .. Transcriptome and metabolome reveal the molecular mechanism of barley genotypes underlying the response to low nitrogen and resupply [J/OL]. Int. J. Mol. Sci., 2023,24(5):4706 [2024-02-20]. https://doi.org/10.3390/ijms24054706.
[11] SCHEURWATER I, KOREN M, LAMBERS H, et al .. The contribution of roots and shoots to whole plant nitrate reduction in fastand slowgrowing grass species [J]. J.Exp.Bot., 2002, 53(374):1635-1642.
[12] MIFLIN B J. Distribution of nitrate and nitrite reductase in barley [J]. Nature, 1967,214:1133-1134.
[13] NAWAZ M A, WANG L M, JIAO Y Y, et al .. Pumpkin rootstock improves nitrogen use efficiency of watermelon scion by enhancing nutrient uptake,cytokinin content,and expression of nitrate reductase genes [J]. Plant Growth Regul., 2017,82(2):233-246.
[14] LUO J, LI H, LIU T X, et al .. Nitrogen metabolism of two contrasting poplar species during acclimation to limiting nitrogen availability [J]. J. Exp. Bot., 2013,64(14):4207-4224.
[15] SAENGWILAI P, TIAN X L, LYNCH J P. Low crown root number enhances nitrogen acquisition from low-nitrogen soils in maize [J]. Plant Physiol., 2014,166(2):581-589.
[16] WEI S S, WANG X Y, SHI D Y, et al .. The mechanisms of low nitrogen induced weakened photosynthesis in summer maize (Zea mays L.) under field conditions [J]. Plant Physiol.Biochem., 2016,105:118-128.
[17] HE L, TENG L, TANG X,et al .. Agro-morphological and metabolomics analysis of low nitrogen stress response in Axonopus compressus [J/OL]. Aob Plants, 2021,13(4):plab022[2024-02-20] . https://doi.org/10.1093/aobpla/plab022.
[18] 董玥,陳雪平,趙建軍,等.低氮脅迫不同氮效率基因型茄子光合特性差異[J].華北農學報,2009,24(1):181-184.
DONG Y, CHEN X P, ZHAO J J, et al .. Differences of photosynthetic characteristics in the nitrogen efficiency genotypes of eggplant under low nitrogen stress [J]. Acta Agric.Boreali-Sin., 2009,24(1):181-184.
[19] 李強,羅延宏,余東海,等.低氮脅迫對耐低氮玉米品種苗期光合及葉綠素熒光特性的影響[J]. 植物營養與肥料學報,2015,21(5):1132-1141.
LI Q, LUO Y H, YU D H, et al .. Effects of low nitrogen stress on photosynthetic characteristics and chlorophyll fluorescence parameters of maize cultivars tolerant to low nitrogen stress at the seedling stage [J]. J. Plant Nutr. Fert., 2015,21(5):1132-1141.
[20] LI L, GAO W, PENG Q,et al .. Two soybean bHLH factors regulate response to iron deficiency [J]. J. Integr. Plant Biol.,2018,60(7):608-622.
[21] ZHANG C, HOU Y, HAO Q, et al .. Genome-wide survey of the soybean GATA transcription factor gene family and expression analysis under low nitrogen stress [J/OL]. PLoS One, 2015,10(4):e0125174 [2024-02-20]. https://doi.org/10.1371/journal.pone.0125174.
[22] QU B Y, HE X, WANG J, et al .. A wheat CCAAT box-binding transcription factor increases the grain yield of wheat with less fertilizer input [J]. Plant Physiol., 2015,167(2):411-423.
[23] TANG Y T, LI X, LU W, et al .. Enhanced photorespiration in transgenic rice over-expressing maize C4 phosphoenolpyruvate carboxylase gene contributes to alleviating low nitrogen stress [J].Plant Physiol. Biochem., 2018,130:577-588.
[24] 肖燕,姚珺玥,劉冬,等.甘藍型油菜響應低氮脅迫的表達譜分析[J].作物學報,2020,46(10):1526-1538.
XIAO Y, YAO J Y, LIU D, et al .. Expression profile analysis of low nitrogen stress in Brassica napus [J]. Acta Agron. Sin.,2020,46(10):1526-1538.
[25] YAN H, SHI H, HU C, et al .. Transcriptome differences in response mechanisms to low-nitrogen stress in two wheat varieties [J/OL]. Int. J. Mol. Sci., 2021,22(22):12278 [2024-02-20]. https://doi.org/10.3390/ijms222212278.
[26] WANG W, XIN W, CHEN N,et al .. Transcriptome and coexpression network analysis reveals the molecular mechanism of rice root systems in response to low-nitrogen conditions [J/OL].Int. J. Mol. Sci., 2023,24(6):5290 [2024-02-20]. https://doi.org/10.3390/ijms24065290.
[27] ALKHADER A M F, QARYOUTI M M, OKASHA T M. Effect of nitrogen on yield, quality, and irrigation water use efficiency of drip fertigated grafted watermelon (Citrullus lanatus) grown on a calcareous soil [J]. J. Plant Nutr., 2019,42(2):1-12.
[28] 杜少平,馬忠明,唐超男,等. 基于SPAD的西瓜氮素營養診斷與推薦施肥技術研究 [J]. 中國土壤與肥料, 2023 (12):200-209.
DU S P, MA Z M, TANG C N, et al.. Study on nitrogen nutrition diagnosis and fertilizer recommendation of watermelon based on SPAD value [J]. Soil Fert. Sci. China, 2023 (12):200-209.
[29] 張婷婷,孟麗麗,劉曉蕊,等.馬鈴薯氮代謝對低氮脅迫的響應及轉錄組分析[J].西北農林科技大學學報(自然科學版),2022,50(8):15-26.
ZHANG T T,MENG L L,LIU X R,et al.. Response of nitrogen metabolism of potato to low nitrogen stress and transcriptome analysis [J]. J. Northwest A&F Univ. (Nat. Sci.), 2022,50(8):15-26.
[30] HE X, QU B Y, LI W J,et al .. The nitrate-inducible NAC transcription factor TaNAC2-5A controls nitrate response and increases wheat yield [J]. Plant Physiol., 2015, 169(3): 1991-2005.
[31] WANG Y, ZHAO Y, WANG S,et al .. Up-regulated 2-alkenal reductase expression improves low-nitrogen tolerance in maize by alleviating oxidative stress [J]. Plant Cell Environ., 2021,44(2):559-573.

