基于轉錄組和代謝組解析川芎對鎘脅迫的響應機制

關鍵詞:川芎;鎘脅迫;轉錄組;代謝組
川芎是傘形科藁本屬植物川芎(Ligusticumchuanxiong Hort.)的干燥根莖。作為川產道地藥材,早在公元1153年(宋朝),四川都江堰一帶就有川芎的種植和藥用記錄[1]。目前,川芎的核心道地產區是四川盆地的彭州、什邡、都江堰、眉山等地,國內90% 以上的商品藥材都來源于此[2]。但近年來川芎在出口時曾多次因重金屬超標問題而被銷毀[3],重金屬超標問題是川芎國際貿易壁壘的主要成因。川芎重金屬污染中鎘(Cd)污染尤為突出[4],而栽培土壤生物及理化特性是導致川芎Cd污染的主要原因[5]。在川芎中,Cd主要富集在其根部以及根莖,Cd脅迫能抑制川芎葉片的光合速率,并顯著降低根莖中阿魏酸和川芎嗪含量[6]。因此,需要利用更多技術手段來控制中藥材的品質安全,使中藥材質量達到穩定、有效、安全、可控。
代謝組學利用氣相色譜- 質譜(gaschromatography-mass spectrometry,GC-MS)、液相色譜- 質譜(liquid chromatographytandem-massspectrometry,LC-MS/MS)等先進技術研究生物體內代謝產物的變化及其隨時間的演變[7],能更好地理解植物受重金屬等逆境脅迫下的生物代謝過程。羅慶[8]利用代謝組學技術探究Cd、鉛(Pb)污染下東南景天根系抵御和富集重金屬的作用機制,發現車前可以通過調節糖類和氨基酸類等差異代謝物來響應土壤Cd 脅迫[9]。此外,轉錄組技術也被用來探究植物體Cd脅迫的應答機制。汪京超[10]鑒定出油菜體內與Cd吸收和代謝相關的轉運蛋白和功能基因;王書鳳[11]通過轉錄組學分析,篩選出Cd 累積高效油菜品種P78 和低效油菜品種P72,并闡明了Cd累積高、低效品種響應Cd脅迫的主要機制。
目前,對中藥材川芎Cd脅迫的研究主要集中在Cd對植物生長發育和生理生化的影響方面,在轉錄組測序分析方面的研究尚處于起步階段,而有關吸收或轉運Cd的基因也未發現,極大限制了耐Cd新品種川芎的選育。因此,本研究以川芎為試驗材料,采用超高效液相色譜質譜聯用(ultraperformance liquid chromatography tandem massspectrometry,UPLC-MS/MS)技術測定代謝組數據并解析川芎根莖代謝物的差異表達,結合轉錄組學技術對川芎中Cd轉運相關同源基因進行研究,從基因表達的角度分析川芎受Cd脅迫后的基因變化規律,揭示川芎響應Cd脅迫的防御機制,以期為川芎Cd污染耕地種植提供理論依據與科學支撐,為川芎資源的合理利用提供方向。
1 材料與方法
1.1 試驗材料
試驗材料來自四川省農業科學院經濟作物研究所篩選的川芎,于2021年9月9日栽種于成都市青白江區光明村溫室大棚內。該研究采用盆栽試驗,花盆規格為42 cm×28 cm×28 cm(上徑×下徑×高),盆栽基質按農田土∶草炭土∶珍珠巖∶河沙=25∶4∶1∶8的體積比混勻,每盆裝基質19 kg,每盆栽種6株川芎。以不添加Cd溶液的清潔土壤為對照(CK),設置1(Cd1)、3(Cd3)、6(Cd6)、10 mg·kg-1(Cd 10)共4 個Cd 脅迫處理水平。CdCl2·2.5H2O(析純試劑)以溶液形式施入土壤中充分混勻,平衡4周后栽入川芎。在2022年6月21日(即川芎收獲期),快速將川芎根莖挖出并沖去表面泥土后分成2份,分別用于轉錄組和代謝組紙標的測定。每個處理取3株長勢相同的川芎(分別用-1、-2、-3表示,如Cd 1的3株材料分別為Cd1-1、Cd1-2和Cd1-3),將其根莖切分、裝袋后放入液氮中備用。
1.2 試驗方法
1.2.1 代謝組測定及分析 ①樣品制備。將川芎根莖置于40 ℃烘箱中烘干,研磨成粉末后過100目篩。稱取50.00 mg的川芎粉末樣品,加入1.00 mL的提取液(提取液的組成為甲醇:乙腈∶水=2∶2∶1,體積比),維持其內標水平在20 mg·L?1。通過30 s的渦旋,保證樣品與提取液充分混勻。在45 Hz下添加鋼珠進行研磨處理,10 min后將樣品放入冰水浴中進行10 min的超聲處理。然后,?20 °C靜置1 h,4 °C、12 000 r·min?1離心15 min,取其上清液500 μL。通過真空濃縮器將分離的代謝產物干燥后加入160 μL提取液(乙腈與水的體積比為1∶1),復溶后再次超聲離心,得到120 μL的上清液。每個樣取10 μL混勻,制成質控(quality control,QC)樣本用于后續檢測[12]。
② 色譜條件。使用Waters Acquity I-ClassPLUS UPLC/Xevo G2-XS Q-TOF 超高效液相色譜質譜聯用儀(沃特世,美國)進行測定,每個樣品平行3次測量。色譜柱為Waters ACQUITITY UPLC高速鋼T3色譜柱(2.1 mm×100 mm,1.8 μm);在負離子模式下進行測定,流動相A為0.1 %甲酸水溶液,流動相B為0.1 %甲酸乙腈;進樣體積設置為1 μL。
③ 質譜條件。采用Waters Xevo G2-XS Q-TOF高分辨率質譜儀(沃特世,美國)以MSe模式采集一次和二次質譜數據。低碰撞能量:2 V;離子源溫度:150 °C;高碰撞能量范圍:10~40 V;質譜掃描頻率:0.2 s;負離子模式下毛細管電壓:?1 500 V;反沖洗氣體流量:50 L·h?1;脫溶氣體流量:800 L·h?1。
④ 方法學考察。通過觀察QC樣品間內標峰高與空白樣品中內標峰條件的差異,判斷儀器是否穩定,檢測過程中是否存在殘留,結果顯示,內標在QC樣品中的保留時間和響應強度都比較穩定,儀器的數據采集穩定性很好,空白樣品中除內部標準品外,未檢測到明顯的峰。證明該方法可用于本次試驗。
⑤ 數據分析。采用MassLynx V4.2軟件獲取原始數據,利用Progenesis QI軟件對其進行峰提取、峰對等數據分析。利用已建立的Biomark自建庫以及METLIN數據庫進行鑒別,將理論片段鑒定和質量偏差控制在100 ppm以內。在此基礎上,將原始峰面積信息與總峰面積進行歸一化處理后,利用主成分分析和Spearman相關分析,對各組內樣品及質量控制樣品進行可重復性評價。在京都基因與基因組百科全書數據庫(kyotoencyclopedia of genes and genomes,KEGG)、人類代謝組數據庫(human metabolome database,HMDB)和脂質圖數據庫中搜索鑒定出的化合物以獲取分類和途徑信息。經過統計分析,確定不同組分之間的差異倍數(fold change,FC),并計算其差異顯著性P 值。使用正交偏最小二乘判別分析(orthogonal projections to latent structuresdiscriminant analysis,OPLS-DA)模型,篩選出具有顯著性的差異累積代謝物(differential accumulatedmetabolite, DAMs),以FCgt;1、Plt;0.05、變量投影重要性(variable importance in projection,VIP)gt;1作為篩選指標[13]。采用超幾何分布分析方法,分析代謝產物在KEGG通路中的富集情況。
1.2.2 轉錄組測定及分析 ① RNA提取。使用RNA提取試劑盒(酷來博,北京)對川芎根莖RNA進行提取;利用分光光度計NanoDrop 2000(賽默飛,美國)檢測提取的RNA純度(OD260/280)和含量;采用Agient2100/LabChip GX儀器(安捷倫,美國)進行高精度檢測以確保RNA完整性。
② cDNA文庫構建。樣本檢測合格后,利用含有Oligo(dT)的磁珠對真核mRNA進行富集,再添加Fragmentation Buffer 將mRNA 片段隨機打斷。以獲得的mRNA為模板,分別合成2條cDNA鏈,并對其進行純化。在此基礎上,利用AMPureXP beads進行片段篩選,得到240 bp左右的片段,經PCR擴增獲得cDNA文庫。
③ 文庫質控。使用實時熒光定量PCR(qRTPCR)定量文庫有效水平(文庫有效水平大于2 nmol·L-1),通過質量檢測后,利用IlluminaNovaSeq 6000(因美納,美國)進行高質量測序,獲得Raw data。經過篩選最終得到高質量的Cleandata[14]。
④ 序列拼接及功能注釋。將所得到的CleanData采用Trinity軟件進行序列組裝拼接,利用DeBruijn 圖識別各個片段集合中的轉錄本序列(transcript)。Unigene序列通過與NR、Swiss-Prot、COG、KOG、eggNOG4.5、KEGG 數據庫進行比對,整合數據庫分析得到基因的注釋結果。
⑤ 差異表達分析。用FPKM 分析基因表達量,與Unigene庫進行對比。使用DESeq2軟件進行差異分析,對得到的差異表達基因進行KEGG富集分析。
2 結果與分析
2.1 代謝組學分析
2.1.1 差異累積代謝物統計 由圖1A可知,在不同Cd 處理水平的川芎根莖中,共標注和定量了1 238種差異累積代謝物(DAMs),根據其分子結構可分為氨基酸、有機酸、脂肪酸、酮類、糖類、酰胺類和其他共7大類。與CK相比,Cd1、Cd3、Cd6、Cd10處理的DAMs總數分別為283、252、172、531個,其中上調代謝物數目均高于下調代謝物數目。Cd10處理的DAMs 最多,包括346 個上調代謝物和185個下調代謝產物; Cd6處理的DAMs最少,包括111個上調代謝物和61個下調代謝物。
對DAMs進行分析,由圖1B韋恩圖可知,CKvs Cd1 與CK vs Cd10 共有DAMs 數量最多,為134個,而4組共有差異代謝物僅為14個。這14種差異代謝物包括泛酸鹽、1-O-阿魏-D葡萄糖、多邊形內酯、多球殼菌素、阿非迪霉素、亞油酸等。
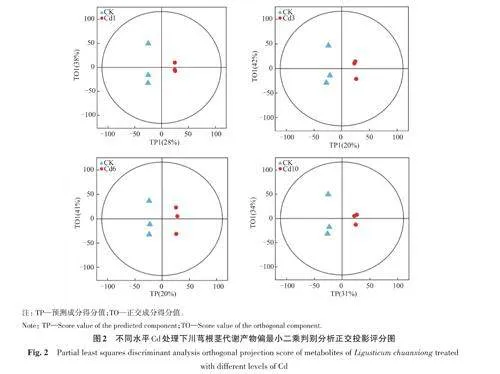
2.1.2 不同處理間差異代謝物分析 利用正交偏最小二乘判別分析(OPLS-DA)發現(圖2),CK的根莖樣品可以從Cd處理組中顯著分離出來。其主要貢獻來自 Cd10處理的531種代謝物(其中185種上調,346種下調),造成差異的主要原因是其他氨基酸的代謝、乙醛酸鹽和二羧酸鹽代謝。與CK相比,Cd10處理中所有氨基酸,包括丙氨酸、天冬氨酸、苯丙氨酸、酪氨酸、色氨酸、精氨酸、甘氨酸、絲氨酸、蘇氨酸均上調,而泛醌和其他萜類醌下調。
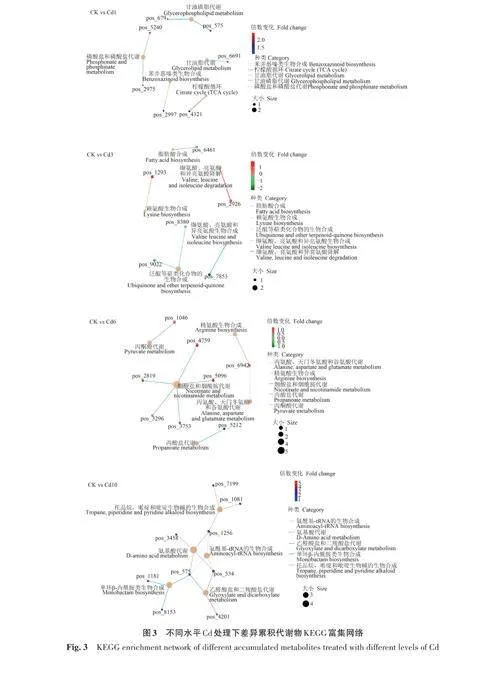
2.1.3 KEGG代謝途徑分析 將鑒別代謝物注釋入KEGG數據庫,共獲得76條代謝通路。由圖3可知,在Cd10處理組的531種代謝物中,乙醛酸鹽和二羧酸鹽代謝、氨基酸代謝、氨酰基-tRNA的生物合成等通路顯著富集(Plt;0.05)。Cd1處理組的283種代謝物中,上調的主要代謝通路包括檸檬酸循環、甘油磷脂代謝等。在Cd3處理組的252種代謝物中主要上調的通路有纈氨酸、亮氨酸和異亮氨酸降解通路,賴氨酸生物合成通路;主要下調的通路有纈氨酸、亮氨酸和異亮氨酸生物合成通路,脂肪酸生物合成通路等。Cd處理組172種代謝物中上調的通路有煙酸鹽和煙酰胺代謝通路,丙酮酸代謝通路,丙氨酸、天門冬氨酸和谷氨酸代謝通路;主要下調的通路有丙酸鹽代謝通路,精氨酸生物合成通路等。
2.2 轉錄組學分析
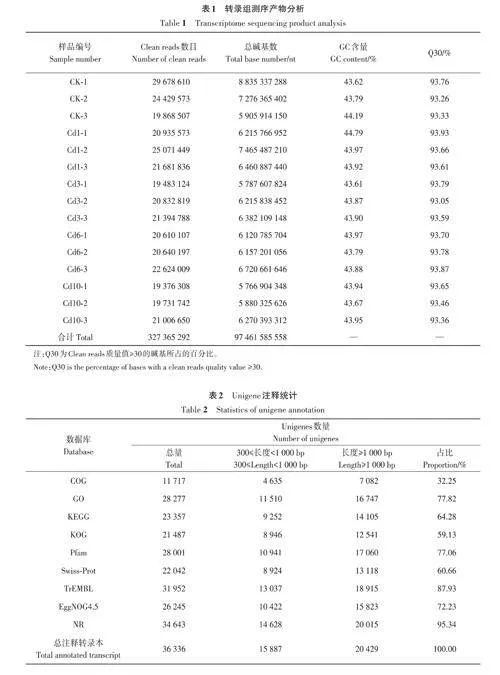
2.2.1 轉錄組序列分析 對不同水平鎘脅迫下的川芎樣品進行測序(表1),共得到97.46 Gb Cleanreads,各個樣品的Clean reads 達到5.77 Gb,其中CK 處理組共有73 976 690 條; Cd1 處理組共有67 688 858條;Cd3處理組共有61 710 731條;Cd6處理組共有63 874 313 條;Cd10 處理組共有60 114 700條。總堿基數為97 461 585 558 nt,各樣品的GC 含量占比均不低于43.61%,其中Q30堿基所占比例不低于93.05%。
2.2.2 文庫構建及Unigene功能注釋 經過組裝后,共獲得42 069條Unigenes,其中長度在2 000 bp以上的Unigene數量最多,占32.19%。Unigene總長度為69 203 497 bp,平均長度為1 645 bp。UnigeneN50長度一般用于評估組裝結果質量,當UnigeneN50≥800 bp時,認為組裝序列的完整性較好。本研究中Unigene N50長度為2 876 bp,表明川芎樣品的組裝完整性較好,可用于后續的試驗分析。通過數據庫比對,共注釋到36 336條Unigenes(表2),其中注釋率最高的是NR 數據庫,注釋Unigenes 有34 643條,占總注釋Unigenes的95.34%。
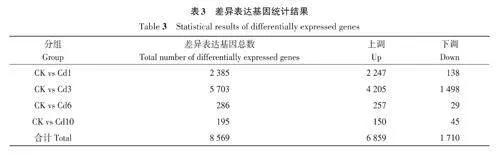
2.2.3 差異表達基因統計 如表3所示,本研究共篩選到8 569 個差異表達基因(differentiallyexpressed genes, DEGs),其中上調基因有6 859個,下調基因有1 710 個。在CK vs Cd3中篩選到的DEGs數量最多,為5 703個,包括上調基因4 205個和下調基因1 498 個;DEGs 數量最少的是CK vsCd10組,共得到195個DEGs,包括150個上調基因和45個下調基因。
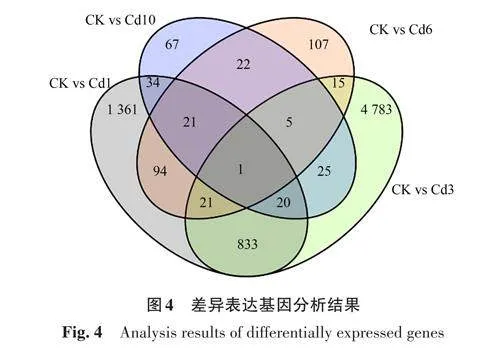
2.2.4 不同處理間差異表達基因分析 對DEGs進行分析,由圖4可知,CK vs Cd1與CK vs Cd3共有DEGs 為875 個,CK vs Cd1 與CK vs Cd6 共有DEGs 為137 個,CK vs Cd1 與CK vs Cd10 共有DEGs 為76個,而3組共有DEGs僅為22個;CK vsCd3 與CK vs Cd6 共有DEGs 為 42 個,CK vs Cd3與CK vs Cd10 共有DEGs 為 51 個,CK vs Cd6 與CK vs Cd10共有DEGs為 49個,而4組共有DEGs僅有1個,為CML19。
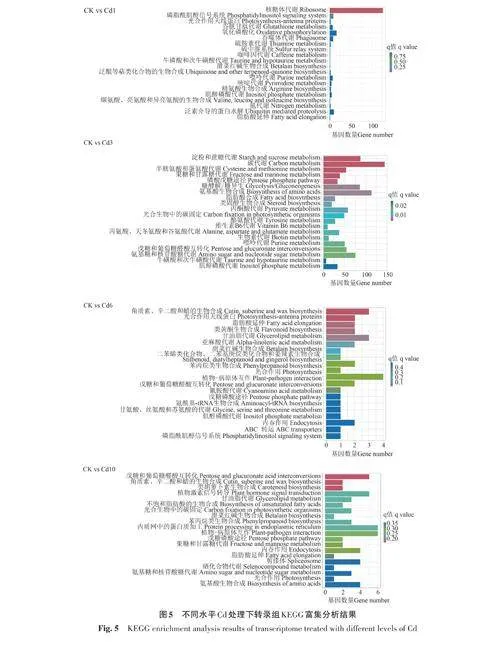
2.2.5 KEGG通路注釋分析 通過KEGG對川芎根莖4個不同處理組DEGs進行富集分析(圖5),有4 025個DEGs被注釋到167條KEGG代謝通路中。顯著性富集分析表明,CK vs Cd3有20 條達到顯著水平(Plt;0.05),包括碳代謝、磷酸戊糖途徑、糖酵解/糖異生、氨基酸生物合成、丙酮酸代謝、酪氨酸代謝等通路;CK vs Cd1中基因數目相對較多的代謝通路是核糖體代謝;CK vs Cd6 中相關基因數目相對較多的代謝通路有甘油脂代謝、亞麻酸代謝、植物?病原體互作等;CK vsCd10中相關基因數目相對較多的代謝通路有戊糖和葡萄糖醛酸互轉化、植物激素信號傳導、內質網中的蛋白質加工、植物?病原體互作等。
2.3 轉錄組與代謝組聯合分析
為更好地探究川芎抵抗Cd脅迫時的作用機制,將差異代謝物與差異基因進行關聯分析發現,4個不同處理組共注釋得到24條通路。CK vsCd1 中共有10 條通路,其中碳代謝通路共連接73個DEGs和DAMs,數目最多;CK vs Cd3有10條通路,碳代謝連接的最多,為144個,其次是氨基酸生物合成,有116個;CK vs Cd6中連接最多的是酪氨酸代謝,共5個;CK vs Cd10中苯丙烷類生物合成與ABC 通道轉運均連接7 個DEGs 和DAMs。碳代謝與ABC通道轉運通路僅在Cd6處理組未見。4組處理共有通路有1條,為氨基酸生物合成,主要積累丙氨酸、組氨酸、苯丙氨酸、絲氨酸等氨基酸。
3 討 論
3.1 氨基酸是川芎在Cd 脅迫下的標志性物質
代謝調節是植物應對各種脅迫的重要機制之一。本研究發現,氨基酸類在川芎根系抗Cd脅迫中發揮重要作用,它們所占的比例較大,并參與了不飽和脂肪酸、異喹啉生物堿、氨酰基-tRNA和酪氨酸的生物合成,這與在Cd脅迫時水稻幼苗中的研究結果一致[15]。紫花苜蓿葉片在響應漬水脅迫時顯著上調丙氨酸、天冬氨酸和谷氨酸代謝等[16],而川芎在受到Cd脅迫時主要上調丙氨酸、天門冬氨酸、甘氨酸、絲氨酸、蘇氨酸和谷氨酸代謝,精氨酸、苯丙氨酸、纈氨酸、酪氨酸和色氨酸等生物合成,說明植物受到非生物脅迫時,可能產生部分相同氨基酸來應答逆境脅迫。特定氨基酸及其代謝可提高植物受到逆境脅迫時的耐受性[17],通過轉錄組與代謝組聯合分析發現,其共有通路為氨基酸生物合成,主要積累丙氨酸、組氨酸、苯丙氨酸、絲氨酸等氨基酸。組氨酸可以調節其他氨基酸的生物合成以及金屬離子的螯合和轉運[18];馬洪娜等[19]認為,苯丙氨酸不僅提供了抗氧化劑還為朱砂根葉片適應鈣脅迫提供能量;絲氨酸是合成蛋白質和其他生物分子所必需的,包括核苷酸和絲氨酸衍生的脂類(如磷脂酰絲氨酸和鞘脂),并參與抵抗各種外界刺激[20-22]。其中,絲氨酸在輕度Cd 脅迫(1、3 mg·kg-1)中上調更大;丙氨酸在中(6 mg·kg-1)、重度(10 mg·kg-1)Cd脅迫時的上調貢獻較大,說明在不同的Cd脅迫水平下,川芎根莖中氨基酸的抗Cd脅迫模式不同。因此,氨基酸類物質可能是用于鑒別川芎根莖是否受到不同程度Cd脅迫的標志性物質。
3.2 Cd 脅迫對川芎糖類代謝和脂質代謝的影響
本研究顯示,川芎在受到Cd脅迫后的差異基因主要參與了糖類、氨基酸、脂類生物合成等代謝途徑,這與玉米、菜心等植物受到Cd脅迫后的轉錄組分析結果相似[23-24]。在植物受到非生物脅迫時,將累積糖類物質以適應環境的變化[25]。糖類的積累可以調節細胞滲透壓,以維持細胞的滲透平衡[26]。在受到干旱脅迫時,植物通過運輸蔗糖至根尖部位來抵御脅迫,維持正常生長[27];Cd脅迫下,冬小麥根中水蘇糖、蔗糖和甘露糖含量增加[28];Cd脅迫下的水稻中糖類含量也表現出相上升趨勢[29]。而本研究中發現,當川芎受到3 mg·kg-1 Cd脅迫時,根莖中的蔗糖含量呈現出顯著增加的趨勢,說明川芎通過積累糖類來調節細胞滲透壓,維持細胞的滲透平衡并減少Cd對自身的危害。
脂質代謝作為植物生長發育過程中的基本代謝之一,是重要的儲能物質和信號分子[30]。在受到低溫脅迫時,小麥根尖中的不飽和脂肪酸含量增加,有利于提高細胞膜的流動性,以適應外界的低溫環境[31]。本研究中,Cd脅迫下川芎可能通過增加脂肪酸、亞麻酸、甘油酯等代謝物的含量來增加細胞膜的流動性,以適應外界的Cd 脅迫環境。
3.3 川芎抗Cd 脅迫的關鍵基因CML19
對差異基因進行分析發現,CML19 在每個Cd處理組中表達都上調,推測CML19 可能為川芎抗Cd 的關鍵基因。研究表明,類鈣調蛋白(calmodulin-like protein,CML)是植物細胞中的鈣離子結合蛋白,在植物生長發育和逆境脅迫的信號轉導中具有重要功能[32]。CML9 突變體能提高擬南芥對干旱和鹽害的耐受性,并產生支鏈氨基酸的積累[33-34];CML13 對逆境脅迫的響應非常靈敏,其在無苞芥響應逆境生理生態環境中可能起著重要作用[35];在受到鹽脅迫時,AtCML37、AtCML38 和AtCML39 基因均上調表達[36]。
綜上所述,川芎通過調節糖類代謝、脂質代謝來響應Cd脅迫,以減少對自身的傷害。通過代謝組和轉錄組分析發現,氨基酸類可作為川芎受Cd脅迫時的標志性物質,而丙氨酸、絲氨酸等氨基酸則可用于判斷川芎受Cd脅迫程度大小。川芎受Cd脅迫時的差異基因CML19 與已有研究中有關作物調節Cd脅迫的關鍵基因相似,可能是川芎響應Cd脅迫的關鍵基因。在未來,可以對CML19進行進一步的克隆與功能鑒定,將有助于進一步闡明川芎對Cd脅迫的響應以及產生差異的分子機制。

