超聲輔助花生分離蛋白復合菊粉糖基化反應條件的優化及性質研究

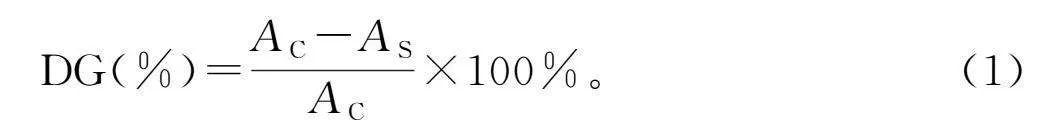

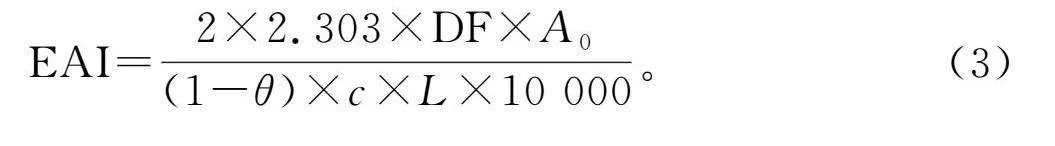



摘要:以超聲輔助花生分離蛋白復合菊粉進行糖基化制備蛋白多糖復合物,考察不同接枝條件對花生分離蛋白與菊粉復合物接枝度、褐變程度和蛋白質溶解度的影響。在單因素試驗的基礎上選取反應條件進行Box-Behnken響應面優化,得到最佳花生分離蛋白-菊粉共價復合物的復合工藝。結果表明,通過響應面優化得到最佳工藝參數為反應時間42 min、反應溫度 80 ℃、PPI濃度15 mg/mL、PPI-INU比例1∶3、超聲功率 100 W、超聲時間17 min。在最佳工藝條件下,蛋白質溶解度為95.56%。與花生分離蛋白相比,花生分離蛋白-菊粉共價復合物的溶解性、乳化特性均有所改善,該研究對花生分離蛋白的應用及其產品品質提升具有重要意義。
關鍵詞:花生分離蛋白;菊粉;糖基化改性
中圖分類號:TS201.21""""""文獻標志碼:A"""""文章編號:1000-9973(2025)02-0067-08
Optimization of Ultrasound-Assisted Glycosylation Reaction Conditions for
Peanut Protein Isolate Composite Inulin and Property Study
ZHANG Tong1, QI Zhao-xia1, FENG Yu-he1, XIE Jun-lan1, CHEN Kai-yao1,
ZENG Li1,2*, JIA Li-rong1,2, DUAN Fei-xia1,2, RAN Xu1,2*
(1.College of Biomass Science and Engineering, Sichuan University, Chengdu 610065, China;
2.Key Laboratory of Food Science and Technology in Institutions of Higher Education
in Sichuan Province, Sichuan University, Chengdu 610065, China)
Abstract: Protein polysaccharide complex is prepared using ultrasound-assisted glycosylation of peanut protein isolate composite inulin, and the effects of different grafting conditions on the grafting degree, browning degree and protein solubility of peanut protein isolate-inulin complex are investigated. The reaction conditions are selected on the basis of single factor test, and Box-Behnken response surface optimization is carried out to obtain the optimal compounding process of peanut protein isolate-inulin covalent complex.The results show that the optimal process parameters obtained by response surface optimization are reaction time of 42 min, reaction temperature of 80 ℃, PPI concentration of 15 mg/mL, PPI-INU ratio of 1∶3, ultrasonic power of 100 W, and ultrasonic time of 17 min. Under the optimal process conditions, the protein solubility is 95.56%. Compared with peanut protein isolate, the solubility and emulsification characteristics of peanut protein isolate-inulin covalent complex are improved. This study is of great significance for the application of peanut protein isolate and the improvement of product quality.
Key words: peanut isolate protein; inulin; glycosylation modification
花生分離蛋白(PPI)一般采用堿提酸沉法從花生粕中提取,其主要組分為花生球蛋白、伴花生球蛋白Ⅰ和伴花生球蛋白Ⅱ,占蛋白整體的75%。其中,球蛋白比例高是花生蛋白溶解度差的主要原因。通過堿提酸沉法從花生粕中分離花生蛋白的方法會促進蛋白質的變性和聚集[1],降低蛋白質的溶解度,從而導致花生分離蛋白的乳化性、起泡性、成膜性等功能特性受到限制,使其只能作為動物飼料或者肥料使用。
目前,菊粉(INU)作為天然的膳食纖維,存在于香蕉、菊芋、洋蔥、蘆筍、菊苣等水果或蔬菜中,由D-呋喃果糖分子通過β(2→1)糖苷鍵連接而成,末端連接一個葡萄糖殘基,具有益生元、抗氧化、抗疲勞、免疫調節等生物活性,已被全世界40多個國家批準為功能性食品或營養補充劑,在食品領域具有廣闊的應用前景。大量研究表明,蛋白質與還原糖之間發生美拉德反應[2],生成的不同接枝程度的蛋白質-多糖復合物可以改善蛋白質的功能特性[3-4]。通過共價結合引入親水性官能團(羥基、氨基和羧基)的多糖,可以提高新復合物的溶解度。傳統的美拉德反應主要為干熱法和濕熱法。干熱法反應時間長,需要控制溫度和相對濕度,不適用于工業生產。濕熱法在溶液中進行熱處理,可以縮短時間,但高溫或長時間處理也會導致蛋白質聚合變性[5],從而限制共價復合物的制備效率和商用用途。超聲波技術在提高糖基化反應效率和改善共價交聯產物功能性質方面發揮著重要作用[6]。研究表明,超聲波技術可以加速蛋白和多糖的接枝,且得到的共價交聯產物具有更好的乳化特性[7]。超聲波技術有助于蛋白質展開和肽鏈斷裂,蛋白質內部的氨基酸殘基暴露,有利于與還原糖發生美拉德反應,有效地改善蛋白質的結構和功能[8]。然而,當前使用超聲輔助美拉德濕熱法促進蛋白質和多糖接枝的研究還很少。
因此,本研究采用超聲輔助濕法糖基化方法對花生分離蛋白(PPI)-菊粉(INU)復合物的制備工藝進行研究,以體系中蛋白溶解度為指標,通過響應面設計確定最佳PPI-INU復合物的制備工藝條件,旨在探索一種高效制備高溶解性的蛋白復合物,為食品工業中花生分離蛋白的應用及高值化產品的開發提供理論基礎。
1"材料和方法
1.1"材料及生產工藝
花生粕:乳山金果食品股份有限公司;菊粉:淄博益生康緣生物科技有限公司。
1.2"試劑
鄰苯二甲醇:上海麥克林生化科技有限公司;β-巰基乙醇:上海阿拉丁生化科技股份有限公司;十二烷基硫酸鈉:上海泰坦科技股份有限公司;鹽酸、氫氧化鈉、無水甲醇、十水四硼酸鈉:成都科隆化學品有限公司;以上試劑均為分析純。
1.3"主要儀器與設備
SX-2008低溫超聲波萃取儀"上海圣訓儀器有限公司;PHS-3E pH計"北京華瑞博遠科技發展有限公司;HH-6型數顯恒溫水浴鍋"常州金南儀器制造有限公司;TG16-WS型臺式高速離心機"長沙湘儀離心機儀器有限公司;EPOCH-SN酶標儀"安捷倫科技有限公司;H01-1G磁力攪拌器"上海梅穎浦儀器儀表制造有限公司;FD-1A-50真空冷凍干燥機"北京博醫康實驗儀器有限公司。
1.4"方法
1.4.1"花生分離蛋白的制備
取花生粕加入1~10的純凈水,磁力攪拌溶解60 min,用1 mol/L的NaOH溶液調節pH為9,常溫下磁力攪拌溶解100 min后,用1 mol/L的HCl調節pH為4.5,靜置40 min后離心取沉淀,用去離子水沖洗至中性后冷凍干燥得到花生分離蛋白PPI(蛋白含量為94%)。
1.4.2"PPI-INU復合物的制備
稱取0.15 g花生分離蛋白(PPI),加入10 mL去離子水,渦旋混合2 min配制成15 mg/mL的樣品溶液。按照1∶3的質量比加入同濃度的菊粉(INU),繼續渦旋2 min使花生分離蛋白與菊粉充分混勻,裝入帶有螺旋口的離心管(50 mL)中,用1 mol/L NaOH溶液調節反應體系的pH為9,使得體系中PPI的溶解度最大,設置超聲頻率為100 W,超聲17 min后在80 ℃水浴加熱42 min,反應結束后立即冰水浴5 min,充分冷卻,反應停止。冷凍干燥后打成粉末得到花生分離蛋白-菊粉共價復合物(PPI-INU),置于干燥器中保存。
1.4.3"復合物接枝度的測定
采用鄰苯二甲醛法測定復合物的接枝度,稱取80 mg OPA溶解在2 mL甲醇中,加入50 mL 0.01 mol/L硼砂溶液、5 mL 20% SDS溶液和200 μL β-巰基乙醇混合,并用蒸餾水定容至100 mL,獲得OPA試劑。
配制PPI濃度為2 mg/mL的樣品溶液,取200 μL樣品溶液與4 mL OPA試劑混合均勻。在35 ℃水浴中反應10 min后,使用酶標儀在340 nm處測量混合物的吸光度。未處理的花生分離蛋白用作對照樣品,蒸餾水用作空白。接枝度(DG)根據公式(1)計算。
DG(%)=AC-ASAC×100%。(1)
式中:AC為未處理花生分離蛋白的吸光度;AS為樣品的吸光度。
1.4.4"復合物蛋白溶解性的測定
稱取樣品2 mg溶于2 mL去離子水中,渦旋2 min混勻后在6 000 r/min下離心5 min。以牛血清蛋白(BSA)作為標準蛋白,用蒸餾水混合稀釋成不同濃度的蛋白質標準液繪制標準曲線。待測樣品用酶標儀在562 nm處測量吸光度[9]。未處理的花生分離蛋白用作對照樣品,蒸餾水用作空白。溶解度根據公式(2)計算。
溶解度(%)=CSCT×100%。 (2)
式中:CS為上清液中蛋白質的濃度(mg/mL);CT為溶液中總蛋白質的濃度(mg/mL)。
1.4.5"PPI-INU單因素試驗
以PPI濃度(5,7.5,10,15,20 mg/mL)、PPI與INU的比例(1∶0、3∶1、2∶1、1∶1、1∶2、1∶3、1∶4、1∶5)、超聲時間(5,10,15,20,25 min)、超聲功率(50,100,200,300,400 W)、反應時間(10,20,40,60,80 min)、反應溫度(60,70,80,90,95 ℃)為影響因素,以接枝度、蛋白溶解度為評價指標進行單因素試驗。
1.4.6"PPI-INU復合物響應面試驗
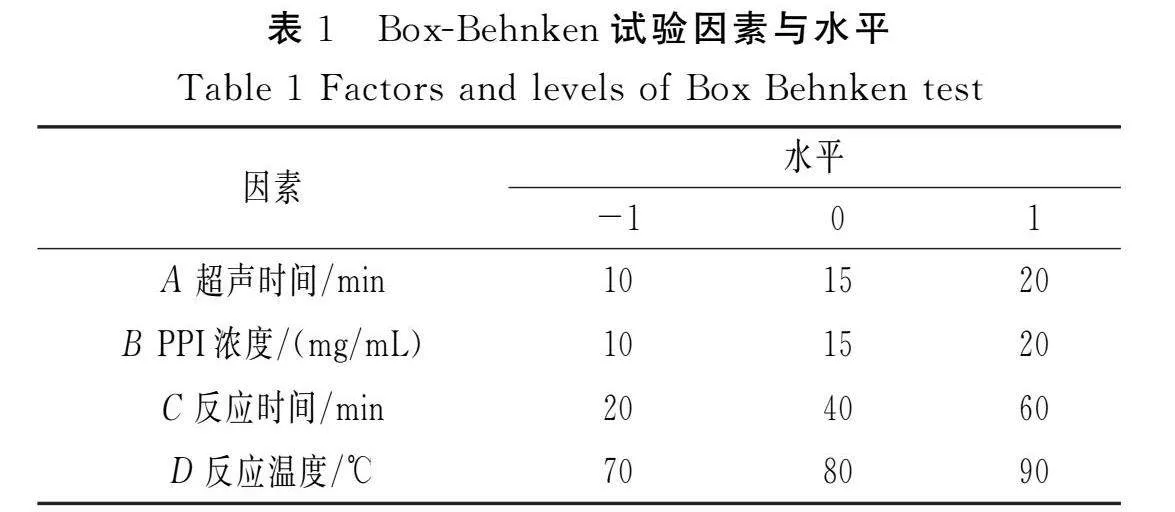
在單因素試驗的基礎上,選擇對蛋白質溶解度影響顯著的PPI濃度、超聲時間、反應時間和反應溫度作為試驗因素,以蛋白質的溶解度作為響應值,采用Design-Expert 13.0軟件進行響應面優化試驗設計并建立模型,每個因素設置3組試驗水平,分別編號為-1,0,1,Box-Behnken試驗因素與水平見表1。對模型進行驗證,在最優復合工藝條件下測定溶解度和接枝度。
1.4.7"PPI-INU復合物溶解性的測定
配制2 mg/mL的花生分離蛋白(PPI)和花生分離蛋白-菊粉共價復合物(PPI-INU)溶液,分別調節pH為3~10。混勻后在8 000 r/min條件下離心10 min,取上清液測定蛋白質含量[10]。
1.4.8"PPI-INU乳化特性的測定
將樣品溶于磷酸鈉緩沖液(100 mmol/L,pH 7.0)中,配制成2 mg/mL的樣品溶液,按照3∶1加入花生油,用均質機均質2 min(13 500 r/min)。均質后,在0 min和15 min時從試管底部取200 μL乳劑與10 mL 0.1%十二烷基硫酸鈉(SDS)溶液混合。渦旋后在500 nm處測定吸光度。以SDS溶液為空白。乳化活性指數(EAI)和乳化穩定性指數(ESI)分別根據公式(3)和公式(4)計算。
EAI=2×2.303×DF×A0(1-θ)×c×L×10 000。(3)
ESI=10×A0A0×A15。(4)
式中:c為初始蛋白質濃度(g/mL);θ為用于形成乳劑的大豆油的比例;L為比色皿的光直徑(1 cm);DF為稀釋因子(50);A0為乳劑在0 min時的吸光度;A15為乳劑在15 min時的吸光度。
2"結果與分析
2.1"單因素試驗結果
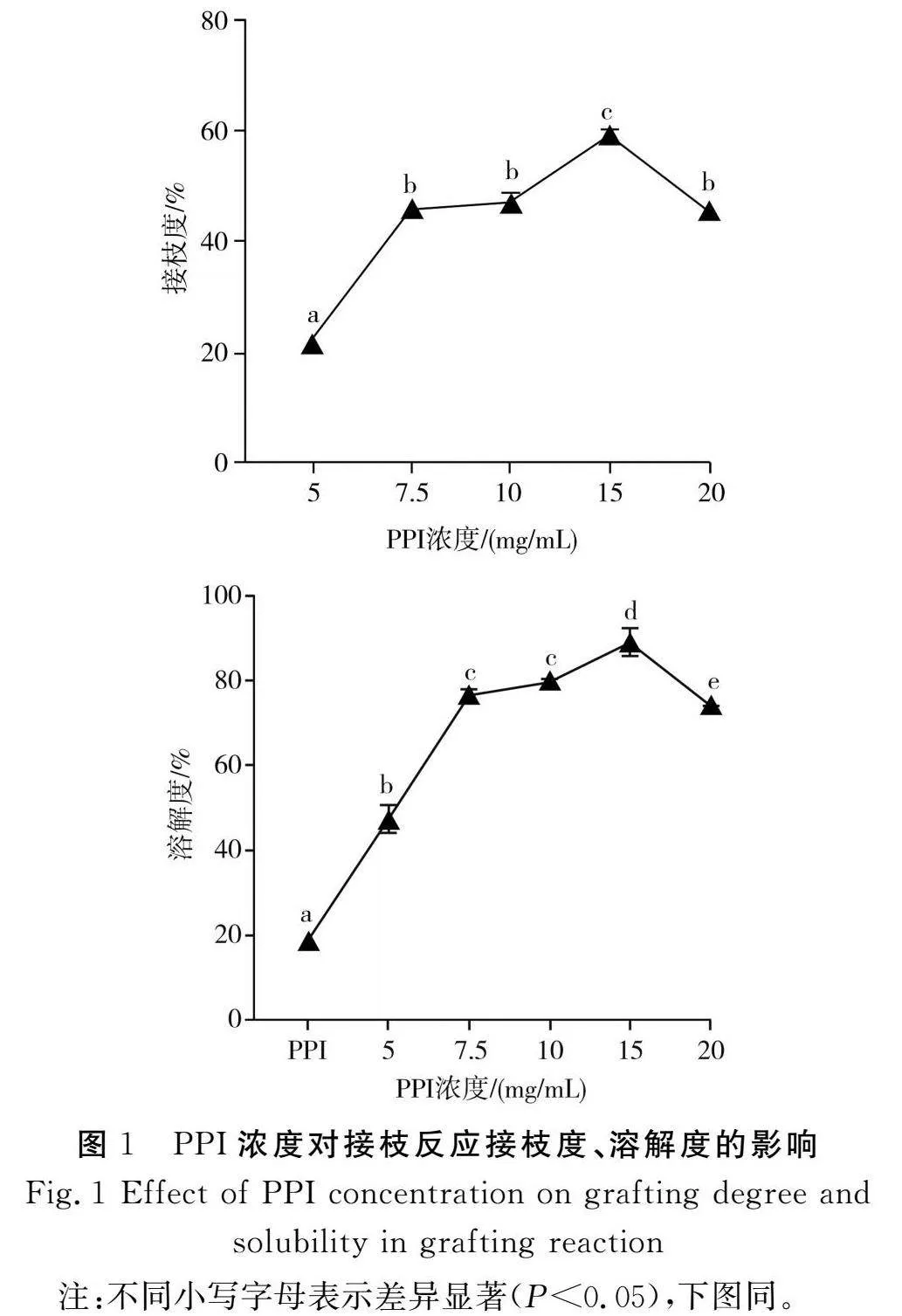
2.1.1"蛋白質濃度對PPI-INU接枝反應的影響
由圖1可知,PPI-INU接枝反應的接枝度和溶解度隨著PPI濃度的增加呈現先上升后下降的趨勢。當PPI濃度達到15 mg/mL時,PPI-INU的接枝度達到最大,為(59.49±0.57)%,溶解度也達到最大,為(88.94±2.28)%,這可能是由于當PPI-INU比例一定時,隨著反應物濃度的增加,同體積溶液中溶質的含量更高,分子間的碰撞概率增大,有助于接枝反應的進行。PPI上接入INU的親水性羥基,增加了蛋白質的親水性,從而提高了蛋白質的溶解度。隨著PPI濃度的不斷增加,蛋白質分子與多糖分子之間的空間位阻效應會阻止兩者的碰撞,從而不利于接枝反應的進行,加之在一定的反應溫度下部分蛋白分子聚集,導致溶解度下降。
2.1.2"PPI-INU比例對PPI-INU接枝反應的影響
由圖2可知,隨著菊粉濃度的增加,反應程度呈現先上升后緩慢下降的趨勢,這是由于隨著菊粉濃度不斷升高,提供了更多的菊粉分子與花生分離蛋白發生美拉德反應,這與穆利霞[11]得出的大豆蛋白與阿拉伯膠的接枝度隨著阿拉伯膠濃度的增加而增加的研究結果一致。當PPI與INU的比例為1∶3時,接枝度達到最大值,為(52.65±0.29)%,顯著高于1∶2和1∶4時復合物的糖基化程度(P<0.05)。溶解度也呈現出相同的趨勢,當PPI與INU的比例為1∶3時,溶解度最大,為(89.28±2.19)%。相比于未處理的PPI溶解度(18.71±1.07)%提高了70.57%。當PPI-INU比例高于1∶3,體系的黏度增加,從而降低了蛋白質和多糖分子之間的碰撞頻率,使得反應程度下降[12]。隨著菊粉濃度的逐漸增多,而蛋白底物濃度一定,過量的菊粉導致分子間的空間位阻增大,不利于接枝反應的進行,使接枝反應速率減慢。
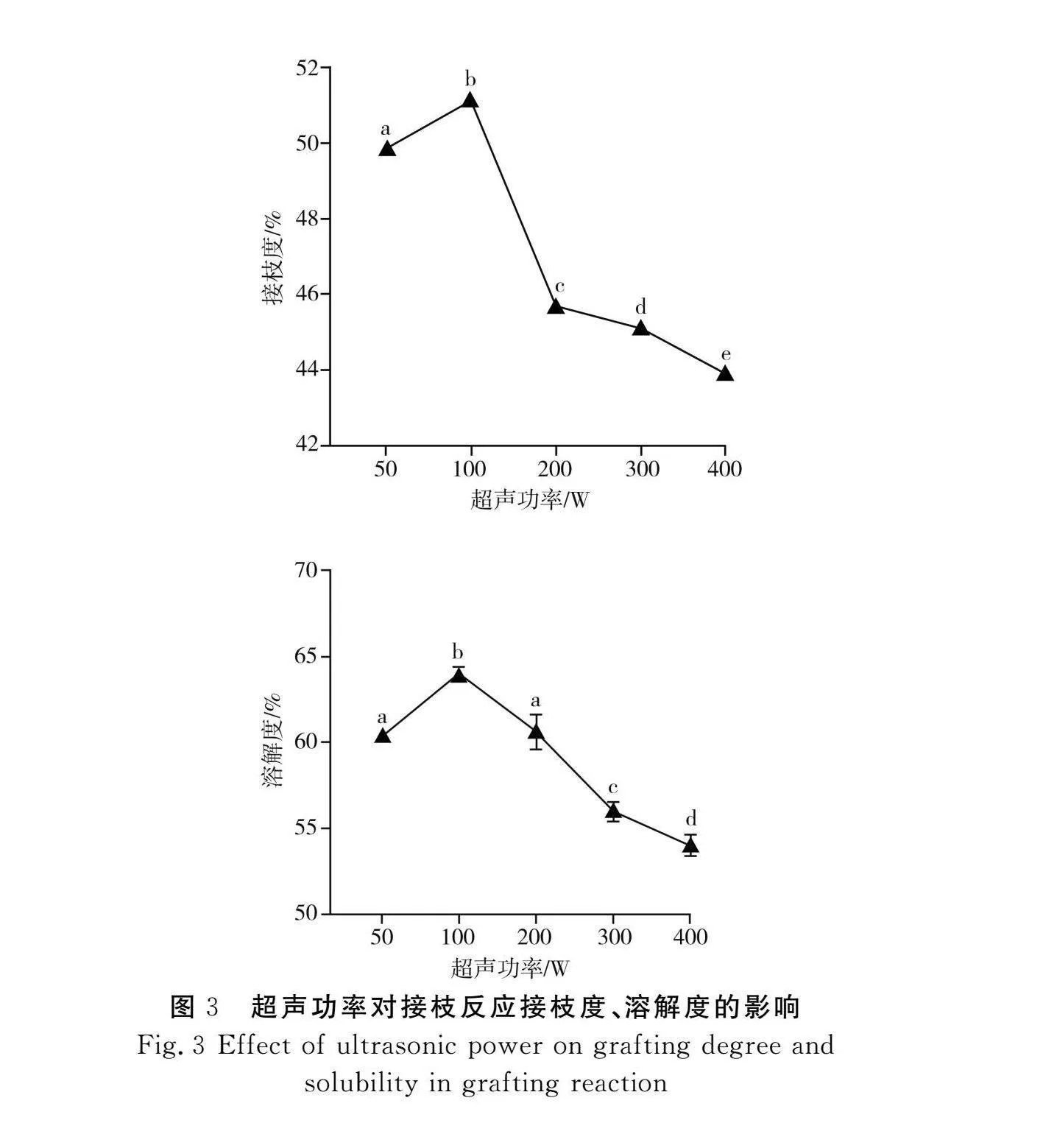
2.1.3"超聲功率對PPI-INU接枝反應的影響
由圖3可知,接枝度和溶解度均隨著超聲功率的升高呈先上升后下降的趨勢,這是由于超聲波為反應提供更多的能量和游離氨基,有效地增加了蛋白質和菊粉接觸的頻率。當超聲功率為100 W時,接枝度達到最大,為(51.13±0.14)%,溶解度為(64.03±0.31)%。超聲波的機械效應和空化效應將粒徑大的蛋白質聚集體解聚成粒徑較小的蛋白質顆粒,從而降低了蛋白質聚集體的粒徑,使得蛋白質與水接觸的表面積增加,水合作用增強[13]。當超聲功率超過100 W時,過度超聲會導致蛋白質結構的展開和聚集,改變蛋白質的構象,使得蛋白質分子之間聚集、交聯,先前結構展開暴露的色氨酸等基團重新包埋于蛋白質內部,增加了蛋白質分子的空間位阻。
2.1.4"超聲時間對PPI-INU接枝反應的影響
超聲時間對PPI-INU復合物接枝度和溶解度的影響見圖4。
由圖4可知,隨著超聲時間的增加,PPI-INU復合物的接枝度和溶解度均呈先上升后下降的趨勢,有研究表明超聲處理促進蛋白質和多糖的結合,比傳統工藝的美拉德反應24 h具有更高的接枝度[5]。在5~25 min的超聲時間范圍內,最大接枝度為60.34%,最大溶解度為69.59%,這是由于超聲波為反應提供更多的能量和游離氨基,蛋白質與多糖分子之間的碰撞概率增加。超聲波的空化效應破壞了蛋白質的聚集體狀態,將蛋白質分子解離成粒徑更小的蛋白質分子,表面積增加,暴露更多的接枝活性位點,與多糖分子接枝的反應面有效增加。PPI-INU的接枝反應本質上是美拉德反應,升高聚合溫度,一般會使接枝反應速率加快。值得注意的是,過度超聲會導致蛋白質展開和聚集,從而減少了可參與接枝反應的暴露氨基酸數量[14]。
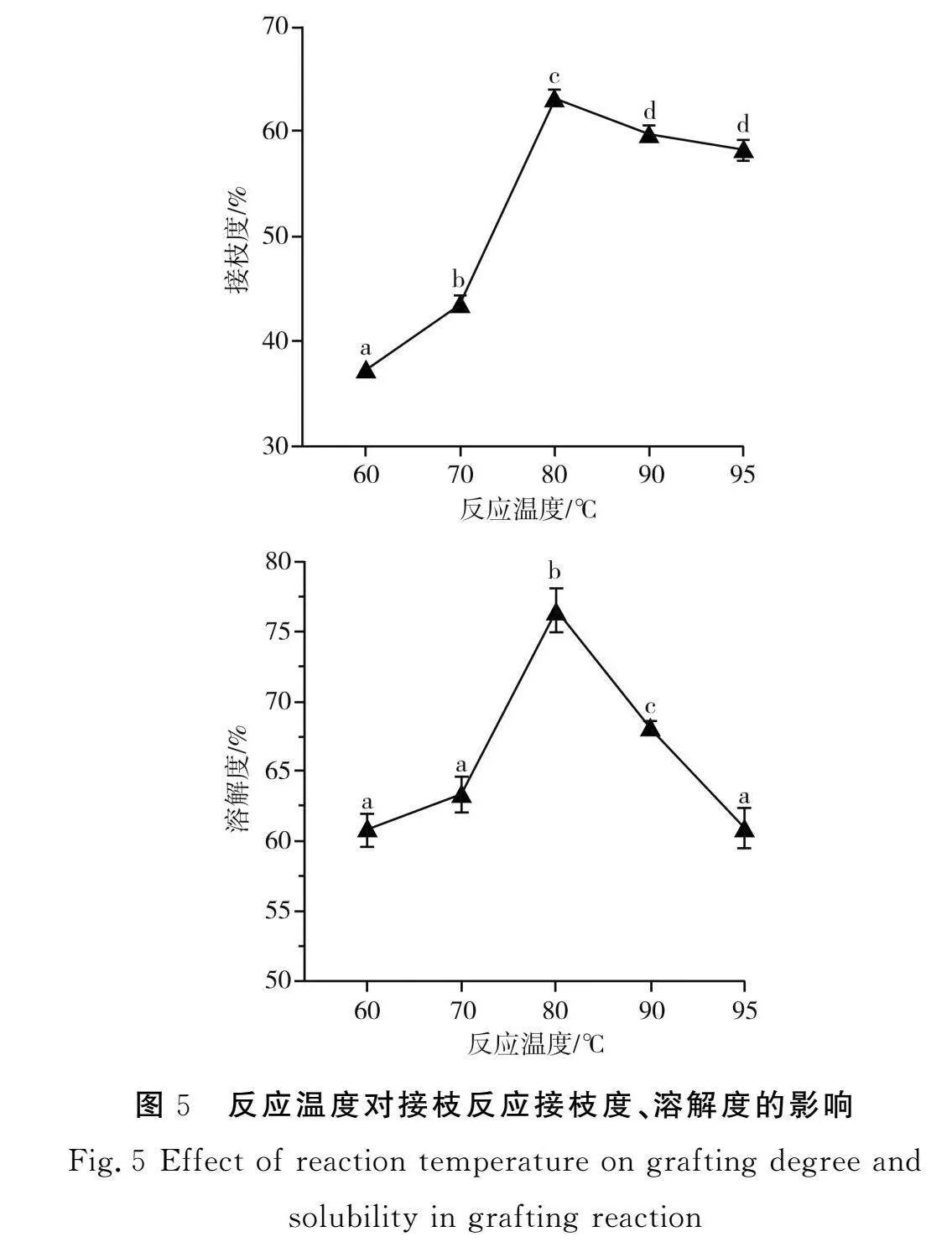
2.1.5"反應溫度對PPI-INU接枝反應的影響
由圖5可知,隨著反應溫度的升高,PPI-INU復合物的接枝度呈先上升后下降的趨勢,80 ℃時PPI-INU的接枝度最高,為(63.15±0.54)%,隨后接枝度不斷下降,這是由于蛋白質在高溫下會聚集變性,使得能參與接枝反應的游離氨基減少,從而導致接枝度下降,不利于PPI-INU的共價結合,這與張詩璇[15]的研究結果類似,其研究結果表明,乳清蛋白與菊粉的羰基化程度也隨著溫度的升高呈先逐漸上升后下降的趨勢。PPI-INU復合物的蛋白溶解度先上升后下降,復合物溶解度最大達到(76.55±1.24)%。接枝度越高,PPI-INU復合物的蛋白溶解度越好,體系溫度升高加速了美拉德反應的進行。
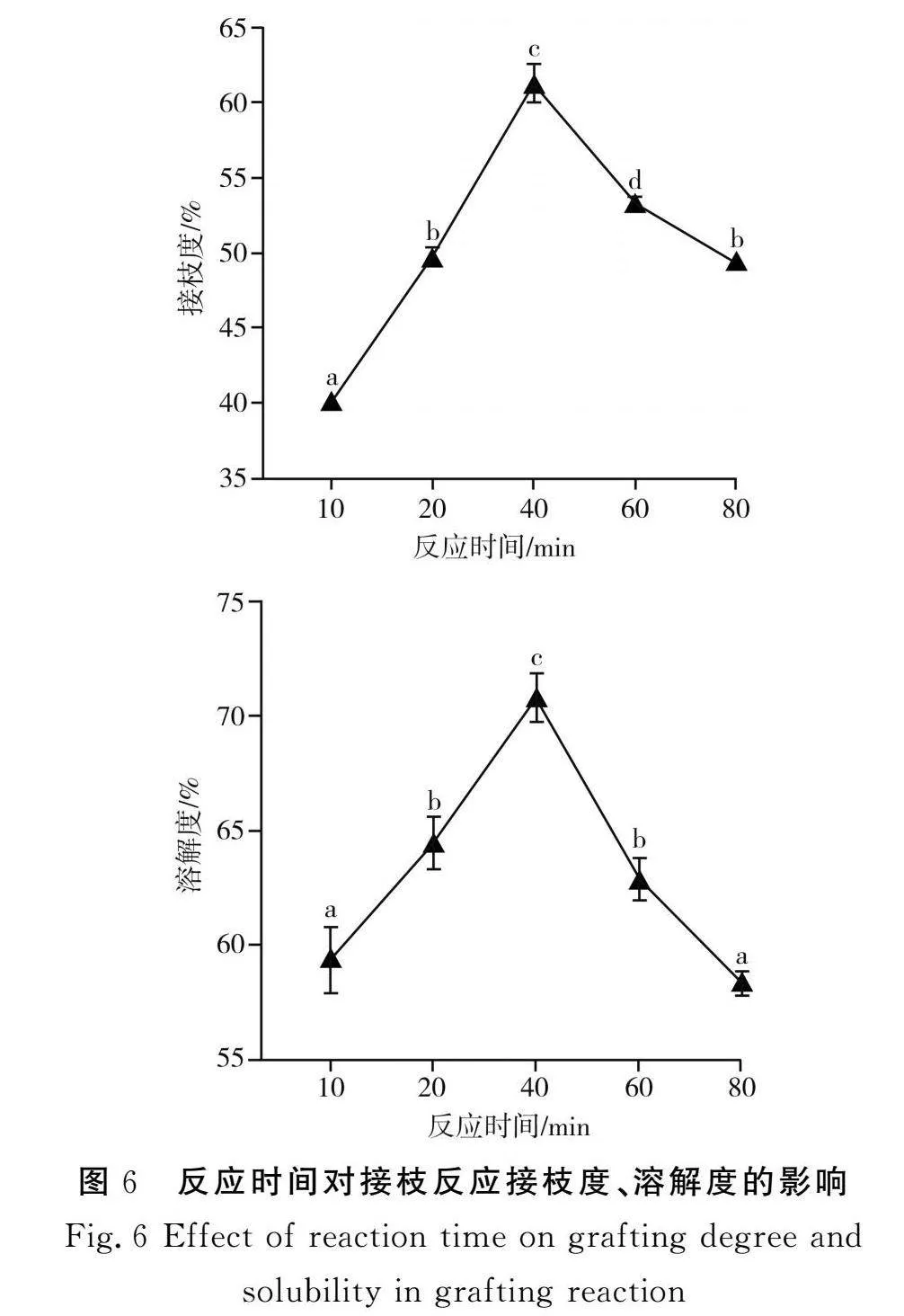
2.1.6"反應時間對PPI-INU接枝反應的影響
由圖6可知,隨著PPI-INU接枝反應時間的延長,接枝度呈先上升后下降的趨勢,當反應時間為40 min時,接枝度最高,為(61.24±0.90)%,顯著高于20,60 min時的接枝度。適當地延長反應時間有助于接枝反應的進行,接枝反應初期,游離在蛋白質表面的氨基能直接與菊粉反應。隨著反應時間的延長,蛋白質的空間結構逐漸展開,更多內部的氨基暴露出來與多糖結合,從而導致糖基化程度升高。隨著反應時間的不斷延長,過長的反應時間會導致蛋白質分子間交聯、聚集,因此,接枝反應的接枝度呈先上升后下降的趨勢。復合物的蛋白溶解度呈相同的趨勢,最大達到(70.81±0.87)%。隨著反應時間的持續增加,蛋白質結構展開,內部的氨基也參與糖基化反應,此時已完成糖基化的蛋白質可能會再次發生聚合[16]。
2.2"響應面優化試驗設計及結果分析
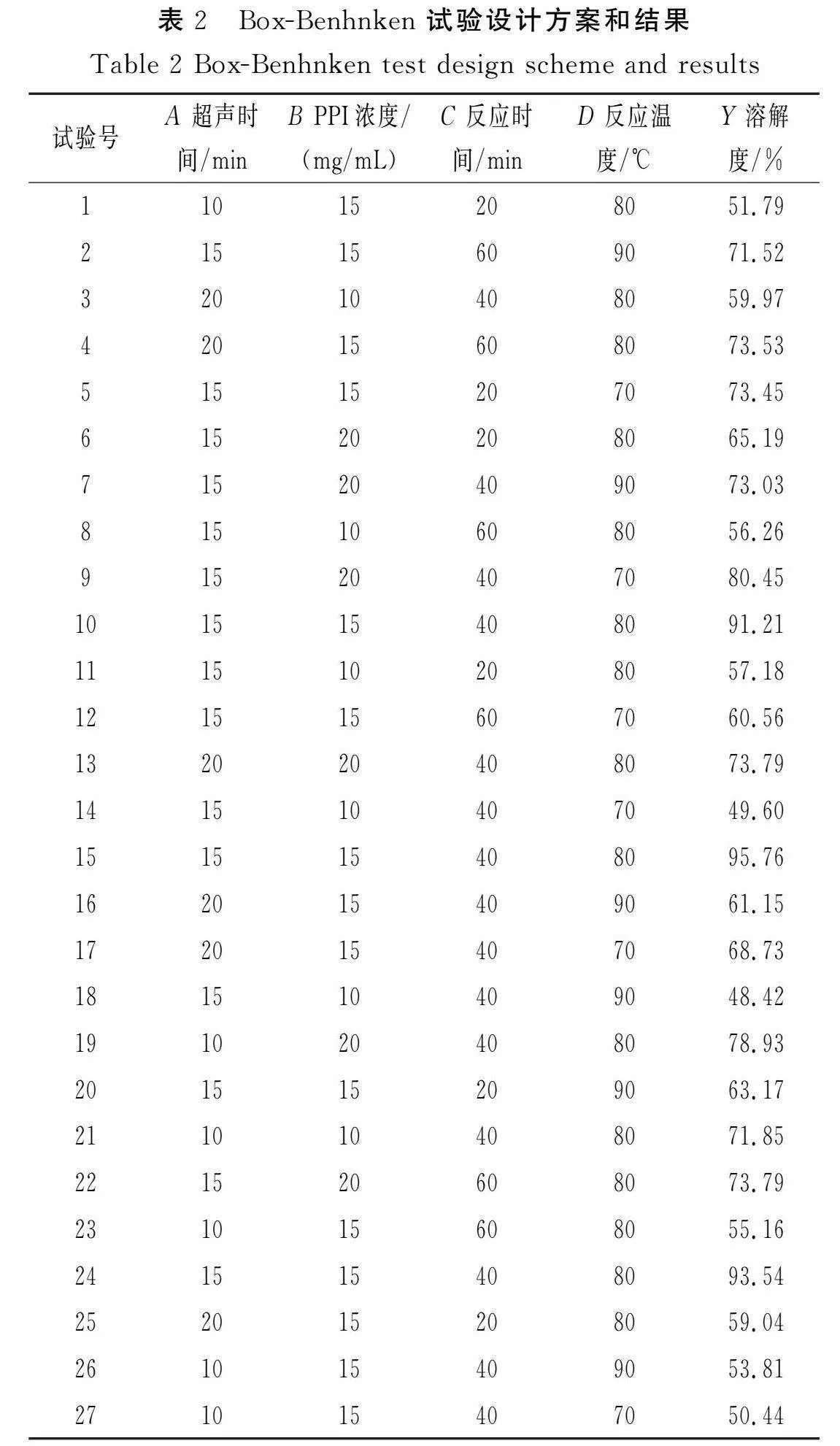
根據單因素試驗結果,選擇復合物蛋白溶解度(Y)為指標,超聲時間(A)、PPI濃度(B)、反應時間(C)、反應溫度(D)為因素進行響應面優化試驗。試驗設計方案和結果見表2。
對試驗結果進行分析,得到復合物蛋白溶解度(Y)與超聲時間(A)、PPI濃度(B)、反應時間(C)、反應溫度(D)之間的二次多元回歸模型:溶解度(Y)=93.51+2.85A+8.49B+1.75C-1.01D+1.69AB+2.78AC-2.74AD+2.38BC-1.56BD+5.31CD-15.76A2-11.98B2-15.46C2-16.25D2。
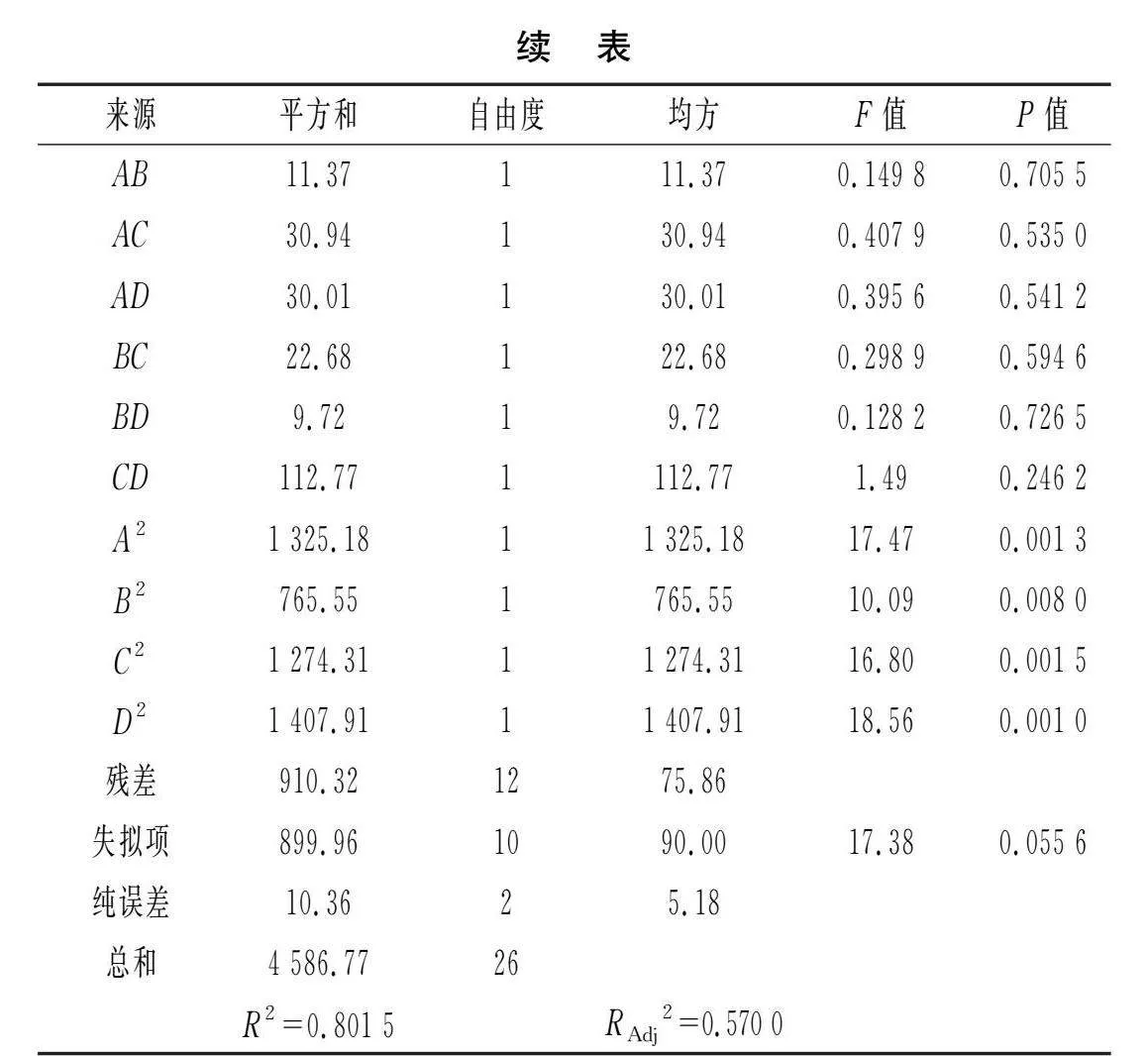
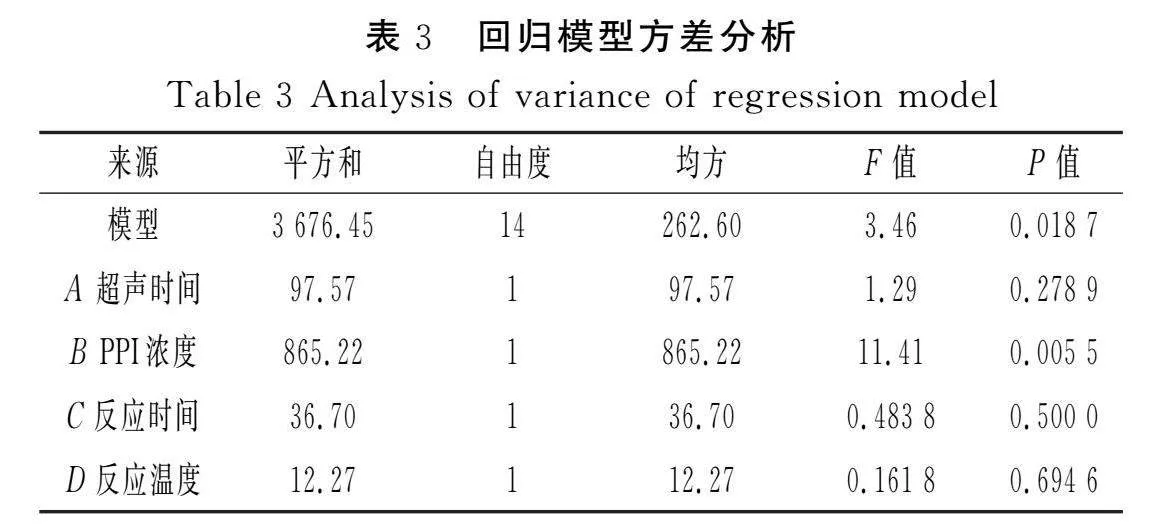
對模型進行方差分析,結果見表3。
由表3可知,模型的P<0.05,表明該回歸方程顯著;失擬項的P=0.055 6>0.05,表明失擬項不顯著,回歸模型的預測值與實際值差異較小,擬合程度高。相關系數R2=0.801 5,校正系數 RAdj2=0.570 0,一致性較好,表明該模型能夠有效解釋響應值的變化。由F值可知,各因素對花生分離蛋白-菊粉復合物蛋白溶解度的影響大小為PPI濃度(B)>超聲時間(A)>反應時間(C)>反應溫度(D),其中PPI濃度的影響極顯著(P<0.01)。
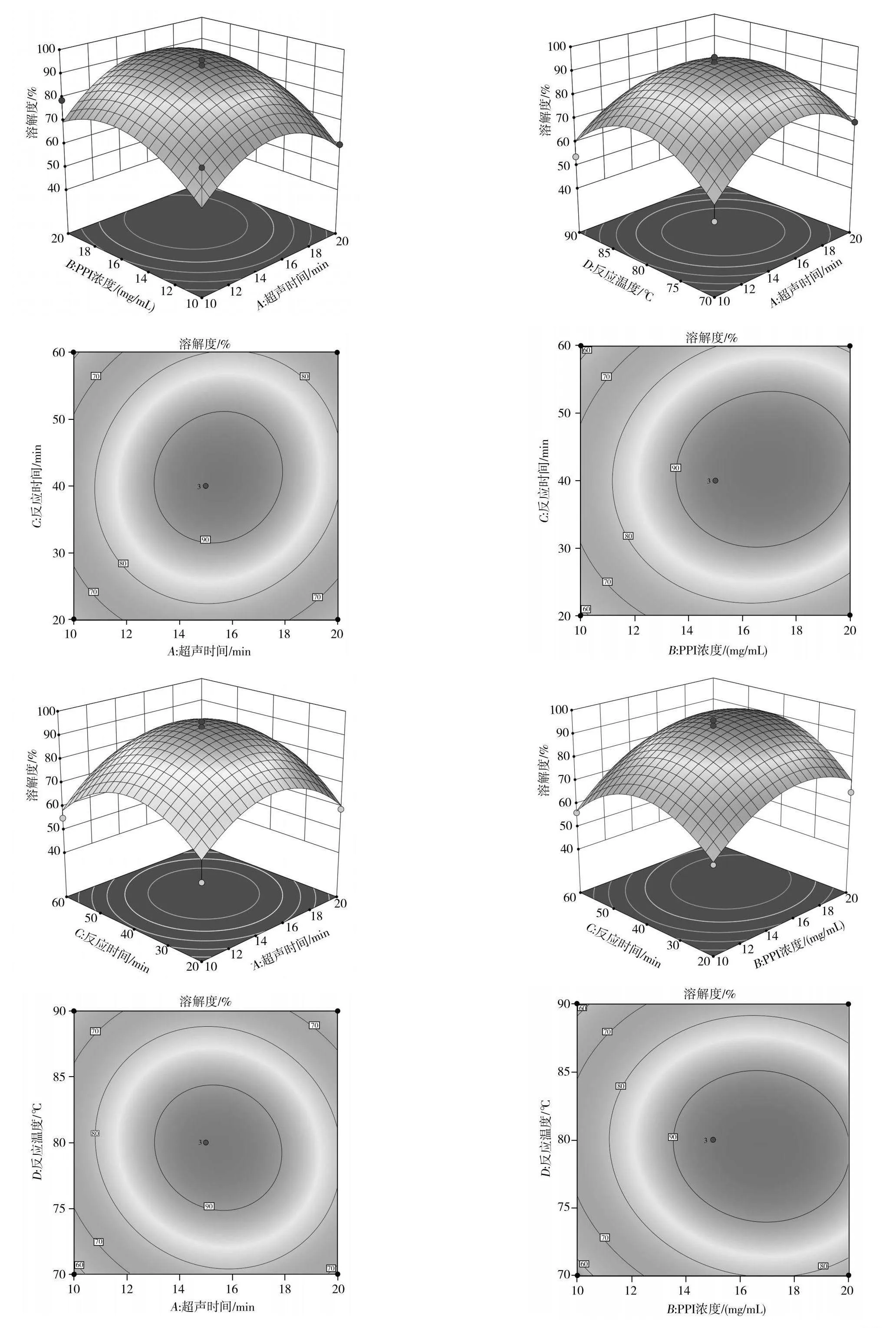
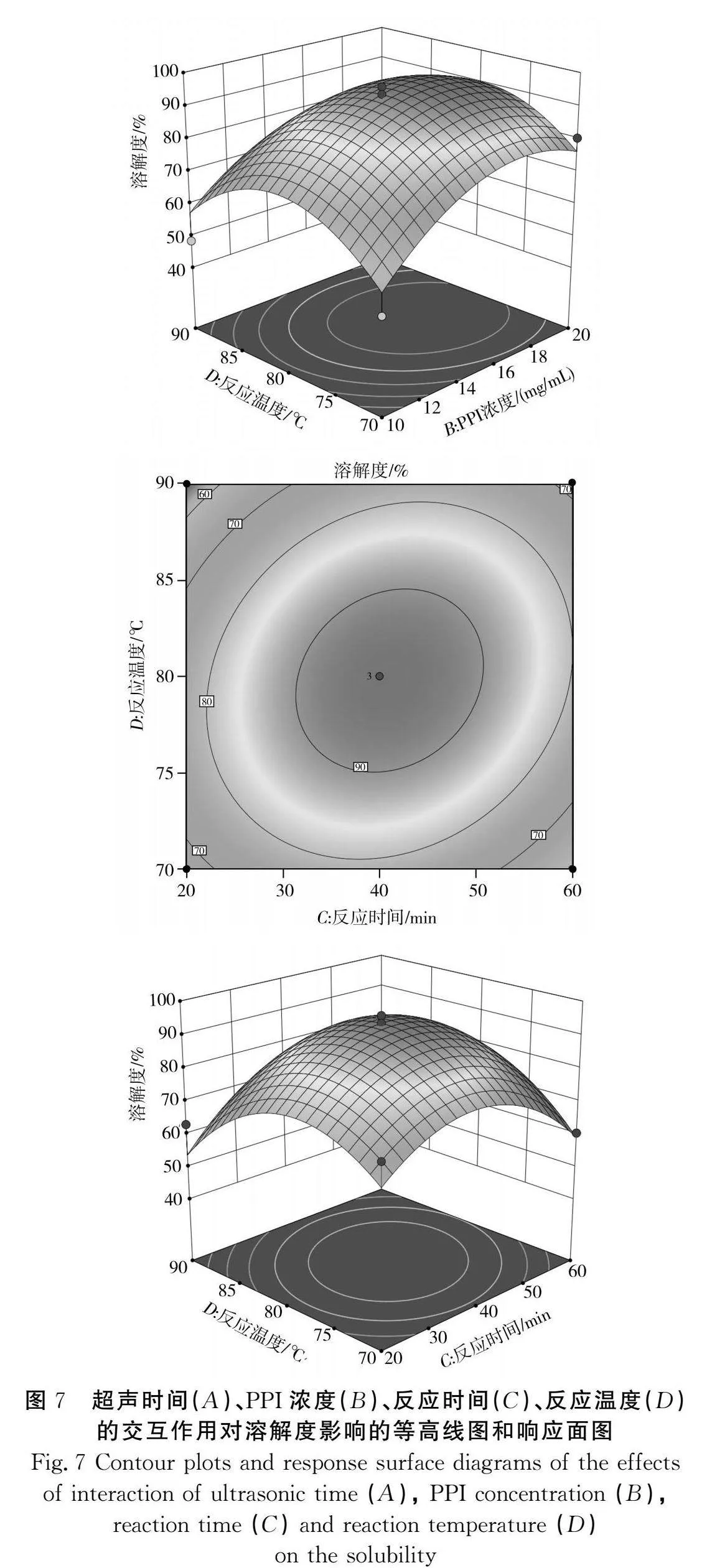
超聲時間與PPI濃度的交互作用、超聲時間與反應時間的交互作用、超聲時間與反應溫度的交互作用、PPI濃度與反應時間的交互作用、PPI濃度與反應溫度的交互作用、反應時間與反應溫度的交互作用對PPI-INU復合物蛋白溶解度的影響見圖7。6個曲面均向上凸起,復合物蛋白溶解度有最大值,根據響應面的陡峭程度可知,PPI濃度與超聲時間的交互作用對PPI-INU復合物的溶解度影響最大,反應時間與反應溫度的交互作用影響最小。
模型預測PPI-INU最優復合條件為PPI濃度15 mg/mL、PPI-INU比例1∶3、超聲時間16.83 min、超聲功率100 W、反應時間41.58 min、反應溫度79.65 ℃,此條件下PPI-INU復合物蛋白溶解度預測值為95.76%。試驗采用PPI濃度 15 mg/mL、PPI-INU比例1∶3、超聲時間17 min、超聲功率100 W、反應時間42 min、反應溫度80 ℃對模型進行驗證,PPI-INU復合物溶解度為94.96%,接枝度為61.26%。與預測值誤差較小,表明該模型可以預測花生分離蛋白-菊粉復合物的制備工藝。
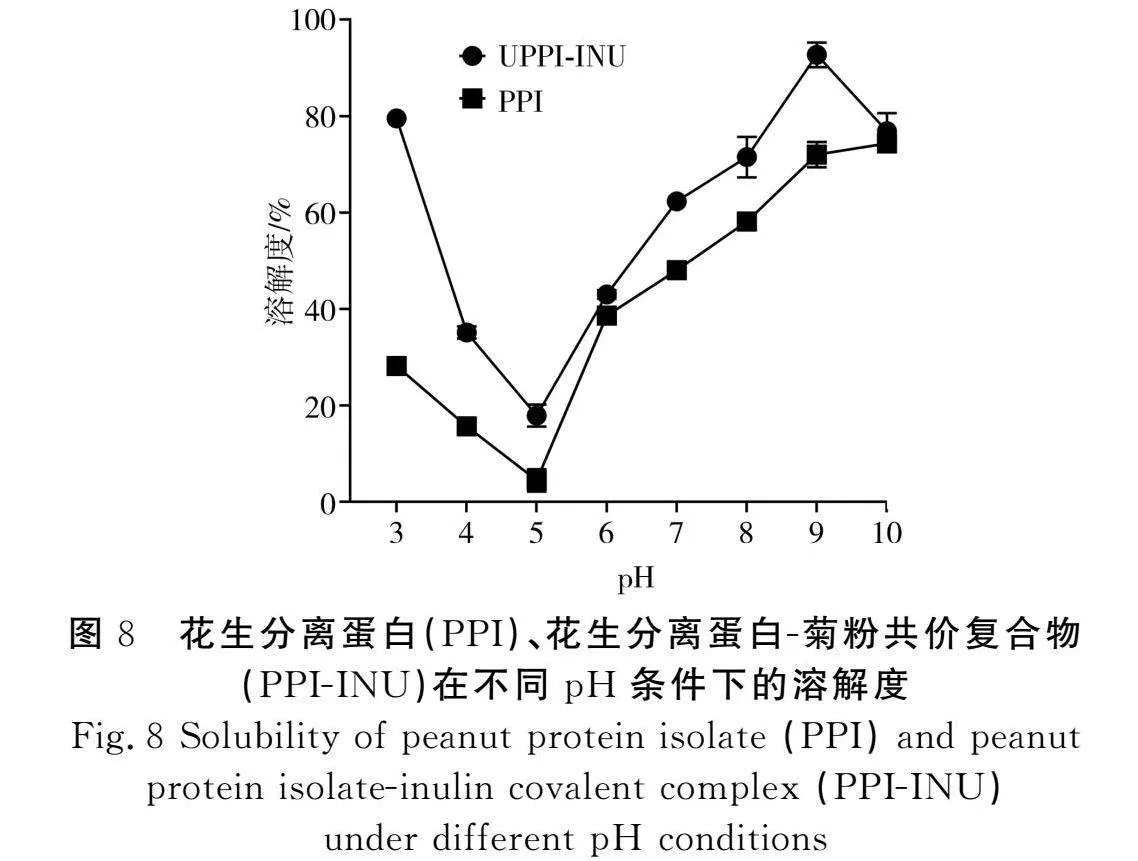
2.3"PPI-INU復合物溶解度
蛋白溶解度是蛋白功能中最重要的性質,其他蛋白功能性質(如乳化特性、起泡特性、凝膠特性、持水特性、持油特性等)均依靠蛋白在溶劑中的初始溶解度。由圖8可知,隨著pH的增加,溶解度呈先降低后升高的趨勢,冷榨花生蛋白粕的溶解度顯著高于溫榨花生蛋白粕。在pH 5附近PPI和PPI-INU的溶解度較差。當pH<4時,蛋白質的疏水性殘基暴露增加,從而導致蛋白在溶劑中的溶解度降低。通過糖基化前后對比分析,花生分離蛋白-菊粉復合物(PPI-INU)的溶解度高于花生分離蛋白(PPI)的溶解度,這是由于在花生分離蛋白與菊粉共價結合時,引入親水性基團,增加了蛋白的親水性,由此可知糖基化改性能提高花生分離蛋白與水的親和力和對pH的敏感性[17]。
2.4"PPI-INU復合物乳化特性
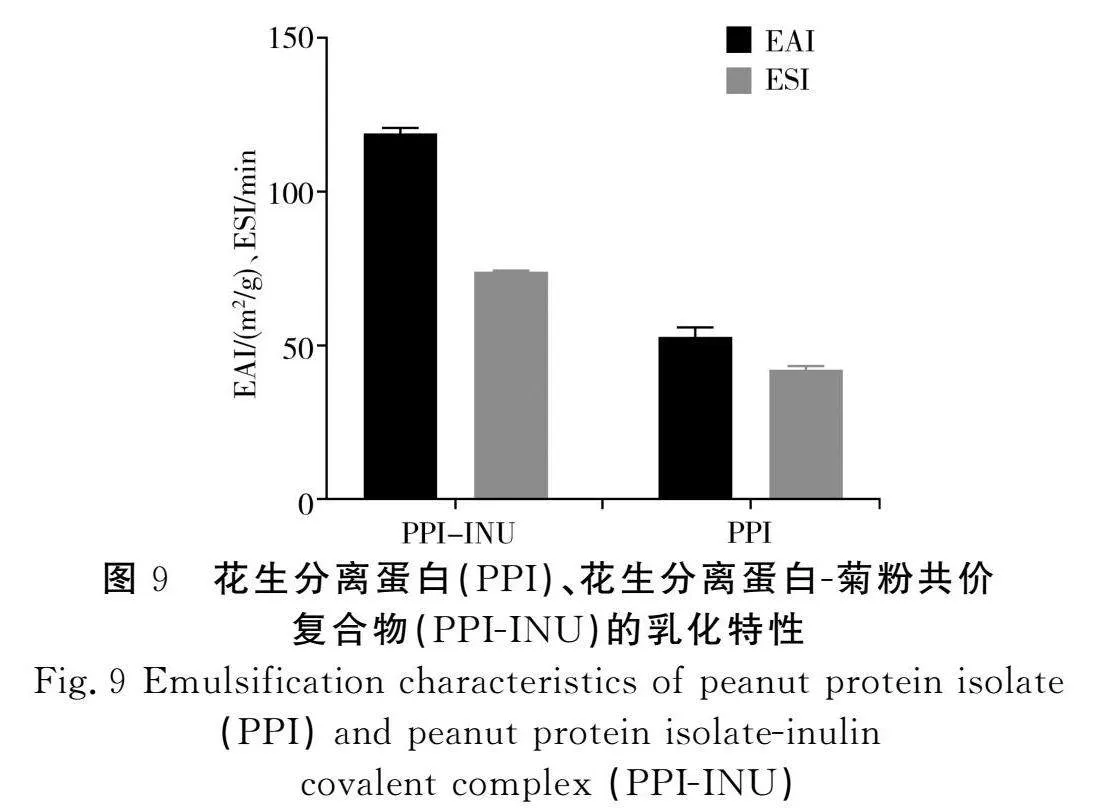
乳化性(EAI)和乳化穩定性(ESI)可以表征蛋白質在油水界面的吸收能力,其取決于蛋白質的結構構象和理化特性。由圖9可知,經過糖基化改性后的復合物的EAI和ESI均顯著升高,這是由于在糖基化改性過程中,花生分離蛋白引入了菊粉,使得花生分離蛋白的空間結構發生變化,PPI-INU復合物可以作為親油親水的表面活性劑吸附在油水界面,阻止油滴聚集,從而提高了乳化特性[18]。
3"結論
本試驗以花生分離蛋白(PPI)和菊粉(INU)為反應原料,采用超聲輔助糖基化反應進行共價復合,探究不同復合條件對體系接枝度、蛋白溶解度的影響。通過響應面試驗建立預測模型并進行工藝優化,得到花生分離蛋白-菊粉共價復合物的最佳工藝條件為PPI濃度15 mg/mL、PPI-INU比例1∶3、超聲時間17 min、超聲功率100 W、反應時間42 min、反應溫度80 ℃,在此條件下制備的花生分離蛋白-菊粉共價復合物(PPI-INU)的溶解度顯著高于花生分離蛋白(PPI),其乳化性也優于花生分離蛋白(PPI),為后續花生分離蛋白在食品體系中的應用奠定了基礎。
參考文獻:
[1]易佳,劉昆侖.超微聯合超聲波優化提取米糠蛋白及其對米糠蛋白溶解性的影響[J].食品研究與開發,2022,43(19):117-123.
[2]章銀良,張陸燕.4種氨基酸與木糖美拉德反應產物的抗氧化活性研究[J].中國調味品,2014,39(10):65-69,75.
[3]KAN X H, CHEN G J, ZHOU W T, et al.Application of protein-polysaccharide Maillard conjugates as emulsifiers: source, preparation and functional properties[J].Food Research International,2021,150(11):110740.
[4]桂海佳,任麗蓉,王曉華,等.基于SPME-GC-MS和電子鼻技術對牛肉蛋白肽美拉德反應產物風味成分分析[J].中國調味品,2023,48(5):160-166.
[5]JIANG W, WANG Y Y, MA C C, et al. Pea protein isolate-inulin conjugates prepared by pH-shift treatment and ultrasonic-enhanced glycosylation: structural and functional properties[J].Food Chemistry,2022,384(4):132511.
[6]LI Z Y, ZHENG Y M, SUN Q, et al. Structural characteristics and emulsifying properties of myofibrillar protein-dextran conjugates induced by ultrasound Maillard reaction[J].Ultrasonics Sonochemistry,2021,72(2):105458.
[7]丁儉,李楊,史博瑞,等.超聲改性大豆分離蛋白與大豆可溶性多糖復合乳化體系的凍融穩定性研究[J].食品科學,2018,39(9):88-94.
[8]GHARIBZAHEDI S M T, SMITH B. The functional modification of legume proteins by ultrasonication: a review[J].Trends in Food Science amp; Technology,2020,98(3):107-116.
[9]王志鵬,王璐.綠原酸脫除工藝對葵花蛋白功能性質影響的研究[J].中國調味品,2022,47(6):61-64,68.
[10]HU Q H, WU Y L, ZHONG L, et al. In vitro digestion and cellular antioxidant activity of β-carotene-loaded emulsion stabilized by soy protein isolate-Pleurotus eryngii polysaccharide conjugates[J].Food Hydrocolloids,2021,112:106340.
[11]穆利霞.大豆蛋白-糖接枝改性及其結構與功能特性研究[D].廣州:華南理工大學,2010.
[12]郭浩彬,李敏杰,張陸燕,等.美拉德反應優化藜麥多肽抗氧化活性的研究[J].中國調味品,2023,48(12):59-68.
[13]許英一,張微,王宇,等.超聲對小麥麩皮蛋白結構和功能性質的影響[J].中國糧油學報,2023,38(10):56-61.
[14]WEN C T, ZHANG J X, QIN W, et al. Structure and functional properties of soy protein isolate-lentinan conjugates obtained in Maillard reaction by slit divergent ultrasonic assisted wet heating and the stability of oil-in-water emulsions[J].Food Chemistry,2020,331(8):127374.
[15]張詩璇.乳清蛋白-菊粉復合物的制備、表征及功能特性的研究[D].蘭州:蘭州大學,2023.
[16]李靈誠,李兵兵,夏寧,等.水熱糖基化大米蛋白質的結構以及溶解性研究[J].食品工業科技,2020,41(18):38-44.
[17]冷雪冬,孫華軍,朱磊,等.米糠蛋白復合戊聚糖糖基化反應條件的優化及性質研究[J].中國糧油學報,2023,38(11):69-74.
[18]劉興麗,魏瑩瑩,沈力,等.超聲-糖基化改性對馬鈴薯蛋白功能特性及結構特性的影響[J].食品科技,2022,47(12):228-233.

