大鼠睪丸間質細胞體外培養不同時間3β-羥基類固醇脫氫酶的表達
畢宏達 王曉云 周廣東 劉 偉 李 鳴 邢 新
大鼠睪丸間質細胞體外培養不同時間3β-羥基類固醇脫氫酶的表達
畢宏達 王曉云 周廣東 劉 偉 李 鳴 邢 新
目的探討通過差速貼壁法獲得的7天齡、3周齡大鼠睪丸間質內細胞的細胞群體構成、體外培養不同時間3β-羥基類固醇脫氫酶(3β-HSD)的表達水平變化,以及細胞睪酮分泌功能變化。方法聯合應用膠原酶消化、不銹鋼濾網過濾及差速貼壁法獲得7天齡、3周齡雄性Wistar大鼠睪丸間質組織內細胞,貼壁細胞以DMEM/F12培養液培養,分別對原代培養2 h、4 d細胞進行3β-HSD免疫化學染色及流式細胞分析,原代培養細胞同時給予人絨毛膜促性腺激素(HCG)刺激,測定HCG刺激組和非刺激組各代細胞培養液上清中睪酮水平及其對HCG刺激的反應。結果7天齡、3周齡鼠差速貼壁法獲得的睪丸間質內細胞群經流式細胞鑒定,3β-HSD陽性細胞所占比例分別為(5.4±1.2)%、(59.2±3.2)%;培養4 d后,兩組3β-HSD陽性細胞比例分別為(93.6±1.2)%、(95.4±3.2)%。兩組原代培養細胞均有睪酮生成功能,在HCG刺激下睪酮分泌均明顯上升,7天齡組培養細胞睪酮分泌高峰遲于3周齡組。結論差速貼壁法獲得的7天齡、3周齡大鼠睪丸間質細胞群中均含有部分Leydig干細胞(Stem Leydig cells,SLCs),SLCs在體外培養過程中逐漸分化,表達3β-羥基類固醇脫氫酶,并產生睪酮。
睪丸間質細胞差速貼壁法睪酮3β-羥基類固醇脫氫酶組織工程
因創傷、腫瘤等導致的睪丸缺失臨床上并不少見。隨著現代社會生活節奏加快、環境污染、人口老齡化等原因,雄激素缺乏癥呈逐年上升的趨勢。采用組織工程技術構建具有生物學活性的雄激素分泌組織,有望成為治療上述疾病的理想治療途徑。但是,傳統的Leydig細胞分離技術主要采用膠原酶消化、Percoll密度梯度離心等一系列復雜方法,細胞得率低、活力差,使種子細胞的來源問題成為困擾組織工程化雄激素分泌組織研究的瓶頸。在前期研究中,我們發現Leydig細胞在大鼠睪丸分離細胞中具有貼壁迅速的特點,據此建立了一種簡易快速的Leydig細胞分離技術。與傳統的Leydig細胞分離方法相比,差速貼壁法分離的Leydig細胞得量大、純度較高、細胞活力良好,初步解決了組織工程技術構建雄激素分泌組織種子細胞來源的問題。用該方法獲得的Leydig細胞所構建的組織工程化雄激素分泌組織能在較長時期維持睪酮分泌功能[1-2]。
但是,差速貼壁法所獲得的Leydig細胞具體的細胞成分目前還不清楚,其中是否含有Leydig干細胞(Stem Leydig cells,SLCs)成分尚不肯定;對不同鼠齡的大鼠采用差速貼壁法獲得的Leydig細胞成分是否完全一致仍不明確。本研究中,我們選擇兩種不同鼠齡的大鼠,以差速貼壁法獲取睪丸間質Leydig細胞進行體外培養,通過不同培養階段對Leydig細胞標志物3β-羥基類固醇脫氫酶(3β-HSD)的檢測,深入研究經差速貼壁法獲得大鼠睪丸間質細胞具體成分,探討所獲得細胞在體外培養中的轉化過程,以進一步優化雄激素分泌組織的種子細胞構成。
1 材料與方法
1.1 睪丸間質細胞獲取
出生后7天齡、3周齡雄性Wistar大鼠(中科院上海實驗動物中心提供)脫頸法處死,無菌取睪丸,PBS沖洗后,冰上剝離白膜及較大的血管。將0.25%膠原酶NB4(Serva,德國)與組織量按1:1比例,37℃、100次/分鐘振蕩消化至睪丸組織形狀剛好消失,曲細精管間組織松散,但曲細精管連續而無明顯斷裂時,加入2倍于消化懸液體積的培養液或PBS終止消化,以直徑為30 μm的不銹鋼濾網過濾,濾液經1500 r/min離心5 min,所得細胞計數后以2.5×106cell/cm2的密度進行接種。37℃、5%CO2、95%O2和100%濕度下,以無血清的DMEM/F12(1:1)培養液培養。2 h后吸棄培養液中未貼壁的懸浮細胞,以PBS漂洗后加入DMEM/F12培養液培養。
1.2 原代及培養4 d后細胞成分分析
1.2.1 3β-HSD免疫細胞化學鑒定
原代細胞貼壁分離后即刻行3β-HSD免疫化學染色。以4%多聚甲醛固定10 min,PBS沖洗,1.25%Triton-X 100破膜,正常羊血清封閉非特異性反應位點,滴加兔抗人3β-HSD特異性多克隆抗體、4℃過夜,PBS沖洗一抗,滴加羊抗兔IgG第二抗體,37℃反應30 min,DAB顯色,蘇木素核襯染,鏡下觀察。原代細胞培養4 d后重復上述實驗。
1.2.2 3β-HSD免疫細胞化學流式細胞儀檢測鑒定
原代細胞貼壁分離后即刻,以0.25%胰蛋白酶-0.02%EDTA消化,收集待測細胞,PBS沖洗,4%多聚甲醛固定,1%Triton-BSA進行細胞膜穿孔,標記兔抗人3β-HSD特異性多克隆抗體(1:100,Santa Cruz,美國)及FITC標記的羊抗兔IgG(1:1 000,DAKO,美國),流式細胞儀(Beckman Coulter,USA)進行3β-HSD陽性鑒定,檢測陽性細胞百分比。原代細胞培養4 d后重復上述實驗。
1.3 原代培養細胞睪酮分泌功能檢測
原代細胞按每孔1.0×105個接種于24孔板上,每天收集原代細胞HCG刺激組和無刺激組培養液上清,經Access全自動免疫分析系統(RIA,微粒子發光原理)(Beckman Coulter,USA)測定睪酮水平。
2 實驗結果
2.1 差速貼壁法獲得睪丸間質內細胞
7天齡的Wistar大鼠睪丸去除白膜后,濕重為(0.081±0.023)g;3周齡大鼠睪丸去白膜后濕重為(1.67±0.49)g。采用差速貼壁法,7天齡大鼠每克睪丸組織濕重可獲得(0.06±0.004)×106個細胞,3周齡大鼠睪丸每克濕重收獲細胞數為(1.4±0.6)×106個。
2.2 原代培養細胞形態改變
原代培養2 h后,7天齡、3周齡大鼠睪丸間質細胞均為圓形,未鋪展(圖1-A、D)。原代培養12 h,7天齡大鼠睪丸間質細胞多數為長梭形,鏡下觀察具有高折光性,細胞聚集為條索狀,呈特征性的六邊形排列(圖1-B);培養4 d后,多數細胞完全鋪展,呈拉網樣生長(圖1-C)。3周齡鼠睪丸間質內細胞原代培養12 h后細胞開始鋪展,呈拉網樣生長,其中部分細胞呈長梭形(圖1-E),培養過程中細胞形態無顯著改變(圖1-E、F)。
2.3 培養細胞成分分析
7天齡大鼠差速貼壁法獲得的睪丸間內細胞絕大多數3β-HSD免疫化學染色陰性(圖2-A),體外培養4 d后絕大多數細胞表達3β-HSD(圖2-B);經流式細胞分析,貼壁分離即刻(5.4±1.2)%細胞3β-HSD陽性,原代培養4 d后3β-HSD陽性細胞比例為(93.6±1.2)%(圖3-A、B)。3周齡大鼠大部分原代細胞表達3β-HSD(圖3-C),培養4 d后,絕大多數梭形細胞及鋪展細胞均表達3β-HSD(圖3-D);經流式細胞分析,貼壁分離即刻(59.2±3.2)%細胞3β-HSD陽性,原代培養4 d后3β-HSD陽性細胞比例為(95.4±3.2)%(圖3-C、D)。
2.4 培養細胞睪酮分泌功能檢測
7天齡鼠睪丸間質細胞在培養中睪酮分泌能力逐漸增強,第5天達到高峰(圖4);3周齡鼠睪丸間質細胞在培養第2天睪酮分泌功能達到高峰,其后逐漸下降(圖5)。兩組培養的睪丸間質細胞均對HCG刺激有反應,在HCG作用下睪酮分泌增加。
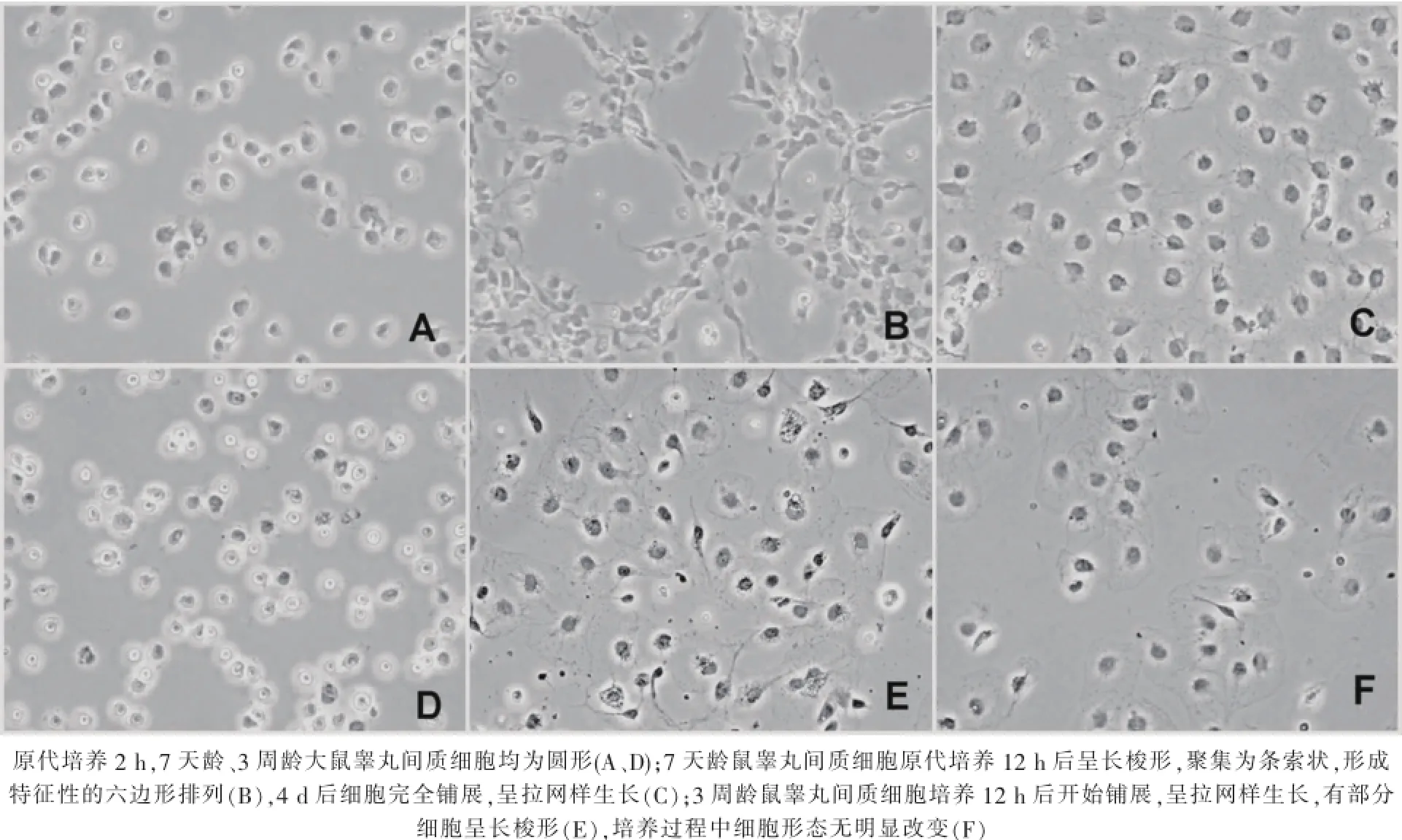
圖1 原代培養細胞形態變化
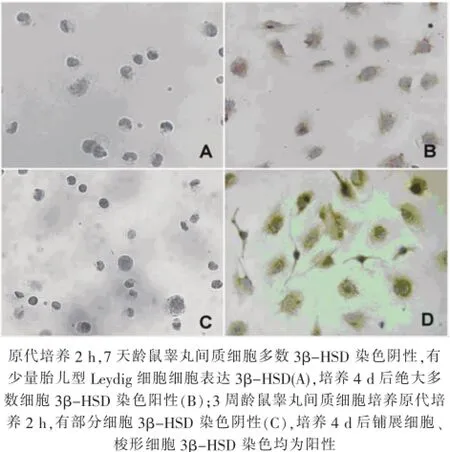
圖2 培養細胞3β-HSD免疫組織化學染色
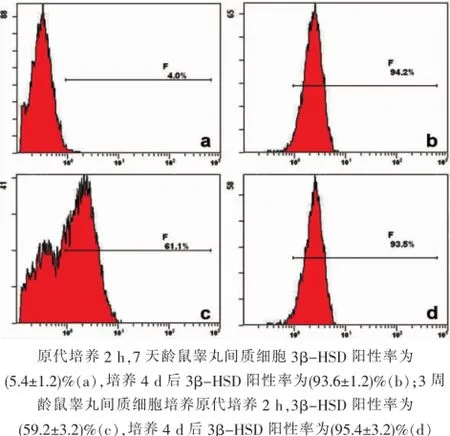
圖3 培養細胞3β-HSD流式細胞學分析
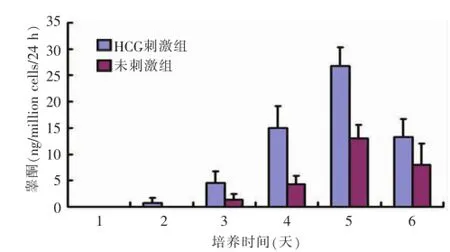
圖47 天齡大鼠睪丸間質細胞睪酮分泌能力檢測
3 討論
組織工程技術的發展可能為睪丸缺失、雄激素缺乏性疾病的治療提供理想的治療手段。作為組織工程化雄激素分泌組織的重要種子細胞,睪丸Leydig細胞的獲取一直是限制該研究深入的瓶頸。傳統的Leydig細胞收獲技術,是基于細胞密度差異基礎上、以Percoll密度梯度離心為主要手段的一系列復雜分離過程,細胞獲得量少、流失量大且活力低。本課題組在前期研究中采用差速貼壁的方法收獲Leydig細胞,初步解決了雄激素分泌組織構建的種子細胞來源問題。但對于差速貼壁法獲得的Leydig細胞具體細胞成分了解尚少。本研究中,我們采用差速貼壁法收獲7天齡、3周齡大鼠睪丸間質內細胞,通過細胞培養觀察、免疫組織細胞化學染色、流式細胞術分析以及細胞生物學活性檢查等方法,證實了經差速貼壁法,從不同鼠齡的大鼠睪丸內獲得的Leydig細胞中均含有一定比例的SLCs,不同鼠齡大鼠睪丸Leydig細胞群中干細胞比例是不同的,但在體外培養過程中所獲得的SLCs均逐漸分化,獲得3β-HSD酶活性。
睪丸SLCs是具有向Leydig成體細胞定向分化能力的間充質來源干細胞,大鼠的SLCs在出生后第2周(有報道最早于出生后第10天)開始向成體細胞分化,形成Leydig前體細胞(Progenitor Leydig cells,PLCs)。3β-HSD的表達與否,是SLCs與PLCs區別的重要標志[3-4]。本研究中,我們在體外培養的不同時段對兩組培養細胞進行3β-HSD免疫化學染色鑒定及流式細胞分析,原代培養4 d后的檢測結果,證實了所獲得的細胞為純化的Leydig系細胞。而在培養初期(貼壁2 h),兩組均有部分細胞為3β-HSD陰性,培養4 d后細胞3β-HSD陽性率明顯升高。我們在培養過程中沒有觀察到細胞增殖現象,不存在陽性細胞增殖導致培養細胞3β-HSD陽性率升高的可能。因此可以肯定,培養初期的3β-HSD陰性細胞在培養過程中發生了轉化,獲得了3β-HSD活性。上述結果表明,差速貼壁法能夠獲得的7天齡、3周齡大鼠睪丸Leydig系細胞中,都含有一定比例的SLCs。但是,在DMEM/F12培養液培養條件下,所獲得的SLCs很快發生了分化。
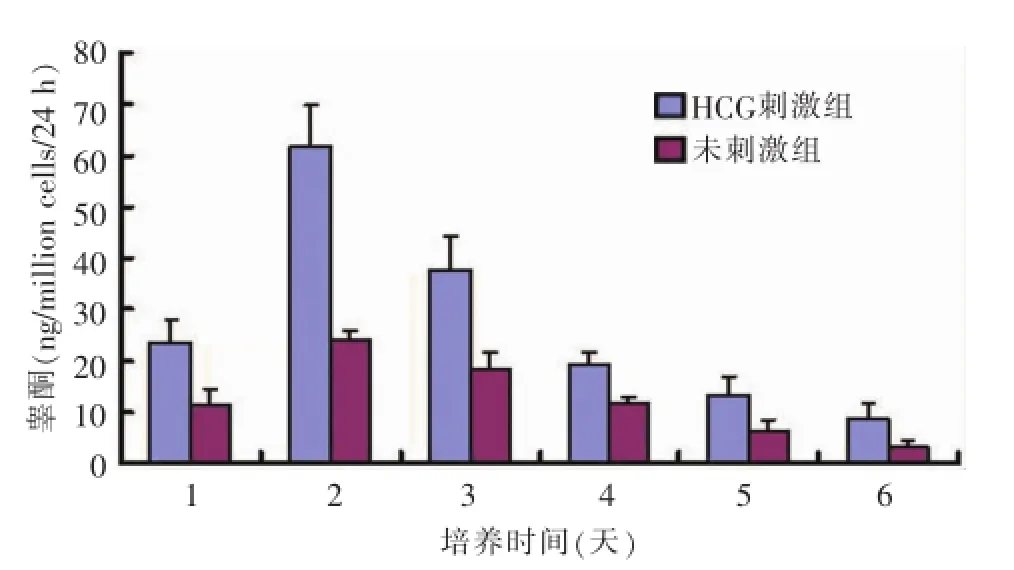
圖53 周齡大鼠睪丸間質細胞睪酮分泌能力檢測
不同鼠齡的大鼠,經差速貼壁法獲得的Leydig細胞中干細胞所占的比例存在較大差異,這種差異與大鼠睪丸Leydig細胞發育的階段特點是一致的。睪丸SLCs向成體細胞分化開始于出生后第10天,7天齡大鼠睪丸間質內SLCs尚處于未分化狀態,僅有少量的胎兒型Leydig細胞存在[5]。自出生后第10天開始,SLCs大量增殖、分化,產生成體Leydig細胞,SLCs在睪丸間質內的比例隨著Leydig細胞的發育成熟逐漸下降[6]。我們通過差速貼壁法獲得的睪丸間質細胞,在7天齡大鼠組以睪丸間質干細胞為主,在3周齡大鼠組Leydig前體細胞、成體細胞占到了較高的比例,反映了SLCs在睪丸組織內所占比例的變化規律。
兩組大鼠Leydig細胞在培養過程中都檢測到睪酮分泌功能,在HCG刺激下睪酮分泌能力均明顯提高,但睪酮分泌功能變化不完全一致。3周齡組細胞中因成體細胞占到了一定比例,早期即表現出睪酮分泌能力,在培養第2天達到睪酮分泌高峰后逐漸下降;7天齡組最初睪酮分泌水平較低,在培養過程中細胞逐漸獲得睪酮分泌活性,分泌高峰出現在培養第5天。上述結果說明,SLCs有助于睪丸Leydig細胞維持睪酮分泌的持續時間。在成年動物體內,雄激素來源主要依賴于睪酮分泌功能最旺盛的成體Leydig細胞,而成體Leydig細胞為終末分化細胞,不具備增殖能力,其數量的穩定依靠SLCs維持。我們以前構建的雄激素分泌組織在較長時間(6個月)內維持睪酮分泌能力,與差速貼壁法獲得的Leydig細胞中含有一定量的SLCs不無關系。
純化的SLCs在特殊設計的培養體系內能夠維持細胞表型穩定,持續增殖[6]。本研究中,我們獲得的SLCs未出現增殖現象,并且細胞在培養過程中很快出現分化。一方面是由于目前的培養體系不利于細胞擴增;另一方面,差速貼壁法獲得的細胞群中,各級Leydig細胞成分混雜在一起,細胞共培養通常會促使干細胞分化。通過改善細胞培養體系、細胞純化等措施,有望實現差速貼壁法獲得的SLCs的穩定體外擴增,并通過調節種子細胞中干細胞比例的方式,優化雄激素分泌組織種子細胞的構成,實現組織工程化雄激素分泌組織維持長期、穩定的睪酮分泌功能。
綜上所述,經差速貼壁法獲得的睪丸間質細胞群中含有一定比例的SLCs,其比例隨著動物年齡的不同而存在一定差異,體外培養過程中SLCs能夠分化為有睪酮分泌功能的成體細胞,有助于差速貼壁法獲得的細胞群睪酮分泌功能的持續。但是,差速貼壁法獲得的睪丸Leydig系各種細胞成分的純化、增殖,仍需進一步深入研究。
[1]王曉云,邢新,周廣東.簡易快速獲得大量高純度大鼠Leydig細胞[J].中華泌尿外科雜志,2007,28:86-90.
[2]王曉云,邢新,周廣東.共培養大鼠睪丸體細胞組織工程技術構建雄激素分泌組織[J].中華醫學雜志,2007,87(31):2223-2227.
[3]Chamindrani SML,Handagama M,Siril HB,et al.Differentiation of the adult Leydig cell population in the postnatal rat testis[J]. Bio Repro,2001,65:660-671.
[4]Davidoff MS,Middendorff R,Enikolopov G,et al.Progenitor cells of the testosterone-producing Leydig cells revealed[J].J Cell Biology,2004,167(5):935-944.
[5]Siril HB,Chamindrani SML,Handagama M,et al.Studies on the onset of Leydig precursor cell differentiation in the prepubertal rat testis[J].Bio Repro,2000,63:165-171.
[6]Teerds KJ,Rijntjes E,Veldhuizen-Tsoerkan MB,et al.The development of rat Leydig cell progenitors in vitro:howessential is luteinising hormone[J]?J Endocrinology,2007,194:579-593.
[7]Ge RS,Dong Q,Sottas CM,et al.In search of rat stem Leydig cells: Identification,isolation,and lineage-specific development[J]. PNAS,2006,103(8):2719-2724.
Expression of 3β-Hydroxysteroid Dehydrogenase in Rat Leydig Cells Cultured by Differential Adhesion In Vitro
BI Hongda1,WANG Xiaoyun1,ZHOU Guangdongi2,LIU Wei2,LI Ming1,XING Xin1.
1 Department of Plastic Surgery, Changhai Hispital,Second Military Medical University,Shanghai 200433,China.2 Shanghai Laboratory of Tissue Engineering, Shanghai Ninth People′s Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China.Corresponding auther:XING Xin.
ObjectiveTo investigate the constitution of cells population,changes in 3β-hydroxysteroid dehydrogenase (3β-HSD)expression and androgen productivity in rat Leydig cells cultured by differential adhesion during 4 days primary culture.MethodsTestes from 7 days and 3 weeks old rats were harvested,then Leydig cells were isolated by using collagenase dispersion,stainless steel mesh infiltration and differential adhesion.3β-HSD expression in cultured cells was observed by immunohistochemistry and flow Cytometry analysis immediately after cell isolation and 4 days later.Testosterone level in isolated Leydig cells with or without HCG stimulation was also tested.ResultsIn 7 days group and 3 weeks old group 3β-HSD positive rates in cultured cells were 5.4±1.2%and 59.2±3.2%respectively after isolation immediately.4 days affer culture,most of the cultured cells(93.6±1.2%in 7 days old group,95.4±3.2%in 3 weeks old group)became 3β-HSD positive.Testosterone level,increased by HCG stimulation,in cultured cells from both groups.ConclusionLeydig cells obtained by differential adhesion from 7 days and 3 weeks old rats consist Stem Leydig cells(SLCs).These SLCs were differentiated and gained 3β-HSD activity during cell culture.
Leydig Cell;Differential Adhesion;Testosterone;3β-hydrosteroid dehydrogenase;Tissue Engineering
Q813.1+1
A
1673-0364(2009)-01-0007-05
2008年12月11日;
2009年1月14日)
10.3969/j.issn.1673-0364.2009.01.003
200433上海市第二軍醫大學長海醫院整形外科(畢宏達,王曉云,李鳴,邢新);200011上海市上海交通大學醫學院附屬第九人民醫院,上海組織工程重點實驗室(周廣東,劉偉)。
邢新。

