乙醇催化氧化實驗的改進
蔡 晶 陳磊磊
摘要: 在現行版實驗的基礎上,對其他關于乙醇在銅催化下與氧氣反應生成乙醛實驗進行分析歸類, 并且提出和設計了新的乙醇在銅催化下與氧氣反應生成乙醛的實驗的簡易裝置。
關鍵詞: 實驗裝置; 改進
文章編號:1005-6629(2009)05-0010-03中圖分類號:G633.8文獻標識碼:C
1問題的產生
乙醇在銅催化下與氧氣反應生成乙醛的實驗,是學習乙醇重要性質的傳統實驗。蘇教版高中化學教材安排的實驗操作是:在試管里加3~5 mL乙醇,浸入50℃左右的熱水中。將銅絲燒熱,迅速插入乙醇中,反復多次。觀察并感受銅絲的顏色和乙醇的氣味變化。上述實驗簡易,操作起來比較方便。
在用這個裝置進行教學的過程中,其不足之處主要表現為:(1)實驗的可觀察性不強;(2)采用聞的方法不可靠;(3)實驗只能證明銅絲的顏色變化,不能充分證明其產物有乙醛。
2 文獻里關于改進后的實驗裝置
查閱其他關于乙醇在銅催化下與氧氣反應生成乙醛的實驗,下列裝置從不同的方面改進了原有的實驗設計,提高了實驗的成功率并給其他實驗的改進提供了一些新思路和有益的借鑒。
從氧氣與銅絲反應時,氧氣的來源的角度看主要可分為如下幾類:
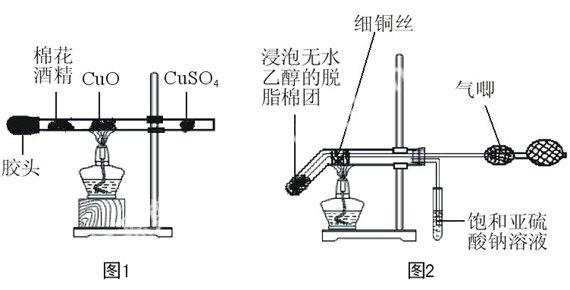
(1)第一種是利用管內空氣,如最左端用膠頭封閉,該實驗時間比較短,從加熱到結束只需1分鐘,但不能讓學生看到銅絲顏色由紅-黑-紅的動態變化過程[1]。(圖1)
(2)第二種是最右端接氣唧,這個實驗比較容易控制,鼓進去的是空氣,銅氧化成氧化銅時需要2~3分鐘[2]。(圖2)
(3)第三種就是左端用MnO2中滴加10 %~15 %的H2O2水溶液,長頸漏斗可以控制氧氣的產生量,從而控制實驗的反應過程。產生的氧氣使銅氧化成氧化銅的時間變短[3]。(圖3)
從乙醇的來源看,主要分為幾類:
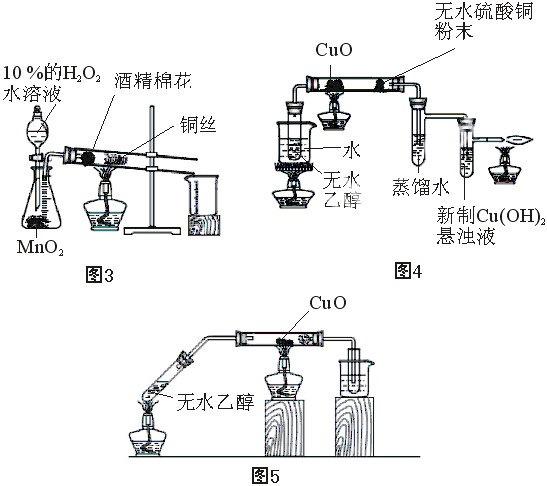
(1)第一種是無水乙醇通過水浴進入導管與銅絲發生反應,此時乙醇蒸汽量比較大,反應效果好,但加熱時間較長,反應不容易控制 [4]。(如圖4)
(2)第二種是直接試管加熱無水乙醇使蒸汽進入導管與銅絲發生反應,和圖4一樣乙醇的蒸汽的量比較大, 反應效果好, 但也存在和圖4同樣的缺點[5]。(如圖5)
(3)第三種是用脫脂棉蘸取無水乙醇放于導管中,該操作設計簡易方便,但乙醇蒸汽的量比較小。(如圖1)
3筆者改進后的簡易實驗裝置
鑒于以上原因,筆者根據中學化學實驗的安全性原則、目的性原則、簡易性原則、直觀性原則、可靠性原則、科學性原則,對實驗進行了改進。
3.1實驗用品
無水乙醇、細銅絲、白色CuSO4粉末、20 %NaOH溶液、5 % CuSO4溶液;試管、硬質玻璃管、酒精燈、滴管、鐵架臺、氣唧等。
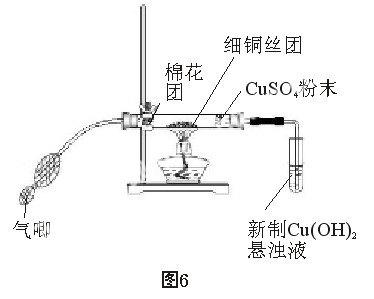
3.2實驗裝置圖
3.3實驗步驟
(1)配制新制氫氧化銅溶液,用滴管滴2~3滴5 % CuSO4溶液于10 mL 20 % NaOH溶液中。
(2)裝置如圖6所示:把細銅絲團放于中間,用酒精燈預熱銅絲4~5分鐘,發現銅絲由紅色變黑色。用鑷子夾一小團棉花蘸取2~3 mL無水酒精,放于硬質玻璃管的最左端,裝上氣唧,硬質玻璃管的右端放入少量白色CuSO4粉末,塞好橡皮塞,把另一端橡皮塞中的導管伸入盛有新制氫氧化銅溶液的試管中。
(3)把酒精燈一直放在銅絲部位加熱,片刻后,銅絲由黑色變成亮紅色,此時鼓動一兩次氣唧,銅絲又馬上變黑色;停止鼓動,片刻后,銅絲又會變成亮紅色,如此反復,銅絲顏色由紅-黑-紅一直在變化,白色CuSO4粉末也逐漸變藍色,說明有水生產,也可以看到右邊的新制氫氧化銅溶液的試管中在鼓動氣唧時有氣泡產生。
因為在鼓動氣唧時,有大量的空氣進入硬質玻璃管中,乙醇蒸汽只占少部分,所以銅絲與空氣中的氧氣反應,產生氧化銅變黑色;當不鼓動氣唧時,硬質玻璃管中主要是乙醇蒸汽,當受熱的硬質玻璃管中,乙醇積聚到一定量時就會使氧化銅還原成銅而得到乙醛和水,白色CuSO4粉末吸收了水而變為藍色,乙醛蒸汽進入試管中。
(4)取下新制氫氧化銅溶液的試管,這時試管中已經含有乙醛。用試管夾在酒精燈上加熱,可以看到溶液逐漸產生磚紅色沉淀,現象明顯。可以證明產生了乙醛。
3.4實驗優點
(1)實驗裝置簡單容易操作,能夠簡單明了地突出實驗主題,便于教師教和學生學,使學生形成較深刻的印象。
(2)實驗現象明顯直觀,符合學生演示實驗的要求,體現了實驗的原理和本質。
3.5注意事項
(1)選用0.3~0.5 mm的細銅絲, 盡量多一些,使得催化劑的量比較大,產生的乙醛比較多。
(2)試管的氣密性要好,如果橡皮塞沒塞好,外面的空氣容易進入反應系統,影響催化反應的效率。
(3)氫氧化銅的量要少,因為產生的乙醛蒸汽畢竟量不多,如果氫氧化銅的量多的話,使之產生磚紅色沉淀很不明顯。
(4)用無水酒精的效果最好,易揮發。
參考文獻:
[1]黎茂堅.實驗室乙醇氧化成乙醛的微型實驗[J].化學教育,2003(1):4.
[2]王恩德.乙醇氧化生成乙醛的實驗設計[J].化學教學,2001(12):6~7.
[3]黃秋鈴. 乙醇氧化成乙醛實驗裝置的探究[J]. 化學教育,2006(1):57~58.
[4]韓學忠. 教學儀器與實驗[J]. 教學儀器與實驗,2005(6):24.
[5]何家忠. 乙醇氧化制乙醛的實驗改進[J]. 安慶師范學院學報,1998(3):113~114.

