論高一化學“粗鹽提純”實驗的不足
許晨戀
摘要:對上海市二期課改修訂版高一化學學生實驗“粗鹽提純” 在實驗目的、實驗內容上的不足提出了修改。
關鍵詞:可溶性雜質;沉淀法;過量試劑
文章編號:1005-6629(2009)05-0017-03中圖分類號:G633.8文獻標識碼:C
在二期課改《化學》教材中,“粗鹽提純”這一實驗設置在了九年級第一學期和高中一年級第一學期,充分突顯了該實驗在化學教學中的重要性。
然而反觀兩個年級“粗鹽提純”實驗報告,有著區分度不高,內容類似的弊病。除了在《化學練習部分高中一年級第一學期(試用本)》【實驗二 粗鹽提純】中增加了“用少量蒸餾水洗滌晶體”的這樣簡單的一步,兩個實驗無論從實驗的目的性(掌握從固體混合物中去除不溶性雜質即粗鹽中的細沙)或是實驗的基本操作(溶解過濾蒸發)上都近乎相同。從本質上來說,高中進行該實驗只是機械地重復了初中的內容,而未做任何提高。這樣的設計不符合學習的特點。學習是進階型的,在知識的階梯上同學們拾級而上,層層深入,直到邁向知識的最高殿堂。而教師起到的作用就是授之以“漁”,常教常新,如此才能強化學生的感知態度,促進學生自我思考發展。
《化學高中一年級第一學期(試用本)》第23頁圖2.1《天工開物》中制海鹽圖中,古人采取“先日撒灰,日中掃鹽”的方法,其中的“灰”即指能除去某些可溶性雜質的草木灰。第24頁提供了表2.1“海水在濃縮過程中析出鹽的種類和質量”,已經明確指出:在由海水濃縮得到的粗鹽中往往存在這樣的幾種微量雜質:MgCl2、MgSO4、CaSO4。在第30頁【思考與復習2.1】中第2題又提出了“在粗鹽提純中,通常在溶液中依次加入BaCl2、NaOH和Na2CO3,以除去SO42-(Na2SO4)、Mg2+(MgCl2)和Ca2+(CaCl2)”。以上三處在課本中出現的內容,足以說明對于粗鹽中一些可溶性雜質的去除,是這一節學習的重中之重,是對九年級粗鹽提純的深化和補充。問題的探索已經讓學生的心動起來,現在是時候“勵其行、促其思、放其手”了。只有通過對粗鹽中可溶性雜質(如硫酸鈉、氯化鎂、氯化鈣等)去除的“實踐”,才能完成他們對化學體系中除去純凈物中的雜質這一整體的“探究”。
考慮到高中教學的系統性、嚴密性和豐富性,首先,我將實驗名稱更改為【粗鹽提純2】;同時在【實驗目的】的表述上添加并著重于“掌握溶液中可溶性雜質的去除方法”,較原實驗目的性有了本質的改變與提升。
在實驗進行的具體過程中,應體現出豐富性。原實驗報告中采用了“水洗法去雜”,由于步驟實在過于簡單,導致了與九年級實驗報告有如“雙胞胎”的嚴重問題,無法讓同學們真正深切體會到粗鹽提純的另一個重要點——可溶性雜質的去除。這樣的漏洞,不免使高一的同學對于化學學習的豐富性產生懷疑,成為以后在化學學習上產生倦怠的隱患。為此,我在實驗報告中添加了【實驗原理】這一塊內容,其好處在于(1)點明了實驗中采用的去除可溶性雜質的方法為“沉淀法”,讓同學有據可尋;(2)增加了實驗過程流程圖,使整個實驗步驟豁然開朗。(具體見實驗報告)
當然,實驗中的嚴密操作是啟發同學思考的關鍵。首先,在加水溶解時,對所加水量的控制,牽涉到“讓固體完全溶解”與“蒸發中所需的時間”這兩個條件,為了使同學們思考全面,將此問題作為了【思考與討論】第一題出現。其次,硫酸鈉、氯化鈣、氯化鎂三種雜質去除,必然存在先后順序,對于孰先孰后的討論,能提高同學們思維的嚴密性。最后,在以沉淀法去雜過程中,為保證可溶性雜質全都轉化為沉淀,就必需添加過量的除雜劑,在將堿性溶液還原到氯化鈉溶液時,則只能添加適量的鹽酸。實驗中的“3個過量” “1個適量”引出了對于“量”這個概念的嚴格取用。(具體見實驗報告)
綜上所述,我設計了如下實驗
實驗報告粗鹽提純2
【實驗目的】
1. 初步掌握溶液中可溶性雜質的去除方法
2. 學會從粗鹽提純氯化鈉的基本原理和方法
3. 熟練掌握溶解、過濾、蒸發和結晶等基本操作
【實驗原理】
化學試劑和醫院用的氯化鈉都是以粗食鹽為原料提純的。粗食鹽中,含有不溶性雜質和Ca2+、Mg2+、SO42-等可溶性雜質。從粗食鹽提純氯化鈉,要選擇合適的試劑,使氯化鎂、氯化鈣、硫酸鈉轉變成沉淀而除去,此法稱“沉淀法”。
為了使雜質充分沉淀而除去,所加試劑(又稱沉淀劑)必須是過量的。加入過量的試劑必然會引入新的雜質,因此要設計幾種試劑加入的先后順序,最后必須除盡各種雜質(包括加入的過量試劑),得到純凈的氯化鈉。
設計從粗食鹽提純氯化鈉的實驗方案,填寫下列實驗框圖1所示流程。
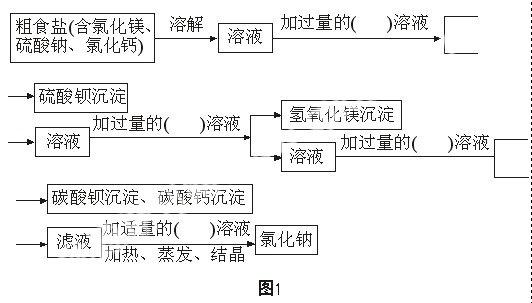
【實驗用品】
100 mL燒杯(2只)、 250 mL燒杯、玻璃棒、鐵架臺(帶鐵圈)、石棉網、天平、100 mL量筒、酒精燈、漏斗、濾紙、蒸發皿、火柴、剪刀
粗食鹽(含少量硫酸鈉、氯化鈣、氯化鎂)、2 mol/L鹽酸、1 mol/L氯化鋇溶液、1 mol/L氫氧化鈉溶液、飽和碳酸鈉溶液、pH試紙、蒸餾水
【實驗內容】
1.稱量:用天平稱取10 g粗鹽,用量筒量取蒸餾水35 mL, 放入100 mL燒杯中
2.溶解:將該燒杯放在鐵架臺鐵圈上隔著石棉網加熱、攪拌,加速食鹽的溶解
3.去除硫酸鈉: 繼續加熱溶液近沸騰, 加入 1 mol/L 氯化鋇溶液2-3 mL。觀察到__________,反應的化學方程式_________________________。繼續加熱上述懸濁液4分鐘。待沉淀沉降,在上層清液中加1-2滴氯化鋇溶液,仔細觀察,溶液不出現渾濁,表示硫酸鈉______________________。如出現渾濁,繼續加入1 mL 1 mol/L氯化鋇溶液,重復上述操作,直到硫酸鈉除盡為止。
4.除去氯化鎂: 加熱燒杯中液體近沸騰,邊攪拌邊滴加1 mol/L氫氧化鈉溶液,直到不再產生沉淀為止。待沉淀全部沉降,取上層清液,檢查氯化鎂是否去除盡。
5.除去_____、_____: 在上述液體中滴加飽和碳酸鈉溶液,直到不再產生沉淀為止。書寫化學方程式______________,____________________。取上層清液,檢查雜質是否除盡。
6.過濾: 制作過濾器,裝配好過濾裝置,過濾燒杯中液體,除去不溶性雜質。
7. 除去碳酸鈉:待冷卻后在上述濾液中滴加2 mol/L 鹽酸,直到溶液pH值為7。
8.蒸發: 將濾液轉移入蒸發皿中,加熱攪拌,至有較多食鹽析出時停止加熱,利用余熱使溶液蒸干。
9.稱量: 用天平稱量精鹽。
【實驗記錄和計算】
粗鹽的質量是_____________g。
精鹽的質量是_____________g。
粗鹽提純精鹽的收得率:(精鹽的質量÷粗鹽的質量)×100%=_____________。
【思考和討論】
1.為什么10 g粗鹽要量取35 mL左右水來溶解?食鹽常溫下的溶解度約36 g/100 g水,試通過計算回答。
2. 在去除雜質的過程中,給溶液加熱有什么好處?
3. 粗鹽提純過程中,幾次用到玻璃棒,每次的作用各是什么?
4. 為了除去粗鹽中的可溶性雜質及泥沙,可將粗鹽溶于水,然后進行五項操作:①過濾②加過量氫氧化鈉溶液③加適量鹽酸④加過量碳酸鈉溶液⑤加過量氯化鋇溶液。正確的操作順序為()
(A)⑤、②、④、①、③ (B)④、①、②、⑤、③
(C)②、⑤、④、①、③ (D)①、④、②、⑤、③
5. 當粗鹽中的可溶性雜質都是微量的時候,可以用什么方法簡單去除雜質?
6. 分析自己實驗操作中有哪些不足之處,如何改進?
修改后實驗的優點在于:
(1)以【實驗原理】作為基礎導向,其中增設的填空引發同學思考,促使他們未行先想,利于培養他們用審視的態度去證實知識形成過程的膽略。
(2)較原實驗強調了可溶性雜質去除的具體步驟與先后順序,完整了同學除去雜質的系統思維法。
(3)通過對“3個過量”“1個適量”的操作與討論培養量化的嚴密性。
(4)增加了溶液中可溶性雜質是否徹底去除的判斷,豐富了實驗內容,增強了趣味性。
(5)以硫酸鈉雜質是否除盡為標準,由同學自行推導出判斷其他雜質是否除盡的方法,提高了同學歸納小結的能力。
(6)實驗內容關于除去雜質內容的填空,提高了同學分析問題的能力;思考與討論中第5題以“水洗法”除雜涵蓋了原實驗的主要內容,提高了同學解決問題的能力。
(7)實驗中的部分填空,鞏固了方程式的書寫;實驗現象也較原實驗更直觀生動。
(8)辨析了各種儀器的不同加熱方法,強化了實驗的操作能力。
(9)剔除了原【思考與討論】中的某些與九年級教材相同的提問,避免重復。增設了選擇題豐富題型,降低了難度,同時概括了添加沉淀劑先后順序對提純結果有無影響,培養學生嚴密地思考問題及解決問題的能力。
(10)整個實驗緊扣教材內容,強調了理論結合實際的主旨。

