肥大細胞釋放生物活性介質促進TNCB致敏淋巴細胞分泌IL-17
王慶輝,呂昌龍,施 鵬,劉 軍,龐 維,馮 輝,陳鯤鵬,單風平*
(1.中國醫科大學基礎醫學院免疫學教研室,遼寧沈陽 110001;2.沈陽醫學院附屬奉天醫院婦產科,遼寧沈陽 110024)
接觸性超敏反應(Contact hypersensitivity,CHS)是由于接觸金屬、橡膠、化學制品、化妝品和藥物等外界物質而引發的皮膚炎癥性改變,被認為是由抗原特異性T細胞介導的遲發型超敏反應。利用氯化苦咪酸(Trinitrochlorobenzene,TNCB)和二硝基氟苯(Dinitrofluorobenzene,DNF-B)等半抗原誘導CHS的小鼠模型的實驗結果表明,T細胞通過釋放TNF-α和IFN-γ等前炎癥性細胞因子,誘導局部組織細胞釋放趨化因子,募集白細胞至受侵部位,造成組織水腫、紅斑,反復刺激甚至可發生出血壞死。近年來,研究報道顯示I L-17也參與了CHS的致病過程。 IL-17主要是由Th17細胞分泌的一種前炎癥性細胞因子。Th17特異性轉錄因子ROR-γt在CHS的表達增加[1]; IL-17-/-小鼠CHS的反應和炎細胞的浸潤程度均低于野生對照小鼠[2];利用抗 IL-17抗體進行體內阻斷,也表明 IL-17在CHS的效應階段發揮重要作用[3]。但抗原物質如何誘導機體產生 IL-17尚未見報道。天然免疫的重要細胞—肥大細胞可釋放組胺、細胞因子等生物活性介質,阻止病原體的感染,構筑了機體的第一道防線。據報道,肥大細胞通過釋放TNF-α等介質,募集中性粒細胞,參與CHS[4]。由于肥大細胞具有分泌多種細胞因子的能力,推測其可能具有誘導T細胞分泌 IL-17的潛能,為此,本實驗利用TNCB致敏C57BL/6小鼠,檢測肥大細胞體外誘導致敏淋巴細胞分泌 IL-17的能力,為進一步揭示CHS的致病機制提供相關實驗數據。
1 材料與方法
1.1 材料
1.1.1 實驗動物 C57BL/6小鼠(本校實驗動物部提供),6~8周齡,雌性。
1.1.2 主要試劑 TNCB(Tokyo Kasei Co.,Tokyo,Japan);RPM I 1640培養基(Ther mo);FCS(Biological Industries,Haemek,Israel);小鼠 IL-3(PeproTech EC,London,United Kingdom);小鼠SCF(PeproTech EC);TNBS(Sigma);2.4G2(Pha rMingen);PE-anti FcεR I抗體(MAR-1,eBioscience),FITC-anti-c-kit抗體(BD Pharmingen);I L-6、TNF-α和 IL-17 EL ISA試劑盒(R&D Systems,Minneapolis,MN)。
1.1.3 主要儀器 FACSCalibur流式細胞儀(Becton-Dickinson,Franklin Lakes,N.J.,USA);酶標儀(Inte rMed NJ-2100);CO2孵箱(Harasawa,Japan)。
1.2 方法
1.2.1 骨髓來源的肥大細胞(born marrow-derived mast cells,BMMC)的制備 C57BL/6小鼠,雌性,6~8周齡。無菌鈍性分離小鼠雙側股骨,用1 mL注射器吸取少量RPM I-1640培養液沖洗股骨骨髓內細胞至10 cm無菌平皿中。收集細胞至10 mL離心管中,1 000 r/min,4℃離心5 min,棄上清。用10 mL BMMC培養液(含100 U/mL小鼠 IL-3和0.5 U/mL小鼠SCF的10%FCS-RPM I1640培養液)重懸細胞,移至10 cm無菌培養皿,于37℃,5%CO2孵箱孵育。常規換液,培養4周后待用。
1.2.2 流式細胞儀檢測 收集BMMC,調細胞懸液濃度至5×106個/mL。在預先加入FcγⅢ/Ⅱ封閉抗體2.42G的流式細胞儀專用染色管中加入細胞懸液0.1 mL,再加入PE-anti FcεR I單克隆抗體和FITC-anti-c-kit單克隆抗體,4℃避光孵育1 h后,加入1 mL PBS,1 000 r/min,4℃離心5 min,棄上清,洗細胞2遍。加入0.4 mL PBS混勻細胞。用FACSCalibur流式細胞儀分析細胞表面FcεR I和c-kit表達,即利用FACS CELLQUEST軟件獲取細胞,每個樣品分析10 000個細胞,使用前向散射角(FSC)及側向散射角(SSC)確定目的細胞群,然后以二維點陣圖顯示FcεR I+c-kit+的細胞百分數。
1.2.3 BMMC體外活化 收集BMMC,調BMMC細胞懸液濃度至1×106個/mL,接種于96孔細胞培養板,0.2 mL/孔,再加入LPS(終濃度為1μg/mL),同時設只加培養液的陰性對照,于37℃,5%CO2孵箱孵育3 h(TNF-α)或6 h( IL-6)。收集培養上清,-20℃保存,待細胞因子檢測。
1.2.4 體外細胞共同培養 用溶于丙酮的100 μL 5%TNCB在去毛的C57BL/6小鼠腹部涂抹致敏,同時設未經致敏的正常對照組。4 d后頸椎脫位處死小鼠,常規無菌分離腹部淋巴結,制備淋巴細胞懸液,用10%FCS-RPM I 1640培養液調細胞懸液濃度至1×106個/mL。同時,無菌取正常小鼠脾臟,常規制備脾細胞懸液,經100μg/mL絲裂霉素C于37℃,5%CO2孵箱孵育30 min后,再經溶于PBS的10 mmol/L TNBS于37℃孵育10 min,PBS洗細胞2遍,用10%FCS-RPM I 1640培養液調細胞懸液濃度至2×106個/mL,作為抗原提呈細胞(APC)。另將LPS活化的BMMC經絲裂霉素C于37℃孵育30 min后,PBS洗細胞2遍,調細胞濃度至2×106個/mL(MC)。將TNCB致敏小鼠的淋巴結細胞(TNCB-LN)和未經致敏的正常小鼠淋巴結細胞(N-LN)分別與APC和MC以細胞數1:1:1比例接種于96孔細胞培養板中,37℃,5%CO2孵箱孵育共同培養,即分別為TNCB-LN+APC+MC實驗組和N-LN+APC+MC對照組,同時設單純培養的TNCB-LN和NLN對照組。培養72 h后收集培養上清,-20℃保存,待 IL-17分泌檢測。
1.2.5 EL ISA試劑盒檢測細胞因子 按照EL ISA試劑盒說明書操作步驟分別檢測培養上清中TNF-α、 IL-6和 IL-17的分泌水平,每份標本設3個復孔。用酶標儀測定樣本的OD450值。以試劑盒提供的標準品繪制標準曲線,應用Sof tMax Pro 4.3.1LS軟件分析,計算細胞因子含量(pg/mL)。
2 結 果
2.1 成熟BMMC表型鑒定
小鼠BMMC培養4周后,經流式細胞儀檢測,>95%的細胞表達成熟肥大細胞的特異性表型(FcεR I+/c-kit+)(見圖1)。
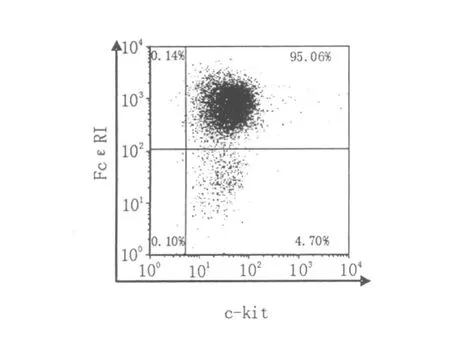
圖1 BMMC特異性表面分子的表達Fig.1 The expressions of specific markers on BMMC
2.2 成熟BMMC經LPS刺激后細胞因子的分泌
如圖2和圖3所示,小鼠BMMC培養4周后,培養上清中TNF-α和 IL-6的分泌處于較低水平,經1μg/mL LPS孵育后,TNF-α(3 h)和 IL-6(6 h)的分泌水平分別高達(152.3±4.19)pg/mL和(1 285.5±446.5)pg/mL,提示LPS活化的BMMC具有分泌炎癥性細胞因子的能力。
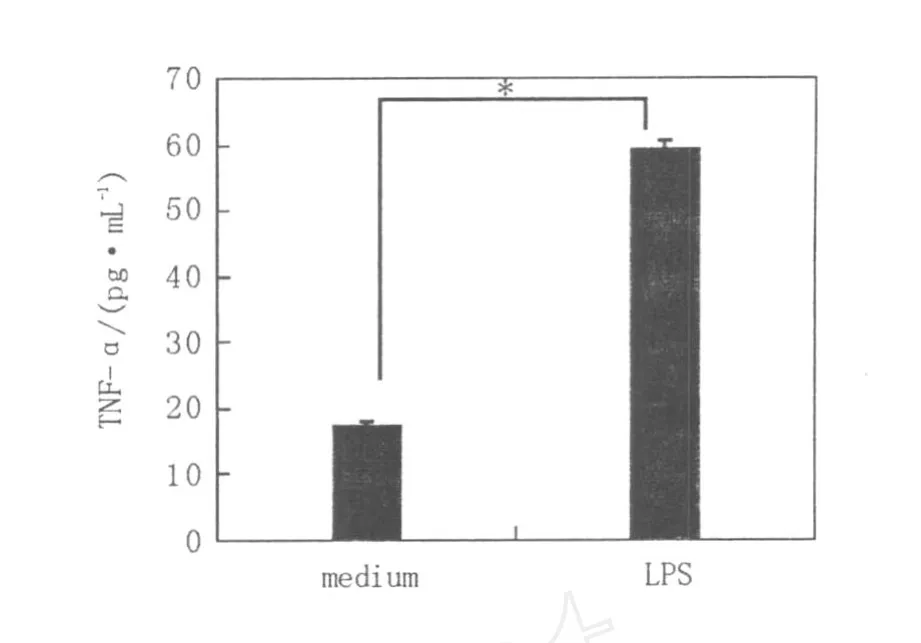
圖2 BMMC經LPS刺激后TNF-α的分泌水平Fig.2 The level of TNF-αin the supernatant of LPS incubated BMMC
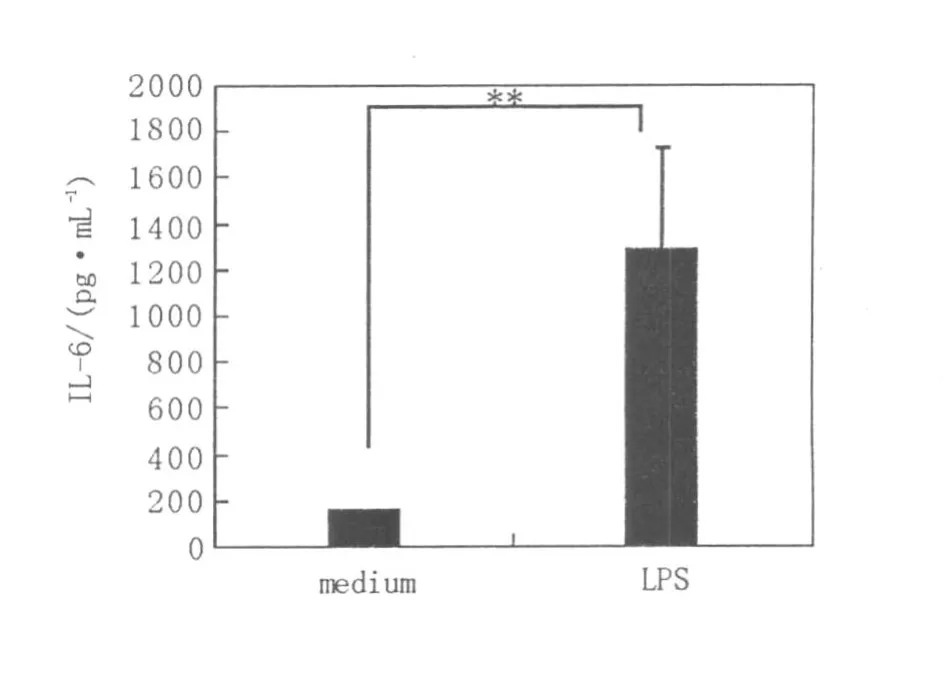
圖3 BMMC經LPS刺激后I L-6的分泌水平Fig.3 The level of IL-6 in the supernatant of
2.3 活化的BMMC誘導TNCB致敏小鼠淋巴細胞I L-17的分泌
如圖4所示,未致敏的淋巴細胞(N-LN)和TNCB致敏的淋巴細胞(TNCB-LN)單純培養后,
IL-17的分泌水平均較低;在TNBS處理的脾細胞作為抗原提呈細胞和活化的BMMC的存在下,TNCB致敏的淋巴細胞 IL-17的分泌水平(TNCBLN+APC+MC組)顯著高于未致敏的淋巴細胞(N-LN+APC+MC組)。由此提示,肥大細胞可促進TNCB致敏淋巴細胞的 IL-17分泌。
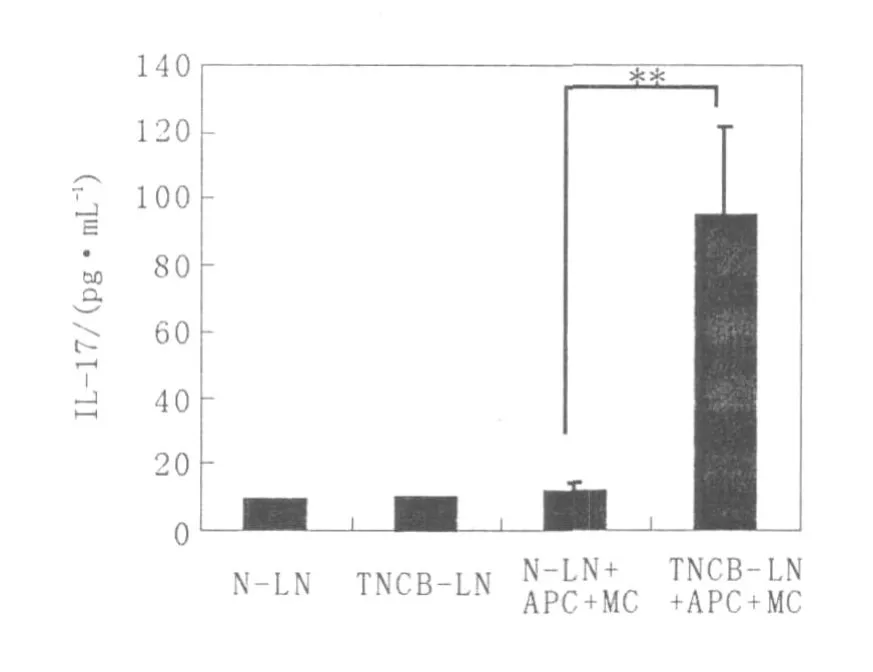
圖4 細胞混合培養上清中I L-17的分泌水平Fig.4 The level of IL-17 in the co-cultured supernatant
3 討 論
IL-17是介導Th17細胞發揮致炎效應的關鍵性細胞因子[5],動員并活化炎癥部位的中性粒細胞[6],參與過敏性炎癥、自身免疫病、器官移植及腫瘤等疾病的發生[7-8]。近年來,研究結果顯示IL-17和Th17細胞也參與了CHS的免疫病理過程[1-3]。因此,探討影響 IL-17分泌的相關因素對CHS的防治具有重要意義。本實驗主要利用CHS的誘導劑TNCB致敏C57BL/6小鼠,旨在研究肥大細胞誘導TNCB致敏淋巴結細胞分泌 IL-17的能力。
肥大細胞主要位于黏膜和結締組織中,由于其數量少,不易分離、純化,研究者們通常用成熟的骨髓來源的肥大細胞(BMMC)進行體外肥大細胞功能的研究。本實驗中小鼠骨髓細胞在肥大細胞培養液中培養4周之后,經流式細胞儀檢測>95%的細胞表面表達肥大細胞特異性標志FcεR I和c-kit,提示BMMC培養成熟。進而,非特異性活化的BMMC可以分泌多種細胞因子,如TNF-α、IL-6和 IL-12/23p40等[9]。其中 IL-6和 IL-23是維持促進Th17細胞分化的關鍵因素[10];TNF也被報道可以促進Th17細胞依賴性的中性粒細胞的募集[11]。因此,我們推測活化的BMMC可能具有誘導TNCB致敏淋巴細胞分泌 IL-17的能力。將小鼠淋巴結細胞與TNBS體外孵育后的脾細胞和活化的BMMC共同培養后,結果顯示與未致敏的淋巴細胞對照組相比,BMMC能夠刺激TNCB致敏小鼠淋巴細胞 IL-17的分泌。由此提示在CHS的致敏階段,肥大細胞可能通過釋放IL-6、TNFα-等生物活性介質,促進Th17細胞的分化和 IL-17的分泌。肥大細胞在 IL-17依賴的CHS的作用還有待體內試驗的進一步研究。
[1] Martiniuk F,Lee DS,Gaspari A,et al.Expression of CD70 and the TH17 transcription factor RORgammaT in human contact dermatitis[J].J DrugsDermatol,2008,7(10):956-960.
[2] akae S,Komiyama Y,NambuA,et al.Antigen-specific T cell sensitization is impaired in IL-17-deficient mice,causing suppression of allergic cellular and humoral responses[J]. Immunity,2002,17(3):375-387.
[3] He D,Wu L,Kim HK,et al.CD8+IL-17-producing T cells are important in effector functions for the elicitation of contact hypersensitivity responses[J].J Immunol,2006,177(10):6852-6858.
[4] Biedermann T,KneillingM,Mailhammer R,et al.Mast cells control neutrophil recruitment during T cell-mediated delayedtype hypersensitivity reactions through tumor necrosis factor and macrophage inflammatory protein 2[J].J Exp Med,2000,192(10):1441-1452.
[5] Bettelli E,Korn T,OukkaM,et al.Induction and effector functionsof T(H)17 cells[J].Nature,2008,453(7198):1051-1057.
[6] Kolls JK,Linden A.Interlukin-17 family members and inflammation[J]. Immunity,2004,21:467-476.
[7] CarlsonMJ,WestML,Coghill JM,et al.In vitro-differentiated TH17 cells mediate lethal acute graft-versus-host disease with severe cutaneous and pulmonary pathologic manifestations[J].Blood,2009,113(6):1365-1374.
[8] Wang YH,Liu YJ.The IL-17 cytokine familyand their role in allergic inflammation[J].CurrOpin Immunol,2008,20(6):697-702.
[9] NakanoN,Nishiyama C,Kanada S,et al.Involvement ofmast cells in IL-12/23 p40 production is essential for survival from polymicrobial infections[J].Blood,2007,109(11):4846-4855.
[10] Aggarwal S,Ghilardi N,Xie MH,et al.Interleukin-23 promotes a distinct CD4 T cell activation state characterized by the production of interleukin-17[J].J Biol Chem,2003,278(3):1910-1914.
[11] Nakae S,Suto H,Berry GJ,et al.Mast cell-derived TNF can promote Th17 cell-dependent neutrophil recruitment in ovalbumin-challenged OTIImice[J].Blood,2007,109(9):3640-3648.

