1株產漆酶白腐真菌的篩選和鑒定
關艷麗,李 莉,陳 飛,郭玲玲,華 霜,孫立梅
(1.遼寧省微生物科學研究院,遼寧朝陽 122000;2.沈陽農業大學土地與環境學院,遼寧沈陽 110161)
白腐真菌(white rot fungi)是一類絲狀真菌,因附生在樹木或木材上,引起木質白色腐爛而得名。通過菌絲侵入木質細胞腔內并分泌、釋放降解木質素和其他木質組分的生物酶,導致木質腐爛成為淡色的海綿狀團塊白腐。分類學上,白腐真菌屬于真菌門,絕大多數為擔子菌綱,少數為子囊菌綱[1]。白腐菌有顯著的降解木質素的能力,在所有能降解木質素的微生物中,白腐菌是目前研究最系統的、對木質素具有最強降解能力的一類真菌,它通過分泌胞外氧化酶來降解木質素,這種木質素降解酶系的主要成分有漆酶、木質素過氧化物酶和錳過氧化物酶等。近年來,有關漆酶的研究在國際上越來越受到重視。由于它在降解木質素、微生物菌體形態形成以及植物病原等方面的功能,使其在制漿造紙工業、染發、飲料加工等方面得到了廣泛的研究和應用。尤其在制漿造紙工業的紙漿生物漂白、廢水處理等方面具有很大的研究價值和應用潛力。由于漆酶可與有毒的酚類物質作用,使苯氧基類除草劑、石油工業廢物等造成環境污染的物質去毒,因而頗具環保意義[2]。本文主要進行產漆酶白腐菌的篩選,結合形態學及分子生物學方法對篩選得到的白腐菌進行分類鑒定,為對該菌的進一步研究提供試驗基礎。
1 材料與方法
1.1 材料
1.1.1 樣品來源 遼寧省朝陽市腐朽立木、伐木樁;錦州地區楊樹、槐樹上生長的子實體,菌蓋無柄,半圓形,墊狀,新鮮時軟木栓質,干后較硬,白色至淡黃色,有細毛。
1.1.2 培養基 ①PDA綜合培養基:馬鈴薯200 g,葡萄糖20 g,KH2PO40.3 g,MgSO4·7 H2O 0.15 g,瓊脂18 g,水1 L,pH自然,用于菌種初篩;②白腐菌變色反應培養基(按徐曉峰等[3]介紹的方法略加改動):KH2PO41.0 g,NaH2PO40.2 g,MgSO4·7 H2O 0.5 g,VB10.1 mg,CaCl20.1mg,FeSO4·7 H2O 0.1 mg,ZnSO4·7 H2O 0.01 mg,CuSO4·5 H2O 0.2 mg,愈創木酚100 mg,NH4NO38.06 mg,瓊脂18 g,水1 L,pH 5.0,用于菌種復篩;③PDA培養基:馬鈴薯200 g,葡萄糖20 g,瓊脂18 g,水1 L,pH自然,用于菌種保藏。
1.2 方法
1.2.1 菌種的分離和初篩[3]從采集的樣品中切下帶菌的部位,通常切成較小的塊,將采集的樣品用無菌水反復漂洗2次,每次約1 min,然后用無菌濾紙將樣品吸干,點接到PDA平板上,每個平板2~3塊,28℃培養2~3 d,挑選出長有白色菌絲或白色茸狀的菌落平板,將其反復純化直至獲得純菌株。將初步獲得的純菌株接種在PDA平板上,約培養4 d,用0.1 mol/L愈創木酚的乙醇溶液(0.5 g愈瘡木酚溶于30 mL 95%的乙醇中)滴定菌落邊緣,當有漆酶存在時,滴定區域變成淺紅色。發生變色的菌株需進行復篩試驗。
1.2.2 菌種的復篩 采用2種培養基對其進行復篩,將初篩獲得的純菌株接種到變色反應培養基平板中,每一菌株做2個平行,28℃培養9 d,觀察分析生長在培養皿中變色圈和菌絲圈尺寸的大小和菌絲顏色變化。
1.2.3 菌株的鑒定 ①菌株形態觀察:將菌株純培養物接種于PDA培養基,28℃下導致培養,待剛長出菌絲時,將無菌的蓋玻片斜插入平板內(插片法)[4],觀察并記錄菌落特征和菌體形態特征;②菌絲培養及基因組DNA的提取:將低溫保藏的白腐菌菌種轉接到PDA斜面上,28℃培養。7 d后轉接到100 mL PDA液體培養基中,28℃100 r/min振蕩培養4 d,收集菌絲,FEN緩沖液洗滌后放入-20℃冰箱保藏備用。基因組DNA的提取在CTAB法[5]上略加改動,DNA提取物于-4℃冰箱貯藏備用;③ITS基因PCR擴增:擴增采用真菌通用引物對ITS1/ITS4(由大連寶生物合成)。具體序列為ITS1:5′-TCCGTAGGTGAACCTGCGG-3′;ITS4:5′-TCCTCCGCTTATTGATATGC-3′。PCR反應體系(25μL):10×buffer 2.5 μL,dNTP(各2.5 mmol/L)1μL,引物各1μL,Taq酶(83.35 nkat/L)0.25μL,模板DNA 1μL,ddH2O 18.25μL。PCR反應條件:95℃變性5 min;95℃變性30 s,56℃退火30 s,72℃延伸1 min,共30個循環,72℃延伸10 min。取5μL PCR產物,1.0%瓊脂糖凝膠電泳檢測。用DNA凝膠純化試劑盒回收PCR產物;④PCR產物測序及系統發育分析:純化的產物由大連寶生物公司進行正反鏈雙向測序。將測得的序列與在Gen-Bank中進行BLAST搜索到的相關序列用CLUSTAL X[6]軟件進行對位排列后再進行手工校正。系統發育樹分析采用軟件MEGA4.1中的鄰近相鄰法進行,利用bootstrap(1 000次重復)檢驗各分支的置信度。
2 結果與分析
2.1 菌種的分離篩選
2.1.1 初篩 通過初步分離獲得25株具有漆酶活性的白腐菌,活性的大小還需進行復篩。
2.1.2 復篩 漆酶活性的檢測可根據Bavendamm的方法進行,由于培養基中加入一定量的愈創木酚,含有漆酶的菌株在這特定培養基上長出的菌絲能產生明顯的桔紅色。用Bavendamm方法能判斷菌株有無漆酶,而且根據變色圈顏色深淺能大致分析出試驗菌株含有漆酶活力高低。PualAnder等[7]報道,可以用變色圈和菌絲圈的比值作為判斷菌種選擇性降解木質素的依據。對培養過程中每天變色圈和菌絲圈尺寸大小和變色圈顏色深淺變化進行分析,篩選出1株產漆酶較高的菌株,編號為4220。此菌株作為進一步研究的試驗菌株。
2.2 菌株的鑒定
2.2.1 菌株形態觀察 菌絲生長快,平板在1周內覆蓋。菌落白色,大而疏松,與培養基結合較緊密,接種點周圍菌絲較薄,可見平板反面,有較濃的蘑菇味,愈創木酚反應20 min后滴定區域變為深紅褐色,見圖1;菌絲透明,節狀分隔,纖維菌絲較多,厚壁,菌絲大量分枝,有鎖狀聯合,見圖2。

2.2.2 菌株的ITS區PCR擴增及測序 菌株4220的ITS區(含5.8S區)PCR擴增電泳結果顯示的條帶特異、效果好,見圖3。采用低熔點瓊脂糖法進行切膠純化回收并測序。菌株4220 ITS區段總長度為636 bp。
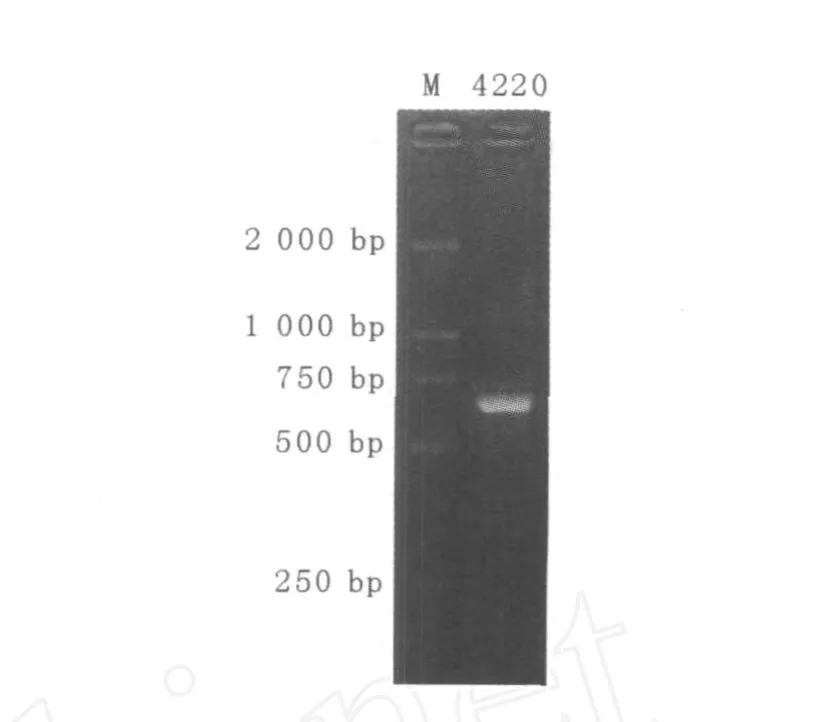
圖3 ITS-PCR擴增結果Fig.3 ITS Amplification patterns
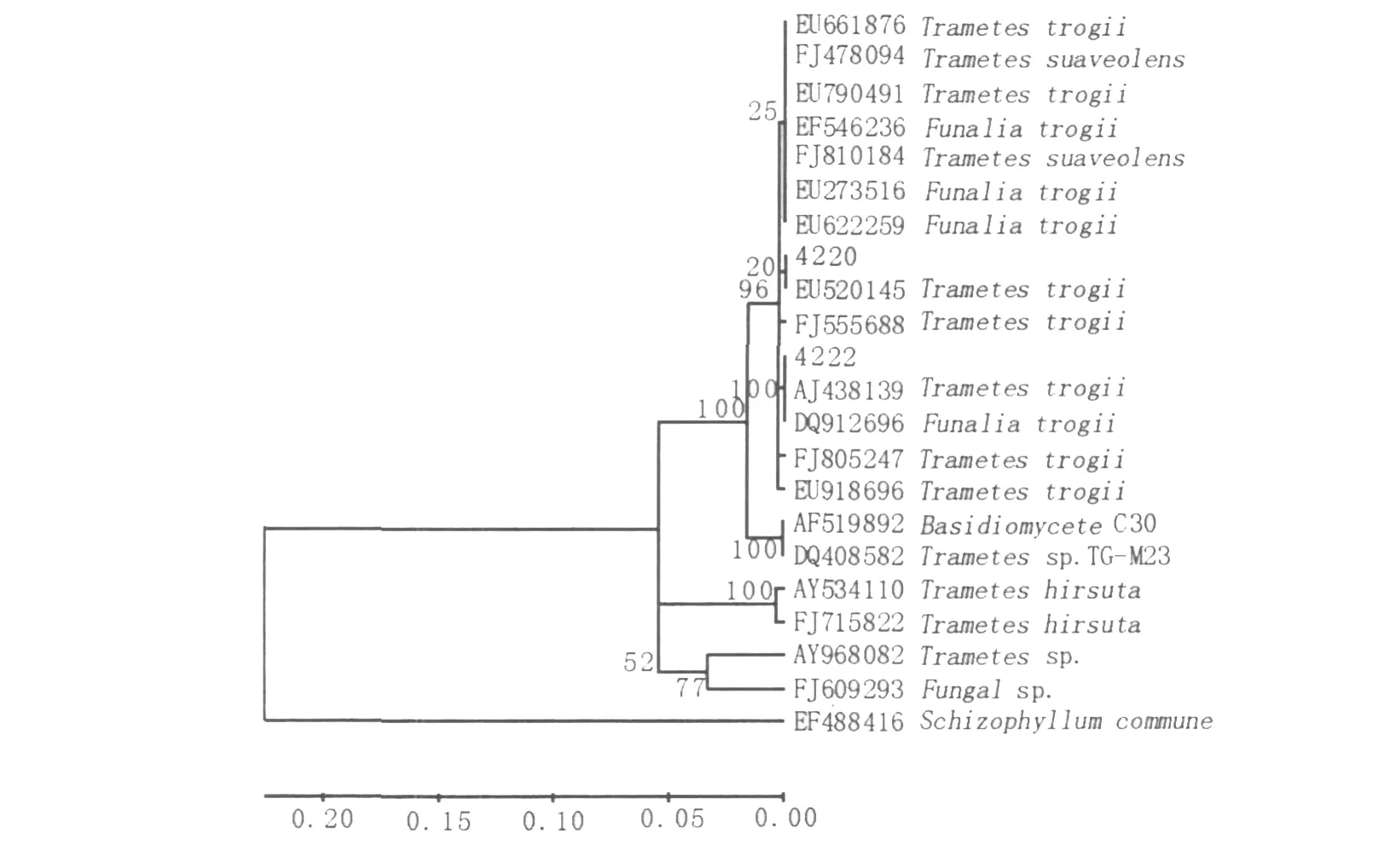
圖4 根據18S rRNA序列同源性構建的系統發育樹Fig.4 Phylogenetic tree based on 18S rRNA sequences homology
2.2.3 菌株系統發育樹的分析 GenBank中同源性較高菌株的ITS序列與本實驗所測的菌株ITS序列進行比對,利用CLUSTAL X軟件將序列匹配排列后,利用MEGA4.1軟件采用鄰近相鄰法構建系統發育樹,結果見圖4。EF488416(Schizophyllum comm une)為外類群(outgroup),樹枝上數值為bootstrap值。從系統發育樹中可以看出菌株4220與EU520145聚在同一分支,但置信度僅為20%,在上一級分支上的置信度為96%,結合菌體的形態學特征及子實體形態可以確定4220為Tram etes suaveolens。目前該菌已被Gen-Bank收錄,收錄號為GU199349。
3 討 論
本研究分離得到1株產漆酶活性較高菌株4220,經形態學特性研究和ITS序列分析,鑒定該菌株為Tram etes suaveolens。傳統的真菌分類主要是根據子實體外觀形態或微觀形態結構特征,但表型特征受環境影響較大,這就使在不同環境條件下生長的同一種真菌經常表現出較大的形態差異,給分類和鑒定帶來困難,真核生物編碼核糖體核酸的基因是一個串聯的重復轉錄單位,即18S rRNA-ITSI-5.8S rRNA-ITSII-28S rRNA,約100~200拷貝,包括編碼區和非編碼區[8],編碼區18S、5.8S、28S rDNA基因序列進化緩慢而相對保守,但這3個基因序列之間的ITS序列的進化則相當迅速,因而rDNA序列廣泛用于真菌各級水平的系統學研究。18S rDNA和28S rDNA分別約為1.8 kb和3.4 kb,序列中既有保守區又有可變區,在進化速率上比較保守,其中18S比28S基因更保守,是在系統發育中種級以上階元的良好標記。5.8S基因分子量小且高度保守,較少用于系統學研究,但它為真菌r DNA PCR擴增的通用引物的設計提供了極大方便。由于ITS區不加入成熟核糖體,所以受到的選擇壓力較小,進化速率較快,在絕大多數的真核生物中表現出了極為廣泛的序列多態性。同時ITS序列長度適中,從人類到酵母的各種真核生物中ITS的序列長度為1 000 bp到小于300 bp大小不等,人們可以從不太長的序列中獲得足夠的信息,可廣泛用于屬內種間或種內群體的系統學研究。所以rDNA ITS序列具有菌種分類鑒定的意義。
[1] 董亮,謝冰,黃民生,等.白腐真菌酶學與分子生物學研究進展[J].環境科學與技術,2005,28(5):102-104.
[2] 韓立榮,張雙璽,祝傳書,等.高效纖維素降解真菌的篩選和鑒定[J].西北農林科技大學學報:自然科學版,2008,36(9):169-174.
[3] 徐曉峰,何北海,徐麗麗,等.白腐菌的篩選及對松木片木質素和樹脂的脫除[J].華南理工大學學報:自然科學版,2007,35(4):105-111.
[4] 劉士旺.真菌形態的幾種觀察方法[J].生物學通報,1998,33(10):45.
[5] 江潔,杜連祥.基因工程菌里氏木霉染色體DNA的提取方法[J].生物技術,2004,14(2):24.
[6] 曹小迎,蔣繼宏,孫勇,等.刺革菌科4種藥用真菌的ITS區序列分析[J].中草藥,2007,38(2):261-264.
[7] PaulAnder,Eriksson K E.physiol plant,1977,41:239-248.
[8] 周國英,李河.竹材木質素選擇性降解菌株的分子鑒定[J].浙江林學院學報,2008,25(4):497-501.

