殼寡糖接枝葡萄糖產物的抗氧化性研究
林家超,王 巍,汪連生,覃彩芹
(孝感學院生物質資源化學與環境生物技術湖北省重點實驗室,湖北孝感432000)
殼寡糖接枝葡萄糖產物的抗氧化性研究
林家超,王 巍,汪連生,覃彩芹
(孝感學院生物質資源化學與環境生物技術湖北省重點實驗室,湖北孝感432000)
殼寡糖與葡萄糖反應,在p H 2.9~11.0內,堿性增加,反應加快;在40~95℃內,溫度升高,反應加快。所得接枝產物溶于水,比殼寡糖有更強的抗氧化能力。
殼寡糖;葡萄糖;接枝;抗氧化作用
甲殼素是自然界僅次于纖維素的第二大天然高分子多糖,廣泛存在于節肢動物、軟體動物、環節動物、原生動物、腔腸動物及真菌和藻類的細胞壁中。殼聚糖是甲殼素的脫乙酰基產物,市售產品主要來源于蝦蟹殼[1]。殼聚糖可溶于某些酸溶液中,但不溶于中性介質,影響其在體內的消化與吸收,使它的一些生理活性發揮受到限制。殼寡糖是殼聚糖經酶降解后得到的低分子量產物[2],具有水溶性好、易被動物體吸收的特點,有更好的增強免疫能力、調節體內酸堿平衡、抗氧化的功效[3-4]。但是,由于殼寡糖本身分子中含有氨基和還原半縮醛基,易于相互反應,致使殼寡糖在氣溫較高的空氣中易變成棕黑色[5],失去水溶性和生理活性。因而,本文采用葡萄糖與殼寡糖反應,制備殼寡糖接枝葡萄糖產物,并研究它們的抗氧化活性。
1 實驗部分
1.1 材料與儀器
殼聚糖,分子量52.5萬,脫乙酰度90.5%,浙江金殼生物化學有限公司產品;α-淀粉酶,北京奧博星生物技術責任有限公司產品;其他試劑為分析純。
1.2 樣品的測定
以凝膠滲透色譜(GPC)測定殼寡糖分子量:TSKG-5000和 TSKG-3000聯柱,RI-101示差檢測器,在 TSP P1000高效液相色譜儀上測定。標準樣品為已知分子量的 TOSOH Pulluan,流動相為0.2mol/L CH3COOH/0.1mol/L CH3COONa溶液,流速為1.0 mL/min,數據由JS-3050江申色譜工作站處理。
紅外光譜 IR:Nicolet Impact 380紅外光譜儀,KBr壓片。
1.3 殼寡糖的制備
20g殼聚糖溶解在500mL的1%(w/w)醋酸溶液,攪拌0.5h后,調節溫度為48℃,加入0.4g α-淀粉酶,持續攪拌6h,然后把溶液放入沸水中煮10 min,離心,棄去不溶物,然后濾液減壓濃縮至約150mL,調p H值為9,用無水乙醇沉淀,離心,乙醇洗滌,用五氧化二磷干燥備用。
1.4 不同條件對反應的影響
時間對反應的影響:0.2 g殼寡糖在20 mL水中溶解完全后,加入0.2 g葡萄糖,p H為6.5,于 75 ℃反應 ,在 0、1、2、3、4、5 h 分別取樣用分光光度計測定溶液在340nm處的吸光度值。
p H值對反應的影響:0.5 g殼寡糖在35m L水中溶解完全后,加入0.5 g葡萄糖,分別取4m L溶液加入8支刻度試管中,用 HCl或NaOH調節pH值,每支試管定容為5mL,于57℃反應1h,用分光光度計測定溶液在340nm處的吸光度值。
溫度對反應的影響:0.3 g殼寡糖在20mL水中溶解完全后,加入0.3 g葡萄糖,p H為6.5,分成6份,于不同溫度下反應1h,用分光光度計測定溶液在340 nm處的吸光度值。
1.5 接枝產物的制備
分別稱取 2份3.0 g殼寡糖,各自溶解于30m L水中,分別加入1.5g和3.0g葡萄糖,調節p H值為9,60℃攪拌5h后,減壓濃縮,用無水乙醇沉淀,洗滌,用五氧化二磷干燥,得到接枝產物COS-G1和COS-G2。
1.6 抗氧化性
用緩沖溶液配制濃度分別為3×10-2、18×10-5、225×10-5mol/L的蛋氨酸、核黃素、氯化硝基四氮唑蘭溶液,依次各取以上溶液0.5m L于反應管中,并向反應管中分別加入0.5mL殼寡糖和接枝產物水溶液(濃度為0.5,1.0,2.0,4.0 mg/mL),再加1m L蒸餾水,混合均勻后,將反應管在恒定光強日光燈下照射30min,用分光光度計在560nm處測定各樣品的吸光度,各樣品重復測定3次。清除率的計算式可表示為:清除率 =[(A0-A)/A0]×100%。
2 結果與討論
2.1 殼寡糖的分子量
圖1所示為殼聚糖原料和降解后的殼寡糖產物的 GPC圖。與殼聚糖原料峰相比,殼寡糖峰向著洗脫體積增大的方向移動。所測殼寡糖樣品平均分子量為1582。

圖1 殼聚糖原料CS和殼寡糖COS的 GPC
2.2 反應條件的影響
隨著反應時間的延長,溶液顏色加深,吸光度值增加。從表1可以看出,吸光度1h內增加較大,1h至5h吸光度值增加緩慢。說明在1h內反應已基本完成,殼寡糖中的氨基與葡萄糖中的醛基容易反應。

表1 不同時間的反應液的吸光度值
從表2可以看出,吸光度值隨著p H值的增加而增加,說明反應在堿性條件下進行時,有利于氨基進攻醛基。

表2 不同p H值的反應液的吸光度值
從表3可以看出,隨著反應溫度的升高,反應液的吸光度值增大,說明隨著溫度的升高,反應速度加快。
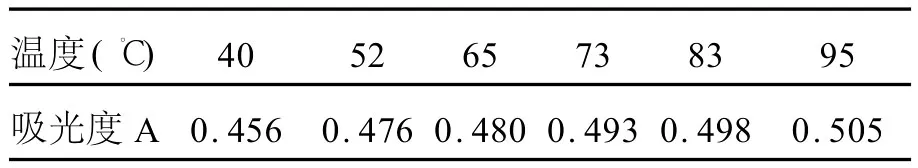
表3 不同溫度下的反應液的吸光度值
2.3 接枝產物的紅外光譜圖
圖2為殼寡糖和接枝產物的紅外光譜圖。殼寡糖在1634和1561 cm-1處的峰分別為殼寡糖中酰胺I和酰胺 II的譜帶。參照酰胺 II譜帶,接枝產物在1640 cm-1處的峰明顯增強,為酰胺 I譜帶和新生成C=N對稱伸縮振動峰的疊加峰[6]。
2.4 美拉德反應的產物對超氧陰離子自由基的清除

圖2 殼寡糖COS和接枝產物COS-G2的紅外光譜
用光照核黃素的方法產生O2-·,可以使氯化硝基四氮唑蘭產生藍色物質,該物質在560 nm處有最大吸收峰。隨著反應的進行,藍色物質的生成就越多,加入殼寡糖可使O2-·的量降低,進而藍色物質的生成減少,因此,測定該波長下的吸光度值的變化,可反映殼寡糖和接枝產物對O2-·的清除能力。

圖3 殼寡糖與葡萄糖接枝產物對光照核黃素產生超氧陰離子自由基的清除作用
由圖3可見,殼寡糖和接枝產物清除超氧陰離子的能力隨濃度的增加而增強,同一濃度時,COS-G2的清除率大于COS-G1,兩者都大于COS,說明殼寡糖與葡萄糖接枝后的產物具有更好的抗氧化性。
[1] Kumar M N V R,M uzzarelli R A A,Muzzarelli C,et al.Chitosan chemistry and pharmaceutical perspectives[J].Chemical Review s,2004,104:6017-6084.
[2] Kim S K,Rajapakse N.Enzymatic production and biological activities of chitosan oligosaccharides(COS):A review[J].Carbohydrate Polymers,2005,62:357-368.
[3] Yen M T,Yang J H,Mau J L.Antioxidant properties of chitosan from crab shells[J].Carbohydrate Polymers,2008,74:840-844.
[4] Tomida H,Fujii T,Furutani N,et al.Antioxidant properties of some different molecular weight chitosans[J].Carbohydrate Research,2009,344:1690-1696.
[5] Zeng L T,Qin C Q,ChiW L,et al.Brow ning of chitooligomers and their optimump reservation[J].Carbohydrate Polymers,2007,67:551-558.
[6] 應國清,盧霞,易喻.殼聚糖吸附劑的制備及性能[J].化工進展,2007,26(2):230-233.
Preparation and An tioxidation of Glucose-grafted Chitooligomers
Lin Jiachao,Wang Wei,Wang Liansheng,Qin Caiqin
(H ubei Key Laboratory of Biomass-Resource Chem istry and Environmental Biotechnology,Xiaogan University,Xiaogan,Hubei 432000,China)
Chitooligomers reacted with glucose.The reaction rate increased with the increased pH in the range of p H 2.9~11.0.The reaction rate increased with the increased temperature in the range of 40~95℃.The obtained products were soluble in water,and had stronger antioxidation than the chitooligomers.
chitooligomers;glucose;graft;antioxidation
O636.11
A
1671-2544(2010)03-0005-03
2010-03-30
湖北省教育廳科學研究重大項目(Z200626001)
林家超(1985— ),男,湖北武漢人,孝感學院化學與材料科學學院2008屆本科畢業生。
覃彩芹(1965— ),男,湖北赤壁人,孝感學院化學與材料科學學院教授,博士。
(責任編輯:鄒禮平)

