肝動脈閉塞后通過側枝血管行經導管動脈化療栓塞的療效研究
方主亭 顏志平 吳林霖 羅劍鈞 張雯 王建華
原發性肝癌(hepatocellu lar carcinom a,HCC)是我國常見的惡性腫瘤,其治療方法較多,療效不一。目前公認對于不能手術的HCC患者則以經肝動脈灌注化療栓塞術(tran scath eter arterial chem oem bolization,TACE)治療作為首選,并逐漸成為非手術治療中最有效、最成熟的一種方法。及時、準確評價TACE療效并行鞏固治療是臨床取得滿意療效的重要保障[1]。而肝癌TACE術后肝動脈閉塞常常無法再次行常規TACE,而影響其療效。故研究肝癌TACE術后肝動脈閉塞的形成機制,并掌握通過側枝供血動脈進行插管的必要性及技巧,對提高肝癌動脈化學藥物栓塞(TACE)的總體療效具有十分重要的意義。我們對我院2009~2010年原發性肝癌多次TACE(>2次)術后肝動脈閉塞,通過側枝供血的38例肝癌患者臨床特征及其介入治療進行了分析,結果如下。
1 資料與方法
1.1 臨床資料 我院介入科2009年08月~2010年05月共為原發性肝癌患者行TACE治療3000余例。共發現TACE術后肝動脈閉塞38例,其中男31例,女7例。巨塊型12例,彌漫型26例。年齡35~76歲,平均年齡53歲。
1.2 方法 術前常規行肝臟增強CT了解病灶的位置、大小、數目大小及可能的供血動脈。TACE前常規行腹腔干/肝總動脈及腸系膜上動脈造影;對部分腹腔動脈變異的先行腹主動脈造影;發現肝動脈閉塞后,癌灶靠近膈頂部的加行膈動脈或胸廓內動脈造影;病灶靠近右肝下緣加行右腎上腺動脈造影;部分腫瘤血管仍不明確的,加行腰動脈造影。明確腫瘤病灶供血動脈后,導管超選擇性插入腫瘤供血動脈,分別注入化學藥物、超液化碘油和/或其他栓塞劑(PVA、微球或明膠海綿等)進行化學藥物栓塞。
2 結果
2.1 肝動脈閉塞后側枝供血動脈的來源 38例患者均為多次(>2次)TACE術后。15例3次,10例4次,8例5次,4例4次,1例7次。DSA造影發現肝動脈閉塞,均通過肝外側枝血管供血,共發現43條肝外側支供血動脈。部分患者合并多條肝外側枝血管。側枝供血動脈來源包括:腸系膜上動脈(SM A)分支15例(34.9%),胃左動脈分支13例(30.2%),胃十二指腸動脈(GDA)側支7例(16.3%),胸廓內動脈2例(4.7%),胰十二指腸動脈(PDA)弓側支2例(4.7%),右膈下動脈1例(2.3%),右腰動脈1例(2.3%),右腎上腺動脈1例(2.3%),右結腸動脈1例(2.3%)。本組肝外側枝血管來源見表1。
2.2 肝外側枝供血動脈的超選擇性插管情況及療效比較本組各類肝外側枝供血動脈超選擇性插管的成功率見表1。成功超選進入靶血管31條(72.1%),未成功超選為12條(27.9%)。對于導管能夠超選進入腫瘤病灶側枝供血動脈分別注入化學藥物、超液化碘油和/或其他栓塞劑(PVA、微球或明膠海綿等)進行化學藥物栓塞(TACE)。對不能成功超選的腫瘤側枝供血動脈則采取近端主干動脈單純化學藥物灌注(TA I)、必要時加行胃十二指腸動脈明膠海綿顆粒堵塞。2個月后評價其療效。以后視病情需要聯合無水酒精注射、微波固化、射頻消融、組織間I125放射性粒子植入等介入方法進行治療。成功超選進入全部靶血管并進行腫瘤供血動脈末梢和腫瘤血管床栓塞(TACE)共27例(71.1%),完全緩解(CR)0例(0%),部分緩解(PR)7例(25.9%),無變化(SD)14例(51.9%),進展(PD)6例(22.2%)。總有效率為25.9%(7/27),臨床獲益率為77.8%(21/27)。未能成功超選靶血管11例(28.9%),僅行動脈化療灌注(TA I)。完全緩解(CR)0例(0%),部分緩解(PR)1例(9.1%),無變化(SD)3例(27.3%),進展(PD)7例7(63.6%)。總有效率為9.1%(1/11),臨床獲益率為36.4%(4/11)。療效比較見表2
3 討論
3.1 肝癌肝動脈供血的分類 根據文獻[2-3]結合分析本組資料,肝癌肝外動脈供血可分為癌灶寄生性供血、肝外側支循環及肝切緣網膜組織供血3類。本組資料我們主要談論肝外側枝循環。它主要是指肝動脈化學藥物栓塞后肝動脈主干發生閉塞所致的肝外側枝動脈供血(圖1)。
3.2 TACE術后肝動脈閉塞的原因及肝外側枝供血動脈供血的形成規律 早有學者[4]提出介入治療中并發血管狹窄、閉塞的原因主要有:①反復插管致血管內膜摩擦損傷;②導管阻斷血流時間較長使血管內膜缺氧損傷;③高濃度對比劑、化療藥物刺激血管內膜損傷;④操作不當,導致血管內膜機械性損傷或內膜下夾層形成。本組資料均為多次TACE(>2次),由于多次插管對供血動脈的損傷、化療藥物及栓塞物質對供血動脈血管壁的影響,均可造成供血動脈狹窄甚至閉塞,肝臟腫瘤供血逐漸從肝動脈轉變成肝外側枝供血。日本學者M iyayama S等[5]通過觀察26例肝癌患者多次TACE后肝癌血供變化情況也證實上述觀點。本組有多例病例為植入碘125粒子條術后,碘125放射性粒子是否會引起肝動脈閉塞尚需進一步研究加以證實(圖2)。

供血動脈來源 例數 成功例數 成功率%腸系膜上動脈(SMA) 15 9 60胃左動脈 13 11 84.6胃十二指腸動脈(GDA) 7 5 71.4胰十二指腸動脈(PDA)弓 2 1 50右膈下動脈 1 1 100右腰動脈 1 1 100右腎上腺動脈 1 1 100右結腸動脈 1 0 0胸廓內動脈 2 2 100合計 43 31 72.1
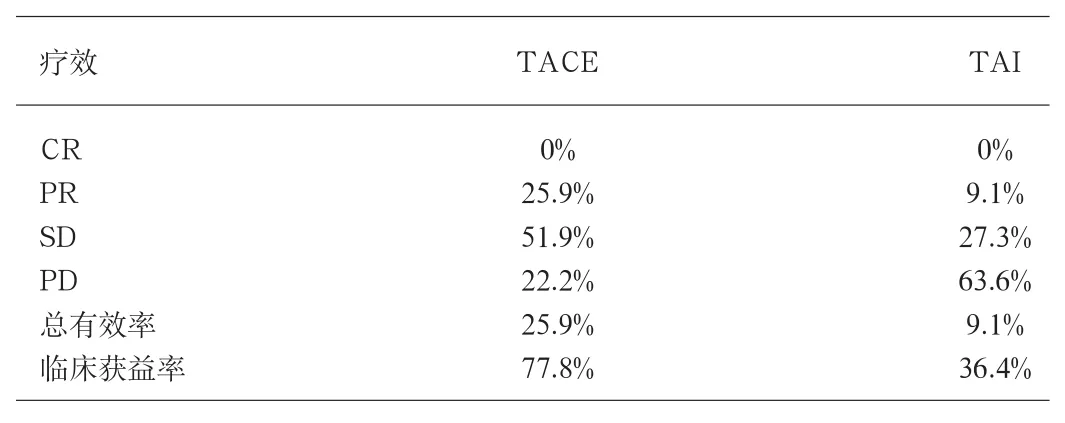
表1 本組38例患者肝外側枝血管來源及超選成功率
由于肝臟供血特點,正常肝臟存在多支潛在供血側支,一旦肝動脈明顯狹窄或閉塞,側支供血動脈可迅速開放。Tak eu ch i等[5]的研究發現23例肝腫瘤患者中采用球囊暫時閉塞正常肝動脈,觀察肝外動脈供血的變化,結果85%的右膈下動脈、83%的左膈下動脈、50%的腸系膜上動脈、20%的腹腔動脈和17%的胃左動脈向肝血流量立即增加。經分析本組38例肝癌肝外動脈供血特征可以發現,肝癌發生肝外動脈供血的基本規律為就近原則,即癌灶就近從周邊組織臟器獲取血液供應。根據CT檢查對腫瘤的部位和范圍對側枝血管來源進行判斷:Ⅱ、Ⅲ、Ⅳ段肝癌,多考慮胃左動脈或左膈動脈供血;Ⅶ、Ⅷ段肝癌多考慮右膈動脈或右胸廓內動脈供血;Ⅴ、Ⅵ段肝癌多考慮或腸系膜上分支供血;Ⅵ、Ⅶ段肝癌多考慮右腎上腺動脈供血。另肝外側枝動脈之間也可以形成異常溝通[6]。同樣左右肝動脈之間也有潛在交通支[7]。
3.3 肝動脈閉塞后肝癌的介入治療的技巧及注意事項 對伴有肝外側枝供血動脈供血的肝癌,單純經側枝供血動脈途徑進行化學藥物灌注顯然是不夠的,從本組病例療效(見表2)可得出以上結論。
①TACE前常規腹腔動脈和腸系膜上動脈造影是發現肝癌肝外側枝供血動脈的重要途徑。②對癌灶染色不全,碘油偏中心沉積者應根據肝外動脈供血的發生機制及規律積極尋找其他肝外側枝供血動脈。本組有5例存在多支肝外側枝血管供血。③對不同的肝外側枝供血動脈應視具體情況選用相應導管進行超選擇性插管。我們的經驗膈下動脈、胃十二指腸動脈、腸系膜上動脈、腰動脈多選擇RH導管,而胃左動脈、右腎上腺動脈等多選用R LG導管,再配合超滑Terum o導絲進行超選。根據血管彎曲度、粗細及病灶供血情況必要時再配合微導管進行進一步超選。對于胰十二指腸動脈弓及結腸右動脈等分支供血常迂回扭曲或呈網絡狀,且角度常呈銳角,若想進一步深入超選,導管甚至微導管將會彈出,且有可能損傷血管,而引起其閉塞,更加大了治療難度。我們常選用RH導管等,內旋利用其頭端自然彎曲鉤住胰十二指腸下動脈或結腸右動脈開口,在X線嚴密監視下緩慢注入碘油及化療藥物混合乳劑進行化學栓塞。如果發現碘油返流,則改用單純化療藥物灌注。對于胸廓內動脈供血的,常規Cob ra及單彎導管配合Terum o導絲成型多不易超選進入胸廓內動脈,對于此種情況,我們常將豬尾巴導管前端減去一部分,使其前端呈半圓狀,然后將改良后的豬尾巴導管送至胸廓內動脈開口遠端,逐漸后退導管,當導管頭端到達胸廓內動脈開口時即可自行彈入,再送入超滑導絲,將豬尾巴導管適當送入或更換Cob ra及單彎導管,多不需使用微導管。④對過于纖細、扭曲或叢狀分布的肝外側枝供血動脈,可采用近端主干動脈單純化學藥物灌注、胃十二指腸動脈明膠海綿堵塞及術后聯合無水酒精注射、微波固化、射頻消融或I125粒子植入術等非血管性介入方法進行協同治療[8]。⑤防止TACE后較大肝動脈閉塞對減少肝外動脈供血至關重要,導管種類、超滑導絲及微導管的使用、導管超選的位置、手術操作力度及速度的把握及栓塞劑的使用不當將會增加肝動脈閉塞發生率。對于多次TACE治療側支循環建立的病例,部分側支多且細小,導管難以進入,只能進行TA I,難以進行栓塞治療,影響療效。本組38例肝外側枝動脈供血由均由多次TACE后肝動脈閉塞引起,雖然仔細觀察本組資料發現肝動脈閉塞對肝功能無明顯影響,但明顯加大了TACE治療的難度,且增加了操作者及患者的曝光時間,部分患者未能成功超選腫瘤側枝供血動脈,未能對腫瘤供血動脈和腫瘤血管床進行栓塞,無疑降低了療效,縮短了其生存時間。
綜上所述,原發性肝癌多次行TACE術后可造成肝動脈閉塞,我們必須盡量減少其發生率。超選肝外側枝腫瘤供血動脈可再次行TACE,療效較TA I顯著。臨床工作中應掌握側枝動脈之間有可能潛在的溝通,盡量使用各種方法超選進入靶血管并進行腫瘤供血動脈和腫瘤血管床栓塞以提高患者的療效。
[1]Lim HS,Jeong YY,Kang HK,et al.Imaging features of hepatocelular carcinoma after transcatheter arterial chernoembolization and radiofrequency ablation[J].AJR,2006,187:W341-W349.
[2]Skezas NN,Spigos DG,Dunne PM,et al.Parasi t izat ion by hepatocel lular carcinoma of branches of the superior mesenteric artery[J]. AJR,1991,157(6):1357-1358.
[3]田建明,王飛,葉華,等.肝癌的動脈供血分類研究:規則性、變異性和寄生性供血[J].臨床放射學雜志,1997,16(1):40-43.
[4]董永華,林貴.肝癌介入治療致靶血管損害的長期隨訪[J].臨床醫學影像雜志,1993,4(2):81-83.
[5]Miyayama S,Yamashiro M,Okuda M,et al.The March of Extrahepatic Collaterals:Analysis of Blood Supply to Hepatocel lular Carcinoma Located in the Bare Area of the Liver Af ter Chemoembolization[J].Cardiovascular and interventional radiology,2010,33(3):513-522.
[5]Takeuchi Y,Arai Y,Inaba Y,et al.Extrahepatic arteria1 supply to the 1iver:observation with a unified CT and angiography system during temporary ba1loon occlusion of the proper hepatic artery[J].Radiology,1998,209(8):121-128.
[6]Miyayama S,Yamashiro M,Okuda M,et al.Anastomosis between the hepatic artery and the extrahepatic col lateral or between extrahepatic collaterals:Observation on angiography[J].Journal of medical imaging and radiation oncology,2009,53(3):271-282.
[7]Tohma T,Cho A,Okazumi S,Makino H,et al.Communicating arcade between the right and left hepatic arteries:Evaluation with CT and angiography during temporary bal loon occlusion of the right or left hepatic artery[J]. Radiology,2005,237(1):361-365.
[8]楊業發,程紅巖,徐愛民,等.肝癌肝外動脈供血的形成機制與介入治療的研究[J].中華普通外科雜志,2004,19(7):411-413.

