抽動-穢語綜合征動物模型的建立和評價
杜淑娟,彭貝如,程樹軍,陳秀梅
(1.廣東省中醫院,廣州 510120;2.廣東出入境檢驗檢疫局技術中心,廣州 510620)
抽動-穢語綜合征(tourette syndrome,TS),又稱多發性抽動癥,是一種兒童期起病的慢性神經精神障礙性疾病。臨床表現主要為突然、快速、反復、非節律性、不自主和刻板的運動性抽動和發聲性抽動。還可能伴有各種行為紊亂、強迫觀念與行為、認知障礙等,可不同程度的干擾和損害兒童的認知功能,影響社會適應能力。本病病因尚未明確,具有明顯的遺傳傾向。本病多見于4~12歲的兒童,患病率約為0.05%~3%,近年來發病呈明顯上升趨勢[1]。
近年來研究提示TS是一種兒童神經精神障礙的概念,其病因可能是由于遺傳、神經自身免疫和感染、環境作用等多種復雜因素在發育過程中相互作用的結果。目前醫學界對TS的病因和發病機理還不完全清楚,其中最重要的原因是動物模型的開發和應用不能滿足基礎與臨床研究的需要[2]。本實驗應用亞氨基二丙腈腹腔注射建立的抽動-穢語綜合征模型大鼠,研究模型大鼠行為學、海馬神經元、腦組織多巴胺含量等指標,為本病的基礎和臨床研究提供實驗動物模型支撐。
1 材料和方法
1.1 材料
1.1.1 實驗動物:SPF級SD大鼠60只,28~30d齡,體重250±10g,雌雄各半(廣東省醫學實驗動物中心,粵監證字2008D006,批號:0037766)。
1.1.2 實驗藥品:亞氨基二丙腈(IDPN),購自Alfa Aesar公司(批號:C7323A),將IDPN溶解于生理鹽水,配制濃度為100mg/mL的稀釋液避光保存備用。
1.1.3 儀器與試劑:LC26A型高效液相色譜儀、SPD26AV熒光檢測器、C2R4A數據處理機均為日本島津產品。脫水機、包埋機、切片機和生物顯微鏡等病理設備為德國Leica產品。微量組織勻漿器為Millipore公司產品。高氯酸、EDTANa2、SDS、H2SO4均為分析純,甲醇為色譜純。對照品由中國藥品生物制品所提供。
1.2 方法
1.2.1 動物模型制作:參考Wakata[3]的方法,給藥前對每只動物行為評分,將SD大鼠隨機分成2組,對照組和造模組各20只,每組均雌雄各半。造模組腹腔注射IDPN,每天150mg/Kg體重,對照組注射生理鹽水。每天1次,連續7d。
1.2.2 大鼠行為觀察:參考采用觀察評分,每日一次,每次至少觀察1h,主要誘發癥狀分為運動行為和刻板運動兩類。(1)運動行為評分,0分:安靜或正常活動;1分:過度興奮;2分:探究行為增加,不連續的吸鼻聲;3分:不停跑動;4分:不停跑動伴有驚跳;(2)刻板運動(或定型運動)評分,0分:無刻板運動;1分:軀體旋轉行為(順時針或逆時針的旋轉運動);2分:頭和頸部的上下運動過多(頭頸部與地面垂直方向的一種異常運動);3分:頭、頸部的上下運動過多加旋轉行為;4分:頭向側擺,合并頭和頸部的上下運動過多。
1.2.3 神經遞質分析:第14天將所有實驗大鼠迅速斷頭處死,取右腦海馬組織及邊緣系統(包括紋狀體、隔核、層殼核、基底節、齒狀回),精確稱重,置入1mL處理液(含0.1mol高氯酸和0.05%EDTANa2)中,微量組織勻漿器冰溶下勻漿,4℃冰凍離心10000r/min,取上清液置入-20℃保存,參考劉師蓮等[4]的方法采用液相色譜法測定多巴胺(DA)和去甲腎上腺素(NE)濃度。測樣時,室溫下解凍,進樣20μL,以峰面積外標法定量。
1.2.4 組織學觀察:留取左側腦組織,剝離海馬及周邊組織,用4%多聚甲醛的0.1mol/L PBS溶液固定,常規石蠟包埋,連續冠狀切片,厚度5μm,分別做HE和TH染色。光學顯微鏡下觀察海馬細胞形態變化。每只大鼠取6張連續冠狀切片,分別計數左側海馬各區神經元數。
1.2.5 數據統計:選用軟件SPSS13.0和SAS9.1.3版本進行統計學處理和分析。采用均數±標準差進行統計描述,進行模型組與對照組行為學評分、神經遞質分析和組織病理學觀察。
2 結果
2.1 行為學觀察和評分
亞氨基二丙腈注射液腹腔注射7d后,無動物死亡或出現嚴重體重下降、精神萎靡等癥狀。注射3d時,造模組部分動物出現過度興奮、探究行為增加(運動行為評分2.1±0.3),頭和頸部出現大量舞蹈樣運動,夾雜頭部快速抽動樣的驚跳,軀體旋轉行為和頭頸部的上下運動明顯增多(刻板運動評分2.3±0.4),攝食量開始下降;造模7d時全部動物出現不同程度的異常跑動和驚跳(評分4.0±0.1),頭頸部頻繁地不自主上下運動和旋轉(評分3.9±0.3),且持續時間較長;停藥后至14d時,上述癥狀仍維持穩定。對照組未見類似行為變化,提示造模成功且穩定。
2.2 腦組織DA、NE含量
造模14d時,大腦海馬及周邊區域兩種神經遞質檢測結果,造模組DA和NE含量分別為(60.7±20.4)μg/g和(74.8±23.9)μg/g,空白組DA和NE含量為(188.4±59.2)μg/g和(46.8±17.3)μg/g,兩種遞質統計學差異極顯著,提示模型大鼠腦組織存在低多巴胺及高去甲腎上腺素狀態。
2.3 組織學觀察
組織學觀察結果顯示,對照組海馬CA2區錐體細胞呈多角形排列緊密整齊,樹突明顯,未見炎癥細胞浸潤和神經元空泡變性和壞死,門區錐體細胞排列不規則,齒狀回顆粒細胞呈圓形緊密排列,細胞充盈,細胞核居中,染色均勻,形態清晰,樹突的棘清晰可見。模型組海馬CA2區錐體細胞排列紊亂,數量減少,部分細胞出現空泡變性,大量細胞出現核固縮壞死,門區錐體細胞排列紊亂,大量神經元細胞腫脹、核固縮壞死,由典型的多角形變為三角形或不規則形,周邊膠質細胞浸潤,頂樹突明顯減少,排列混亂;齒狀回神經元壞死,大部分顆粒細胞濃縮、深染,細胞數量明顯減少,排列疏松(圖1,彩插6)。空白組海馬酪氨酸羥化酶免疫反應陽性神經元成群分布,模型組胞漿內陽性反應顆粒明顯減少,有的神經元陽性顆粒完全喪失。
2.4 海馬神經元細胞計數
造模組與空白組相比,海馬各區及齒狀回神經元數量顯著下降(P<0.05),提示造模導致神經元數量明顯減少(表1)。
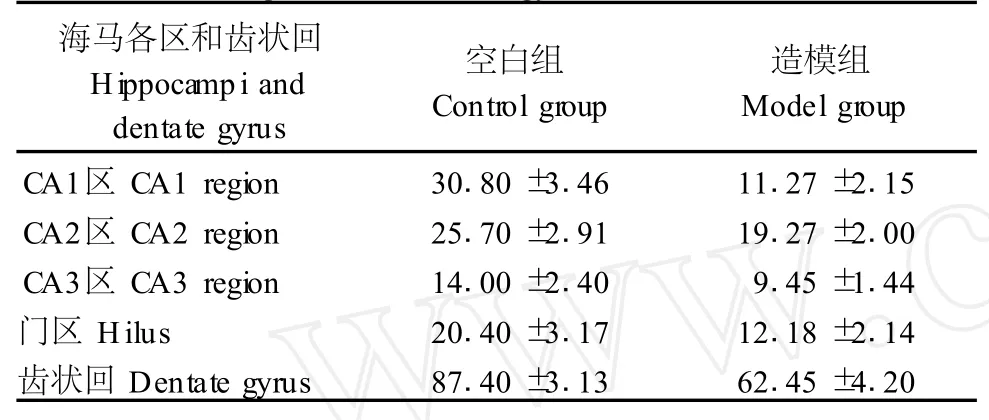
表1 海馬各區及齒狀回神經元細胞計數(/250μm2)Tab.1 Neuron counter of hippocampi region and dentate gyrus(/250μm2)
3 討論
3.1 行為學特征
動物表現出的癥狀很難完全等同于人類TS的綜合表現,因此需要準確地界定動物的行為與TS的精神運動癥狀的相同性。本文按照TS的診斷標準將行為異常分為兩類4級進行評分[5],定量判定造模型過程中行為異常的變化情況,從中篩選出與人類抽動類似的行為特征。結果表明,IDPN誘發TS模型大鼠出現明顯刻板運動和運動行為異常,如過度興奮、探究行為、異常跑跳、旋轉行為、頭頸部上下側擺等動作均具有特征性,有時出現的連續的嗤鼻、抬舉上肢等動作,類似于人類TS患兒喉部發聲、聳肩等特征動作,而且停止給藥后行為癥狀仍持續維持。表明在行為學上該動物模型很大程度上模擬了TS的客觀行為特征。
3.2 神經生物學特征
雖然目前對TS的神經生物學物質基礎還未完全闡明,但基本認為中樞神經遞質,特別是DA、NE、5-HT等與TS之間關系密切[6,7],因此,探討大腦多巴胺類神經遞質及其代謝產物的水平既是了解TS發病機制和發病部位的關鍵因素,也是證明模型可靠性的重要指標。本模型通過大腦海馬區DA和NE的測定結果表明,造模型后DA明顯下降,而NE水平有所升高,這與Wakata等檢測到IDPN造模后腦區DA下降的結果類似[3]。神經生物學特征的模擬為下一步探討造模型過程中此類遞質的動態變化奠定了基礎。
3.3 組織形態特征
通過實驗大鼠的腦組織病理切片和免疫組化觀察,發現大腦海馬區神經元結構及數目出現明顯病理性改變。TS主要累及海馬及周邊核團(尾殼核、隔核、紋狀體)神經元的功能[8]。本試驗從組織學層面表明了IDPN誘發的動物模型具有退行性神經組織病變的特征。選擇剛成年大鼠則可以提高模型易感性和接近兒童患病的實際情況。
迄今為止,還沒有一種動物模型能完全復制人類多發性抽動癥的所有癥狀和特征,本文以IDPN腹腔注射誘發大鼠建立抽動-穢語綜合征模型,初步表明具備與本病相關的神經生物學、行為學和病理學特征,為以后開展基礎研究和包括中藥在內的藥物治療研究提供支撐。
[1]Freeman RD,Fast DK,Burd L,et a1.An international perspective on Tourette syndrome:selected findings from 3500 individuals in 22 countries[J].DevMed Child Neurol,2000,42(7):436-447.
[2]Swerdlow NR,Sutherland AN.Using animal models to develop therapeutics for tourette syndrome[J].Pharmacol Ther,2005,108(3):281-293.
[3]Wakata N,Araki Y,Sugimoto H,et al.IDPN-induced monoamine and hydroxyl radical changes in the rat[J].Brain Neurochem Res,2000,25(3):401-404.
[4]劉師蓮,張兆蓮,劉賢錫,等.大鼠腦組織單胺類遞質及其代謝產物的檢測方法研究[J].山東大學學報(醫學版),2002,40(5):472-475.
[5]劉智勝.小兒多發性抽動癥[M].北京:人民衛生出版社,2002:237-238.
[6]Nobuatsu N.Inhibitory effect of free radical scavenger,MCI-186,in the increase of hydroxyl radical induced by iminodipropionitrile in rats[J].J Neurol Sci,2004,219:41-44.
[7]Wong DF,Brasic JR,Singer HS,et al.Mechanisms of dopaminergic and serotonergic neurotransmission in Tourette syndrome:clues from an in vivo neurochemistry study with PET[J].Neuropsychopharmacology,2008,33(6):1239-1251.
[8]Mink JW.Basal ganglia dysfunction in Tourette’s syndrome:A new hypothesis[J].PediatrNeurol,2001,25:190-198.

