隴東野生紫花苜蓿的同工酶分析
陳立強,師尚禮,滿元榮
(甘肅農業大學草業學院,草業生態系統教育部重點實驗室,中美草地畜牧業可持續發展研究中心,甘肅蘭州 730070)
紫花苜蓿(Medicago sativa)別名紫苜蓿、苜蓿,起源于小亞細亞、伊朗、外高加索和土庫曼一帶[1]。紫花苜蓿抗逆性強、分布廣、栽培面積大、產量高、品質好、利用方式多、適口性好、經濟價值高,具有其他豆科牧草所不能比擬的優點[2]。隴東野生紫花苜蓿分布于甘肅清水半陰濕地區,與栽培紫花苜蓿相比,具有根莖,抗旱、抗寒、抗踐踏且分枝能力強的優點,因此,具有潛在的飼用栽培和良好種質資源價值[3,4]。
同工酶是基因表達的產物,反應了植物生長發育過程中基因的啟動與表達,系統進化中基因的突變與重組,可通過酶譜分析直接判斷基因的存在及表達,從而在蛋白質水平上揭示物種的遺傳基礎[5,6]。利用同工酶分析技術,從分子水平、遺傳背景方面來尋找植物種類間的親緣關系,能彌補形態分類的不足[5,8]。20世紀70年代以來,同工酶技術在草業科學領域中應用于物種、變種和品種的區分鑒定取得了不少成績[9]。近年來,同工酶分析法已廣泛應用于苜蓿材料親緣關系、抗逆性、品種鑒定和分類上[10]。
通過對隴東野生紫花苜蓿與其他37個國內外紫花苜蓿材料的過氧化物酶、過氧化氫酶和酯酶分析,探討了隴東野生紫花苜蓿與其他紫花苜蓿材料間的親緣關系,以期為隴東野生紫花苜蓿種質鑒定、分類、育種以及資源的有效利用提供理論依據。
1 材料和方法
1.1 供試材料
試驗材料為隴東野生紫花苜蓿和其他37個紫花苜蓿品種(表1)。
1.2 方法
1.2.1 酶液提取 過氧化物酶(POD,EC1.11.1.7)用種子提取,每份材料隨機選取0.5 g種子;過氧化氫酶(CAT ,EC1.11.1.6)和酯酶(EST ,EC 3.2.1.1)用幼苗的根提取,種子在培養箱內發芽培養,光照9 h,黑暗15 h,溫度27 ℃,至真葉期,每份材料隨機剪取根0.5 g,然后將種子或根置于預冷的研缽中,研磨過程中陸續加入2 mL預冷的0.1 mol/L T ric-HCl緩沖液(pH 8.0)。研磨后迅速倒入 2 mL離心管中,以5 000r/min離心5 min,取上清液灌入離心管中,加入等體積40%的蔗糖溶液混勻,-80℃保存以備點樣[11],所有試驗過程都在相同條件下進行。

表1 參試紫花苜蓿品種及其來源Table 1 Varieties and origin of alfalfa for test
1.2.2 電泳及染色 采用聚丙烯酰胺凝膠垂直板電泳法,分離膠為7%的1 mol/L T ris-HCl(pH 8.8),濃縮膠為4%的 1 mol/L Tris-HCl(pH 6.8);電極緩沖液為Tris-甘氨酸緩沖液,pH 8.0;前沿指示劑為2%的溴酚蘭溶液;進樣量10 μ L;先于 100 V 電壓下電泳至樣品進入分離膠,再用200 V電壓繼續電泳,待溴酚蘭移至分離膠底部(約4 h),停止電泳,剝膠染色,同工酶染色參照文獻[12]的方法進行。
1.2.3 數據處理 根據各酶帶的遷移距離計算其相對遷移率(R f),Rf=X2/X1,X1為指示劑的遷移距離,X2為凝膠中酶帶的遷移距離[13]。根據所統計酶譜帶的有無,把有帶計為1,無帶計為0[14],組成0,1二元矩陣,用NTSYSpc 2.1軟件的SAHN程序和UPGMA方法計算材料間的相似系數并進行聚類分析和主成分分析。
2 結果與分析
2.1 同工酶酶帶分布特征
同工酶往往由該酶的單個基因位點的多個等位基因或多個位點的等位基因控制,同工酶酶譜能表現出若干條酶帶。結果表明,38個供試紫花苜蓿材料的過氧化物酶顯示出了10條酶帶,其R f值介于0.20~0.75(表 2),其中 Rf 為0.20,0.25,0.30 ,0.49和 0.53的5條帶為供試材料的共有帶,Rf為 0.39,0.65,0.70,0.73和0.75的5條帶為多態性帶,R f為0.39的酶帶僅出現在隴東野生、隴東、飛馬和賽特4個紫花苜蓿材料的酶譜中。供試材料的過氧化氫酶共表現出了7條酶帶,且都為多態性帶,其R f值介于0.09~0.67(表2),R f為0.09,0.19和0.30的3條帶僅在隴東野生紫花苜蓿酶譜中缺失,而R f為0.15,0.20和0.46的3條帶僅出現在隴東野生紫花苜蓿酶譜中。酯酶酶譜表也現出7條酶帶,其R f值介于0.08~0.99之(表2),除R f為0.11和0.15的兩條帶外其他酶帶均為多態性帶,其中R f為0.08和0.65的兩條帶僅出現在隴東野生紫花苜蓿酶譜中。
結果表明38個紫花苜蓿材料的3種酶電泳共顯示了24條酶帶,其中有5條是隴東野生紫花苜蓿的特征酶帶,有7條(PER為5條,EST為2條)是各材料共有的特征酶帶。共有酶帶可認為是供試材料具有相同起源基因的表現,而17條多態性酶帶(PER為5條,CAT為7條,EST為5條)表明材料在特定的生長環境或不同的進化過程中發生了趨異分化[15]。隴東野生紫花苜蓿與其他紫花苜蓿材料所共有的7條酶帶表明在長期的進化中除了形成自己特征的同時還具有苜蓿屬植物很強的遺傳穩定性。38個紫花苜蓿材料酶譜均存在不同程度的差異,這些酶譜表型可作為區分它們的依據。
2.2 供試材料間的相似系數及聚類分析
應用NTSYSpc2.1軟件計算出供試材料間相似系數矩陣,38份紫花苜蓿品種間的遺傳相似系數介于0.583~1.000,其中隴東野生紫花苜蓿與其他37個供試材料間的相似系數介于0.583~0.833,與賽特間的相似系數最大,與Pick 3006間的相似系數最小,其平均值(0.702)遠遠低于品種間的平均相似系數(0.776~0.870),表明他們之間的遺傳距離相對較大。基于遺傳相似系數,對38個紫花苜蓿品種用非加權成組配對法(UPGMA,Unweighted Pair-Group Method Usingan Arithmetic Average)進行聚類分析,其分析結果如圖1,圖中數字標號與表1同。從圖1可以看出,在相似系數0.702處將38份紫花苜蓿品種分為2類,其中隴東野生紫花苜蓿單獨聚為一類,由此推斷,隴東野生紫花苜蓿與其他供試材料間的親緣關系較遠,為一相對獨立的紫花苜蓿種質資源,這與張雪婷等[4]用POD研究的結果一致。紫花苜蓿品種聚為另一類,且在相似系數為0.810處分為兩個亞類,第Ⅰ亞類包括河西,維多利亞,游客,巴洛法,金皇后,隴東苜蓿,賽特,飛馬,皇冠,獵人河,雷達克之星,格林,領先者,蘇聯1號,秘魯,公農 2號,牧歌401+Z,阿爾岡金。第Ⅱ亞類包括新疆大葉,三得利,Pick 8925,哥薩克,肇東,皇后 2000,美國苜蓿王,美國放牧型,捷克,牧歌,中蘭1號,巨人,德福,秘魯,公農1號,德寶,大西洋,Pick 3006,中農32號。
2.3 主成分分析
通過NTSYSpc 2.1軟件,對5個同工酶38份紫花苜蓿材料的同工酶標記原始矩陣進行主成分分析,得第1和第2主成分位置分布圖(圖2),圖中數字標號與表1同,位置相互靠近者表示關系密切,遠離者表示關系疏遠[16]。供試材料主要分布于3個區域,且隴東野生紫花苜蓿與其他材料間距離較大,供試紫花苜蓿品種集中于兩個區域。結果表明主成分分析結果與聚類分析結果基本一致。
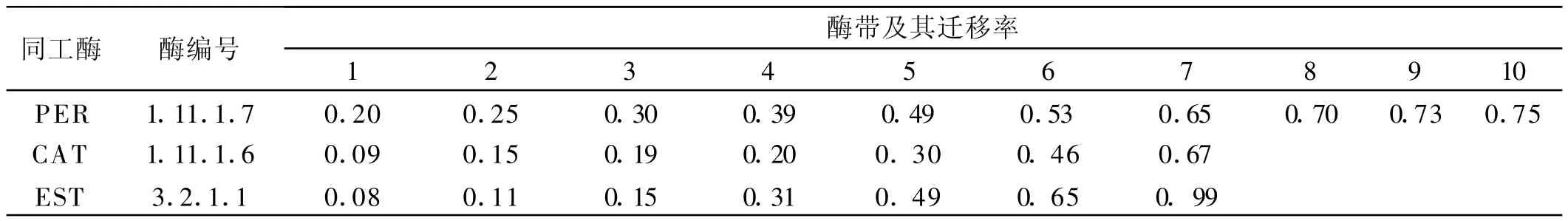
表2 38個紫花苜蓿品種的3種同工酶酶帶數及遷移率Table 2 The number of isoenzymic bands and its mobility of three isozymes in 38 Medicagosativa varieties %
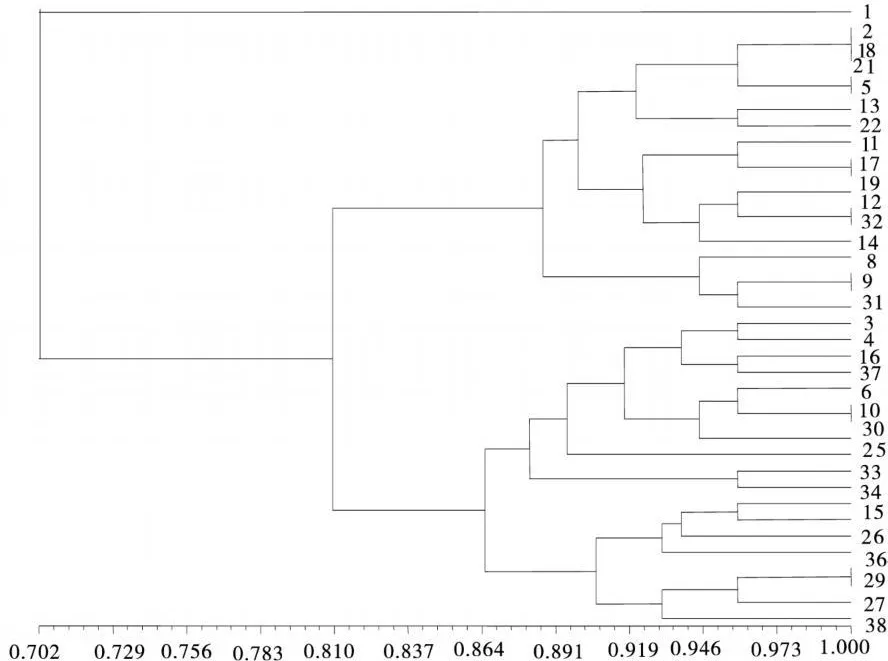
圖1 38個紫花苜蓿品種基于SSR的UPGMA聚類圖Fig.1 UPGMA dendrogram of 38 Medicagosativa varieties based on three isozymes

圖2 38個紫花苜蓿品種基于SSR的主成分分析Fig.2 Principal component analysis of 38 Medicagosativa varietiesbased on three isozymes
3 小結
38個紫花苜蓿品種共表現出了24條酶帶,且所有材料共有7條,在24條酶帶中,5條酶帶為隴東野生紫花苜蓿所特有。試驗表明同工酶對紫花苜蓿材料具有較強的鑒別能力,是分析紫花苜蓿的有效方法。
單獨分析某一條帶的有無或酶帶顏色深淺來比較和鑒定紫花苜蓿材料間的差異有很大的局限性,但若用全部酶帶進行定量分析則可全面準確地反映出品種間的酶譜特征和差異,再針對相似系數進行聚類分析,能更加清楚地了解各供試材料間的親緣關系[9]。38個紫花苜蓿品種間的遺傳相似系數在0.583~1.000,隴東野生紫花苜蓿與其他37個品種間的相似系數遠遠低于品種間的相似系數,進行聚類分析,以遺傳相似系數0.780為標準,供試材料可聚為2大類,較直觀地顯示了親緣關系,隴東野生紫花苜蓿單獨聚為一類,37個品種聚為另一類,主成分分析結果與聚類分析結果基本一致。表明隴東野生紫花苜蓿與品種間遺傳距離較大,由此可確定隴東野生紫花苜蓿與其他品種間的親緣關系較遠,為一相對獨立的紫花苜蓿種質資源,可用于擴大品種的遺傳基礎。
試驗表明,用同一植株不同發育期和不同器官所提取的同工酶數目和活性都存在很大的差異,因此,在同工酶提取時,所取材料必須要滿足發育期和材料部位兩個條件[17]。經試驗對比,用種子提取的過氧化物酶和用幼苗根提取的過氧化氫酶和酯酶活性較強,反映在凝膠上則酶譜清晰。所以試驗選擇用種子提取過氧化物酶,用幼苗根提取過氧化氫酶和酯酶。
[1] Falahati-Anbaran M,Habashi A A,Esfahany M,et al.Population genetic structure based on SSR markers in alfalfa(Medicagosativa L.)from various regions contiguous to the centres of origin of the species[J].Journal of genetics,2007 ,86:59-63.
[2] 尹權為,張璐璐,李發玉.過氧化物同工酶在紫花苜蓿遺傳多樣性分析上的應用[J].草業與畜牧,2008,9:9-11.
[3] 耿小麗,魏瑧武,程鵬舞,等.苜蓿花藥培養及倍性鑒定.草原與草坪,2008(6):1-5.
[4] 張雪婷,師尚禮.隴東野生紫花苜蓿的遺傳特異性分析[J].草地學報,2009,17(3):333-348.
[5] 王玲英.幾種草坪植物過氧化物酶同功酶的測定[J].青海草業,1996,5(1):22-26.
[6] Mahboob A,Chowdhury,Alfred E,etal.Genetic diversity in grasspea(Lathyrussativus L.)[J].Genetic Resources and Crop Evolution ,2000 ,47:163-169.
[7] 龔大潔,周開亞.同工酶及其在爬行動物系統學中的應用[J].西北農業大學(自然科學版),1999,35(1):111-116.
[8] 李曉林.蘋果屬植物酯酶同工酶分析[J].西南農業大學學報,1997,19(2):105-111.
[9] 陳傳軍,沈益新,周建國.南農選系草地早熟禾POD同工酶的酶譜特征及與其它品種的差異[J].中國草地,2005,27(2):36-42.
[10] 沙偉,孟凡玲,馮昌軍.10個苜蓿品種過氧化物同工酶(POD)分析[J].北方園藝,2007(1):150-152.
[11] Akashi Y,Fukuda N,Wako T.Genetic variation and phylogenetic relationships in East and South Asian melons,Cucumis melo L.based on the analysis of five isozymes[J].Euphytica,2002,125:385-396.
[12] 張維強,唐秀芝.同工酶與植物遺傳育種[M].北京:北京農業大學出版社,1993:167-195.
[13] 楊堯軍,李毅,張生華,等.箭胡毛楊及其親本酯酶和過氧化物酶的同工酶分析[J].甘肅農業大學學報,2006,41:46-50.
[14] Fuentes J L,Escobar F ,Alvarez A.Analyses of genetic diversity in Cuban rice varieties using isozyme,RAPD and AFLP markers[J].Euphytica,1999,109:107-115.
[15] 劉波,王荔,陳疏影,等.36份不同居群半夏同工酶研究[J].云南農業大學學報,2008,23(1):1-18.
[16] 唐燕瓊,胡新文,郭建春,等.柱花草種質遺傳多樣性的ISSR 分析[J].草業學報,2009,18(1):57-64.
[17] 程昕昕,耿廣漢,劉正.玉米雜種一代的酯酶酶譜分析[J].種子 ,2007 ,26(4):30-31.

