四種嵌合免疫受體在 T淋巴細胞中的表達分析
駱耐香 陳森洲 徐雅娟
(桂林醫學院,廣西 桂林 541004)
大多數腫瘤相關抗原(TAA)是自身抗原,由于胸腺的選擇機制和耐受機制,機體針對這些抗原產生的 T淋巴細胞中大多數T細胞受體(TCR)的親和力都比較低,從而限制了其腫瘤識別及殺傷效果。將克隆的高親和力識別 TAA的T淋巴細胞受體也稱嵌合免疫受體(CIR)通過基因轉染技術轉染給 T淋巴細胞,可以使重定向的原來無腫瘤識別能力的 T細胞在體外和體內有效識別并殺傷腫瘤細胞〔1〕。近年來利用基因工程技術構建的 T淋巴細胞嵌合免疫受體,它包括識別TAA的單鏈抗體(scFv)和T淋巴細胞的活化基序,通過真核細胞表達載體轉染T淋巴細胞,使 T淋巴細胞能識別并殺傷腫瘤細胞。我們將含人源化抗癌胚抗原(CEA)scFv的 4種 CIR,即 CIRZ、CIR1、CIR2、CIR3,轉染人T淋巴細胞后檢測其在人 T淋巴細胞的表達,篩選出高表達的CIR,為進一步進行體內實驗提供基礎,同時為這一治療策略最終應用于臨床提供可靠的實驗依據。
1 材料與方法
1.1 主要儀器和材料 電穿孔儀NucleofectorTM為Amaxa Biosystems公司產品,流式細胞儀 FACS Calibur為美國 BD Biosciences公司產品。培養基AIM-V購自Sigma公司。健康人外周血由福岡紅十字血液中心提供。CIRZ、CIR1、CIR2、CIR3為本研究室制備,見圖 1。別藻蘭蛋白(APC)標記試劑盒購自日本Dojindo分子技術有限公司,按說明將其標記 CEA。
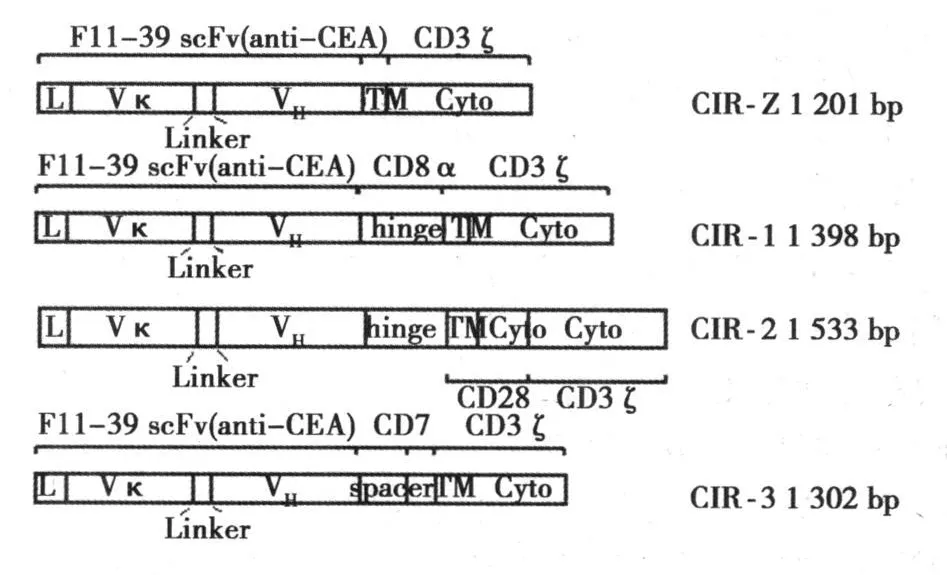
圖1 四種 CIR基因(CIRZ、CIR1、CIR2、CIR3)簡圖
1.2 細胞分離與培養 按常規方法分離淋巴細胞。將分離的人 T淋巴細胞在含 10%小牛血清、100 U/ml青霉素和100mg/ml鏈霉素的 AIM-V培養基中,37℃含 5%CO2的細胞培養箱中培養,每 2天換液 1次,取對數生長期細胞備用。
1.3 基因轉染 將 4種CIR通過電穿孔的方式轉染人T淋巴細胞。按照產品說明,用 100μl電穿孔液 Nucleofector·Solution重懸 T細胞 2×106后,加入 4μg CIR,使用程序 A-23進行電穿孔轉染后即移入預先預熱的 AIM-V培養液中,置 37℃含 5%CO2的細胞培養箱內培養。
1.4 流式細胞術 首先在轉染后 16 h收獲并調整細胞濃度為 1×106/ml于 Eppendorf管中 ,分別加入 400μg/L CEA-APC與 FACS-PBS混合液 200μl,混勻于冰上 1 h,每隔 15 min顛倒混勻,PBS洗 2次后,懸浮于 500μl FACS Flow溶液中,采用流式細胞儀 FACSCalibur檢測分析不同的 CIR在 T細胞表面與CEA定向結合情況。以不含基因的空載體經電穿孔后作為陰性對照。
2 結 果
CIR1、CIR2、CIR3可有效表達在 T細胞表面,與 CEA-APC發生定向結合,曲線高出陰性對照并向右移,其中 CIR3效果更好,而 CIRZ未與 CEA-APC結合,見圖 2。
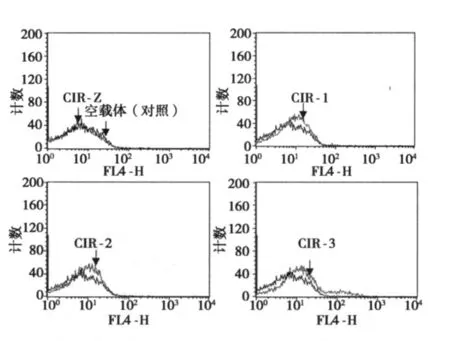
圖2 4種CIR在人T淋巴細胞表面表達的流式細胞術分析
3 討 論
腫瘤過繼免疫治療雖然成功地應用于黑色素瘤和腎細胞癌的治療,但對結腸癌、乳腺癌等實體腫瘤的治療效果并不滿意,其主要原因可能是培養足夠的腫瘤特異性淋巴細胞非常困難。隨著分子生物學技術及基因工程技術的迅猛發展,構建T淋巴細胞的 CIR成為可能,CIR包含識別 TAA的單鏈抗體和T淋巴細胞活化的協同刺激分子 CD28、CD3ζ鏈等,通過體外轉染到 T淋巴細胞的表面,以發揮抗腫瘤功能。
CEA是目前研究最廣而且最具有潛力的靶抗原之一。它是一類主要的TAA,為分子量為 180 000的糖蛋白,最先是在結腸癌提取物中發現的抗原。現已知 CEA不但廣泛存在于各種人類腫瘤細胞中,也存在于正常胃腸組織和胎兒小腸上皮細胞中,但正常組織中的CEA不直接分泌到血液和組織液中。因此,CEA可作為腫瘤免疫治療非常有用的一個靶分子〔2,3〕。機體有效抗腫瘤免疫需要免疫系統能夠識別腫瘤抗原,并最終利用免疫效應機制清除腫瘤細胞。大量的體外實驗及動物實驗證明,用抗TAA的TCR重定向的T細胞具有特異性的腫瘤殺傷功能〔4,5〕。由于人源抗體比鼠源抗體在腫瘤的免疫治療和基因治療中有更大的潛力,我們構建了 4種含人源抗CEA單鏈抗體的 CIR,分別為 CIRZ、CIR1、CIR2和 CIR3,而 CEA特異性CIR可以表達在 T淋巴細胞表面〔6〕。本實驗發現有 3種 CIR(CIR1、CIR2、CIR3)可以在 T淋巴細胞表面表達,其中 CIR3表達最好。與 CIRZ不同的是,3種可在T淋巴細胞表面表達的CIR具有的共同之處是胞外段均有鉸鏈區,推測這類CIR容易在細胞表面表達,繼而可與 CEA發生結合。目前報道的所有臨床應用的 CIR的信號傳導均使用 CD3ζ鏈,而近來的研究發現,只用 CD3ζ鏈作為信號傳導會導致活化的淋巴細胞凋亡,而在單鏈抗體與 CD3ζ之間加入共刺激分子(如 CD28)能有效地增強活化淋巴細胞的功能并防止細胞凋亡。我們利用人源化抗CEA的單鏈抗體的靶向性和CD3ζ胞內區、跨膜區的共刺激信號,構建真核表達載體,轉染 T細胞,旨在制備能活化的有CEA靶向性的外周血 T細胞來殺傷腫瘤細胞。該實驗結合了殺傷性 T細胞的抗腫瘤作用與協同刺激分子兩大研究熱點,使體液免疫與細胞免疫有機結合,利用了TCR/CD3ζ中抗原識別和信號傳導的獨立性,將抗體分子的導向作用和T細胞活化所需的雙信號相結合,構建scFv-CD3ζ腫瘤特異性T細胞能降低T細胞活化的閾值。而且構建的腫瘤特異性 T細胞的殺傷功能由于不受 MHC限制有一定的臨床應用價值,可以提高抗腫瘤綜合免疫治療水平。
臨床研究表明,過繼性輸注腫瘤特異性 T淋巴細胞可通過抑制腫瘤細胞的生長而有效的治療腫瘤。臨床應用的腫瘤特異性T淋巴細胞可從腫瘤病人的外周血、淋巴結或者腫瘤組織中分離。美國國立癌癥研究所進行的一期臨床試驗中,對 17例轉移性黑色素瘤病人用Mart1TCR基因修飾的自體外周血T淋巴細胞進行治療,兩例病人出現客觀療效,這是首次基因治療有效用于腫瘤免疫治療的報道。在該兩例病人中持續檢測到高達 40%~70%的外周血細胞中含有基因標記,并且長達一年之久〔7〕。隨著更多更好的 CIR的構建及治療方案的改善,有望在用基因修飾的 T淋巴細胞治療腫瘤方面取得突破進展。
1 Gross S,Walden P.Immunosuppressivc mechanisms in human tumors:why westill cannot curecancer〔J〕.Immunol Lett,2008;116(1):7-14.
2 Pavoni E,Flego M,Dupuis ML,et al.Selection,affinity maturation,and characterization of a human scFv antibody against CEA protein〔J〕.BMC Cancer,2006;6(1):41.
3 Aldrich WA,Ren C,White AF,et al.Enhanced transduction of mouse bone marrow-derived dendritic cells by repetitive infection with self-complementary adeno-associated virus 6 combined with immunostimulatory ligands〔J〕.Gene Ther,2006;13(1):29-39.
4 Zhao Y,Zheng Z,Robbins PF,et al.Primary human lymphocytes transduced with NY-ESO-1 antigen-specific TCR genes recognize and kill diverse human tumor cell lines〔J〕.J Immunol,2005;174(7):4415-23.
5 Rosenberg SA,Dudley ME.Adoptive cell therapy for the treatment of patients with metastatic melanoma〔J〕.Curr Op in Immunol,2009;21(2):233-40.
6 Shibaguchi H,Luo NX,Kuroki M,et al.A fully human chimeric immune receptor for retargeting T-cell to CEA-expressing tumor cells〔J〕.Anticancer Research,2006;26(6):4067-72.
7 Morgan RA,Dudley ME,Wunderlich JR,et al.Cancer regression in patients after transfer of genetically engineered lymphocytes〔J〕.Science,2006;314(5796):126-9.

