藻藍蛋白對2型糖尿病大鼠胰腺組織iNOS表達的影響
馬璇 劉琳 張蕊 劉吉東 沈衛
糖尿病與機體內自由基的增多以及抗氧化防御系統功能紊亂有關,氧化應激被認為是糖尿病各種并發癥的共同發病途徑[1]。藻藍蛋白(phycocyanin,PC)是一種重要的色素蛋白,普遍存在于藍藻細胞中的光合輔助色素,由開鏈四吡咯化合物和脫輔蛋白通過硫鏈鍵結合,是螺旋藻(spiru lina)細胞中起重要光合作用的天然色素,在螺旋藻中的含量高達10%~20%[2]。研究表明,藻藍蛋白具有促進動物細胞的再生,清除自由基、抑制腫瘤、抗輻射、抗過敏、抗疲勞、抗病毒、增強免疫力和抗炎的作用[3]。目前,對藻藍蛋白的研究開發集中于抗腫瘤、神經保護作用等方面,針對糖尿病治療作用及其機制鮮有研究,本實驗利用2型糖尿病大鼠模型,觀察藻藍蛋白的抗氧化作用,探索其對2型糖尿病的治療作用。
1 材料與方法
1.1 動物模型
健康雄性W is t a r大鼠3 2只,鼠齡1個月,體重1 3 0 g~1 5 0 g,由青島市藥檢所實驗動物中心提供(SCXK(魯)20030010)。動物均于實驗前置于實驗室適應環境一周,自由飲食,室溫(23±2)℃,自然光照,相對濕度50%~70%。隨機分為正常對照組(8只)、模型組及藥物干預組(24只)。正常對照組大鼠喂以普通飼料,其余喂以高糖高脂飼料(15%豬油、20%蔗糖、13%蛋黃粉、2%膽酸鈉、50%普通飼料)飼養[4-5],四周后禁食12h,以30mg/kg劑量一次性腹腔注射1%鏈脲佐菌素(STZ)檸檬酸緩沖液,正常對照組大鼠同步注射等量的檸檬酸緩沖液。注射1周后剪尾取血,測空腹血糖,以血糖值≥7.0mmol/L為糖尿病模型建立成功。24只大鼠造模成功,將其隨機分為模型組、藻藍蛋白組、二甲雙胍組各8只,其中模型組2只大鼠于實驗第11周死亡。
1.2 干預措施
糖尿病模型成功后(實驗第9周)開始干預治療。藻藍蛋白粉劑(藻藍蛋白由中國科學院海洋研究所提供)暗室分裝后-20℃保存,用前加蒸餾水稀釋至濃度為10%的混懸液,按500m g/kg體重灌胃給藥(藻藍蛋白劑量由中國科學院海洋研究所推薦使用),每天1次,連續10天;二甲雙胍組同步給予二甲雙胍(400m g/kg),以蒸餾水稀釋至8%濃度連續灌胃10天。正常對照組和糖尿病模型組同步給予等體積的生理鹽水,連續灌胃10天。
1.3 血糖
各組動物分別在第1周末、第8周末、第10周末測空腹血糖(FBG)(mmol/L)。大鼠禁食12h后,次日早鼠尾靜脈取血,用血糖儀(強生醫療器材有限公司,穩豪型)測定空腹血糖。
1.4 免疫組化染色
治療結束后(11周初),各組大鼠頸椎脫臼處死,迅速取胰腺,4℃生理鹽水沖洗干凈后10%甲醛固定24h,蒸餾水浸泡4h后。常規梯度酒精脫水,二甲苯透明,石蠟包埋,LEICA 2135石蠟切片機連續切片,厚度5um,每隔20片取1片,每個標本取6片,分別裱于涂有多聚賴氨酸的載玻片上,室溫保存備用。iNOS親和純化抗體、即用型SABC試劑盒、DAB顯色試劑盒,均由武漢博士德生物司提供。取上述切片常規脫蠟至水,嚴格按試劑盒說明書操作,DAB顯色,光鏡下特異性染色為片狀棕黃色粗顆粒。部分切片不加一抗以0.1mol/L PBS替代染色,不出現陽性著色。光學顯微鏡(400倍)下,每張切片隨機選擇4個視野,分別計數每個視野內100個胰島細胞中iNOS的陽性細胞數,以各組的陽性細胞數進行比較。
1.5 統計學處理
實驗數據以SPSS11.5統計軟件包處理,各組數據以均數±標準差(±s)表示;組間比較用方差分析,q檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 一般情況觀察
造模成功后,糖尿病大鼠體重較正常組明顯降低(P<0.05)。經過治療后,藻藍蛋白組和二甲雙胍組大鼠體重較模型組顯著增加(P<0.05),且兩組大鼠多飲、多食、多尿的情況有所改善,表明藻藍蛋白和二甲雙胍對糖尿病癥狀改善有一定的治療效果(表1)。
2.2 空腹血糖
STZ造模后,模型組、藻藍蛋白組、二甲雙胍組大鼠空腹血糖與正常組比較明顯升高(P<0.05)。經干預治療后,藻藍蛋白組、二甲雙胍組大鼠空腹血糖與模型組比較有顯著性差異(P<0.05)(表2)。
2.3 組織病理
正常組大鼠的胰島呈圓形或橢圓形的細胞團,胰島內細胞數量較多,細胞邊界清晰,排列整齊,分布均勻;糖尿病對照組大鼠的胰島內細胞數量明顯減少,細胞邊界不清,排列紊亂;部分細胞腫脹、皺縮、壞死、核缺失;藻藍蛋白組和二甲雙胍組大鼠胰島細胞病變減輕,胰島細胞團形狀較規則,與模型組有較大改善,但與正常組相比仍有差距(圖1)。
2.4 iNOS表達
正常組大鼠胰島細胞iNOS呈弱表達,糖尿病模型組大鼠(2只死亡)胰島細胞iNOS表達較正常組增強(P<0.05),呈棕黃色,著色部位主要在胰島細胞胞漿。藻藍蛋白組和二甲雙胍組大鼠胰島細胞iNOS表達較糖尿病組顯著降低(P<0.05),著色較淺,但藻藍蛋白組和二甲雙胍組之間無顯著性差異(P>0.05)。見表3和圖2。
3 討論
Ceriello[6]等認為,氧化應激是胰島素抵抗、糖尿病和心血管疾病的共同發病機制,機體因遭受各種有害刺激時,體內氧自由基產生過多;清除能力降低,當氧化系統和抗氧化系統失衡,就會導致機體組織和功能損傷[7-8]。NO是具有許多生物活性的自由基,是重要的信使分子和效應分子,但是其過量產生會發揮極強的細胞毒性作用。
在糖尿病早期,由于腎小球或視網膜內皮細胞產生NO增多,加上糖尿病患者普遍存在的脂毒性,非飽和游離脂肪酸上調誘導型一氧化氮合成酶(iNOS),產生過量的NO,過量的NO產生大量的過硝酸根離子(ONOO-)和OH-等自由基,損傷β細胞的結構和功能[9]。同時,增高的NO促進胰島素分泌,加之胰島素抵抗的加重及持續高血壓,刺激β細胞處于持續高分泌狀態,促進β細胞衰退,更加重了糖尿病的進展。另外,動物實驗發現,在所有組織中胰島內的具有抗氧化能力的超氧化物歧化酶(SOD)活性最低,胰島又是富含膜結構的組織,極易受自由基的攻擊,以上特性使胰島細胞受NO產生的氧化損傷作用增強。一氧化氮合酶(NOS)抑制劑可明顯降低BB大鼠糖尿病的發病率,進一步說明了NO在糖尿病中的重要作用。但是,由于NO半衰期極短,在組織中直接測定非常困難,Kolodziejska等[10]研究表明,在病理狀態下直接檢測組織中iNOS可客觀反映組織中NO的含量。
表1 各組動物體重的變化(±s)(單位:g)

表1 各組動物體重的變化(±s)(單位:g)
注:與正常組比較,*P<0.05;與模型組比較,△P<0.05。
組別 例數 1周 造模后(8周) 治療后(10周)正常組 8 145.25±5.01 347.88±21.50 390.38±28.54模型組 8 146.75±4.56 269.00±23.77 264.00±24.33△藻藍蛋白組 8 145.50±3.96 261.00±17.70 287.38±13.38△二甲雙胍組 8 148.38±3.46 260.13±26.24 288.25±21.99△
表2 各組大鼠空腹血糖的比較(±s)(單位:mmol/L)
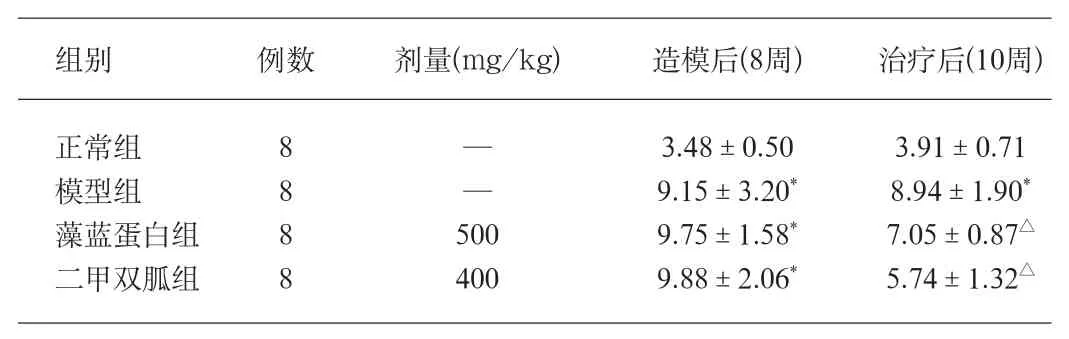
表2 各組大鼠空腹血糖的比較(±s)(單位:mmol/L)
注:與正常組比較,*P<0.05;與模型組比較,△P<0.05。
組別 例數 劑量(mg/kg) 造模后(8周) 治療后(10周)正常組 8 — 3.48±0.50 3.91±0.71模型組 8 — 9.15±3.20* 8.94±1.90*藻藍蛋白組 8 500 9.75±1.58* 7.05±0.87△二甲雙胍組 8 400 9.88±2.06* 5.74±1.32△
表3 各組不同臟器iNOS陽性細胞數(±s)

表3 各組不同臟器iNOS陽性細胞數(±s)
注:與正常組比較,*P<0.05;與模型組比較,△P<0.05。
組別 N 胰腺正常組 8 3.75±1.26模型組 6 18.00±1.63藻藍蛋白組 8 8.00±1.63 △二甲雙胍組 8 10.50±2.52 △
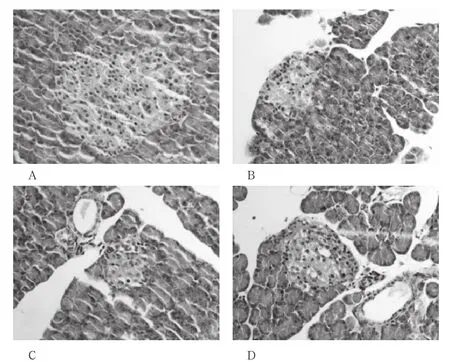
圖1 大鼠胰腺細胞,HE×200
二甲雙胍具有抗氧化特性,在大動脈內皮細胞中,二甲雙胍可以通過降低NAD(P)H氧化酶或線粒體呼吸鏈的活性而減少ROS產生[11]。Romay等[12]研究表明,藻藍蛋白可以清除烷基、羥基、過氧基,可以抑制由Fe2+、壞血酸致微粒體脂質過氧化,其抗氧化作用與抑制腫瘤壞死因子α(TNF-α)及NO產生有關。Bhat等[13]認為,藻藍蛋白還可以清除ONOO-,且其清除氧自由基作用與其發色團有關。

圖2 大鼠胰島細胞iNOS表達,DAB×400
本實驗表明,糖尿病大鼠模型成功后血糖明顯升高。經過兩周治療,藻藍蛋白組和二甲雙胍組血糖均有所下降,二甲雙胍組、藻藍蛋白組與模型組相比同樣具有統計學意義,說明藻藍蛋白具有降低血糖的作用。另外,本實驗研究證明,經藻藍蛋白治療后的糖尿病大鼠胰島細胞中的iNOS表達,無論是著色程度還是陽性細胞數量上較模型組都明顯呈現弱表達,著色部分主要位于胞漿。結合藻藍蛋白干預組與模型組病理形態學對比,推測,藻藍蛋白很可能從抗氧化方面具有一定的治療2型糖尿病的作用。Bottino等[14]通過分離純化胰島細胞,在體外早期應用抗氧化劑干預胰島細胞,也發現阻斷氧化應激的反應過程可明顯降低胰島細胞的損傷,并可促進胰島細胞的增殖,為2型糖尿病的早期診斷和干預提供了一種新的思路。另外,二甲雙胍與藻藍蛋白均具有降糖、抑制iNOS表達、改善胰島細胞結構的作用,但藻藍蛋白作用靶點是否與二甲雙胍一致,其確切的作用機制尚需探索。藻藍蛋白有望成為治療2型糖尿病的候選藥物,其具體的作用機制、劑量、療程有待進一步研究。
[1]金雷,薛宏宇,金禮吉,等.抗氧化劑在糖尿病中的應用研究進展[J].現代生物醫學進展,2008,8(2):383-384.
[2]陳志桃,王立興,林維欽,等.螺旋藻藻藍蛋白的研究進展[J].海峽藥學,2003,6(15):1-5.
[3]Bani-Sadr F,Teissiere F,Curie I,et al.Anti-infection prophylaxis after sexual assault.Experience of the Raymond Poincare-Garches Hospital[J].Presse Med,2001,30(6):253-258.
[4]郭嘯華,劉志紅,李恒,等.高糖高脂飲食誘導的2型糖尿病大鼠模型及其腎病特點[J].中國糖尿病雜志,2002,10(5):290-294.
[5]李愛卿,王志慧,趙躍斌.高糖高脂飼料誘導2型糖尿病大鼠模型[J].臨床醫學進展,2005,l14(2):130.
[6]Ceriello A,Motz E.Is oxidative stress the pathogenic mechanism underlying insulin resistance,diabetes,and cardiovascular disease?The common soil hypothesis revisited[J].Arterioscler Thromb Vasc Biol,2004,24(5):816-823.
[7]Mircescu G.Oxidative stress:an accomplice to uremic toxicity?[J].J Ren Nutr,2006,16(3):194-198.
[8]Lushchak VI.Free radical oxidation of proteins and its relationship with functional state of organisms[J].Biochemistry(Mosc),2007,72(8):809-827.
[9]Kr ncke KD,Fehsel K,Kolb-Bachofen V.Nit ric ox ide cytotoxicity versus cytoprotection—how,why,when,and where?[J].Nitric Oxide,1997,1(2):107-120.
[10]Kolodziejska KE,Burns AR,Moore RH,et al.Regulation of inducible nitric oxide synthase by aggresome formation[J].Proc Natl Acad Sci USA,2005,102(13):4854-4859.
[11]Ouslimani N,Peynet J,Bonnefont-Rousselot D,et al.Metformin decreases intracellular production of reactive oxygen species in aortic endothelial cells[J].Metabolism,2005,54(6):829-834.
[12]Romay Ch,González R,Ledón N,et al.C-phycocyanin:a biliprotein with antioxidant,anti-inflammatory and neuroprotective effects[J].Curr Protein Pept Sci,2003,4(3):207-216.
[13]Bhat VB,Madyastha KM.Scavenging of peroxynitrite by phycocyanin and phycocyanobilin from Spirulina platensis:protection against oxidative damage to DNA[J].Biochem Biophys Res Commun,2001,285(2):262-266.
[14]Bottino R,Balamurugan AN,Tse H.et al.Response of human islets to isolation stress and the effect of antioxidant treatment[J].Diabetes,2004,53(10):2559-2568.

