2,4-二硝基苯肼顯色法測定環己酮含量
環己醇及其衍生物是醫藥、農藥、有機化工領域的重要中間體,如:4-(4-氯代苯基)環己醇是制備阿托喹酮等多種醫藥和多種液晶材料的重要中間體[1],反式4-乙酰氨基環己醇是合成新型祛痰藥鹽酸氨溴索登的醫藥中間體[2]。雖然取代環己醇在很多天然物質中普遍存在,但是關于通過生物催化方法,特別是利用基因工程的方法構建還原環己酮類衍生物的生物催化劑的報道甚少[3]。
2006年,Bali等[4]在大腸桿菌中異源表達了糖多孢紅霉菌聚酮合成酶模塊1中的酮還原酶域基因,研究表明該酶域對環己酮類衍生物有較強的活性,且可通過定向進化技術提高該酶域的還原能力。但是該研究在篩選目標突變型菌株時,采用的是96孔板高通量篩選方法,通過監測NADPH在340 nm處吸光度的變化,來獲得對環己酮衍生物還原能力提高的重組菌株,工作繁瑣。
目前國內測定環己酮的方法主要有氣相色譜法[5]、糠醛顯色法[6]等。作者參考文獻[7],利用2,4-二硝基苯肼顯色法測定重組菌株未還原的環己酮的含量,來初步篩選還原環己酮能力提高的突變重組菌。2,4-二硝基苯肼顯色法測定環己酮含量,操作簡便,檢測結果可靠,對儀器要求也不高,可大大簡化定向進化篩選環己酮還原能力強的突變株的工作。
1 實驗
1.1 菌株與質粒
大腸桿菌EscherichiacoliBL21、pET-28a質粒,安徽大學張部昌教授惠贈;異源表達糖多孢紅霉菌聚酮合成酶模塊1酮還原酶域基因的重組大腸桿菌E.coliBL21 (pET-eryKR1)2及異源表達枯草芽孢桿菌葡萄糖脫氫酶基因的重組大腸桿菌E.coliBL21 (pET-gdh) 1,自行構建保藏。
1.2 培養基
LB培養基參考文獻[8]配制,篩選抗性菌株時,加卡拉霉素至終濃度100 μg·mL-1。
1.3 試劑
環己酮(色譜純),上海晶純化學試劑廠;2,4-二硝基苯肼(分析純)、環己醇(化學純),國藥集團化學試劑有限公司。
1.4 方法
1.4.1 酶的誘導表達
E.coliBL21 (pET-eryKR1)2或E.coliBL21 (pET-gdh) 1菌株按5%的接種量接入30 mL LB培養基中,37℃培養約3 h(OD=1.0左右),加入1 mmol·L-1IPTG誘導酶,繼續培養4 h后,于4℃、4000 r·min-1離心10 min,獲得的菌體用0.01 mol·L-1磷酸鹽緩沖溶液(pH值7.4)懸浮洗滌數次,離心,收獲菌體。
1.4.2 重組菌催化還原環己酮
取0.2 gE.coliBL21 (pET-eryKR1)2[或作為陰性對照的E.coliBL21 (pET28a)]和0.05 gE.coliBL21 (pET-gdh)1懸浮于10 mL 0.1 mol·L-1的磷酸鉀緩沖溶液(pH值7.4)中,再加入0.025 g葡萄糖及10 mmol·L-1環己酮底物。30℃、100 r·min-1振蕩反應6 h后,于4℃、4000 r·min-1離心10 min,取上清液,測環己酮含量。
1.4.3 環己酮含量的測定方法
2,4-二硝基苯肼試劑的配制:取2,4-二硝基苯肼1 g,加入7.5 mL濃硫酸,溶解后將此溶液慢慢倒入75 mL 95%乙醇中,用水稀釋至250 mL。
取25 μL環己酮上清液加入到試管中,再加入100 μL 2,4-二硝基苯肼試劑,沉淀充分后,加入5 mL 0.8 mol·L-1的氫氧化鈉溶液,混勻,測吸光度。
1.4.4 檢出限和精密度的測定
檢出限和精密度的測定參照文獻[6]和[9]。平均數X0、標準差s及相對標準差CV根據文獻[6]計算。
2 結果與討論
2.1 標準曲線的繪制
對環己酮和2,4-二硝基苯肼反應生成的苯腙衍生物以及2,4-二硝基苯肼進行全波長掃描,結果如圖1所示。
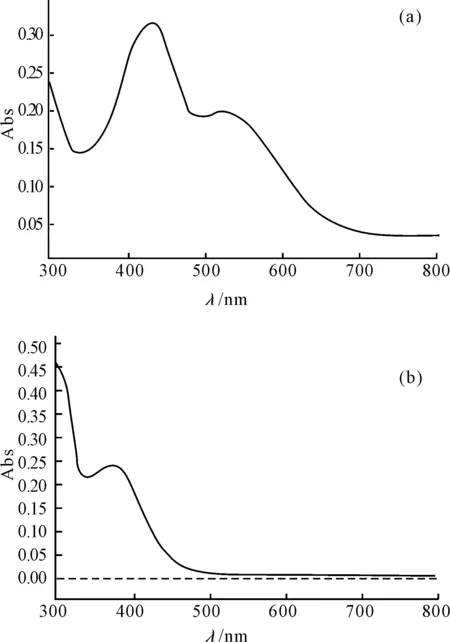
圖1 環己酮苯腙衍生物(a)和2,4-二硝基苯肼(b)的紫外分光光譜
由圖1可知,苯腙衍生物的最大吸收峰在428 nm,而2,4-二硝基苯肼在428 nm波段之后的吸收值比較小,在520 nm之后幾乎為0。因此,選擇2,4-二硝基苯肼顯色法檢測環己酮的掃描波長為520 nm。
取5 μL、10 μL、15 μL、20 μL、25 μL 10 mmol·L-1環己酮樣品加入到試管中,再加入100 μL 2,4-二硝基苯肼試劑,沉淀充分后,加入5 mL 0.8 mol·L-1氫氧化鈉溶液,混勻,以蒸餾水作為空白對照,在520 nm處測吸光度。以環己酮濃度(mg·L-1)為橫坐標、OD520值為縱坐標,繪制環己酮的標準曲線,如圖2所示。擬合線性回歸方程為:y=0.1257x+0.019,R=0.9973。
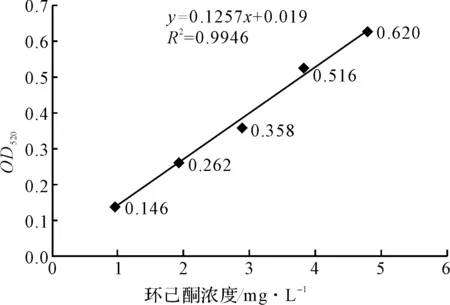
圖2 環己酮的標準曲線
2.2 重組菌還原環己酮的量的檢測
經IPTG誘導的E.coliBL21 (pET-eryKR1)2菌株,以環己酮為底物按1.4.2方法進行生物催化還原,測得還原后剩余環己酮與2,4-二硝基苯肼形成的苯腙衍生物的OD520為0.349,而陰性對照E.coliBL21 (pET28a)對應的OD520為0.637,進一步計算得出:經E.coliBL21 (pET-eryKR1)2菌株催化還原后,環己酮的剩余濃度為538.19 mg·L-1(10 mL的轉化液中),而已知環己酮初始濃度為981.4 mg·L-1(即10 mmol·L-1),故還原環己酮的轉化率為45.2%。這與利用氣相色譜法分析E.coliBL21 (pET-eryKR1)2菌株還原環己酮的轉化液,根據峰面積測得的該菌株還原環己酮的轉化率基本一致。由此可見,通過在520 nm處檢測環己酮和2,4-二硝基苯肼反應的環己酮苯腙衍生物的吸光度,再根據環己酮的標準曲線y=0.1257x+ 0.019,可推測體系中未被還原的環己酮的量,從而獲得轉化率。
2.3 檢出限
對520 nm處測定的7個空白值(如表1)進行統計計算,得X0=-0.107,s=0.00786,檢出限L0=3s/K=3×0.00786/0.1257 =188 μg·L-1。

表1 檢出限測量數據
2.4 精密度
對一定濃度的二硝基苯腙樣品進行精密度實驗,在520 mn處測定5個二硝基苯腙吸光度(表2),計算得標準差SD=0.0115,而相對標準差CV=1.52%。
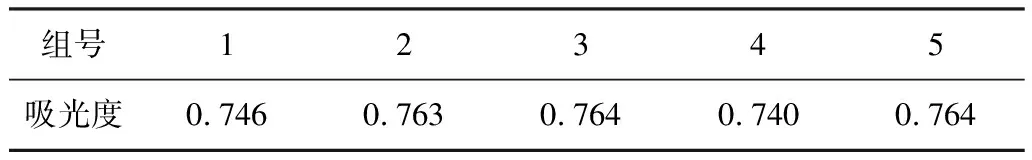
表2 精密度測量數據
3 結論
建立了利用環己酮和2,4-二硝基苯肼顯色反應來檢測環己酮含量的方法,環己酮濃度在0~5 mg·L-1范圍內與吸光度線性關系良好,線性方程為:y=0.1257x+0.019,R=0.9973。在10 mL轉化液的實驗條件下,方法的檢出限為188 μg·L-1,相對標準差為1.52%。該方法操作簡便、靈敏度較高、結果可靠,能滿足篩選突變體的要求。
參考文獻:
[1] 王繼華,王煥杰,馬振東,等.4-(4-氯苯基)環己醇及4-(4-氯苯基)環己酮的合成研究[J].精細化工中間體,2007,37(2):48-51.
[2] 楊能渭,徐正林.4-乙酰氨基環己醇的順反立體異構化工藝[J].高校化學工程學報,2002,16(2):189-193.
[3] de Conti R M,Porto A L M,Augusto J,et al.Microbial reduction of cyclohexanones[J].Journal of Molecular Catalysis B: Enzymatic,2001,11(4): 233-236.
[4] Bali S,O'Hare H M,Weissman K J.Broad substrate specificity of ketoreductases derived from modular polyketide synthases[J].Chem Bio Chem,2006,7(3):478-484.
[5] 史永松,顧海東.氣相色譜法測定環境空氣中的環己酮[J].環境監測管理與技術,2002,14(2):92.
[6] 杭士平.空氣中有害物質的測定方法(第二版)[M].北京:人民衛生出版社,1986:1-558.
[7] 尹濟群,劉名才,馮敬池,等.2,4-二硝基苯肼顯色法測定血細胞丙酮酸激酶[J].臨床檢驗雜志,1995,13(3):127-128.
[8] Sambrook J,Frisch E F,Maniatis T.Molecular Cloning: A Laboratory Manual(2nd ed)[M].New York:Cold Spring Harbor Laboratory Press,1992.
[9] 張素榮,潘巍慧.納氏試劑比色法在微量氨測定中存在的問題及改進建議[J].環境工程,2005,23(5):65-66.

