葡萄籽原花青素對骨髓間充質干細胞誘導分化后神經元樣細胞凋亡的影響
徐隋意,李光來
間充質干細胞(MSCs)是一群來源于中胚層的具有多向分化潛能的非造血系成體干細胞,因此又被稱為多能干細胞[1]。骨髓間充質干細胞(BMSCs)對組織損傷小不觸及倫理道德問題等優點,已成為間充質干細胞最主要的來源[2]。由于BMSCs可誘導分化成如膽堿能[2]、多巴胺能[3,4]等不同遞質的神經元,BMSCs在治療神經內科各種疾病如Alzheimer病、Parkinson病等有著不可比擬的優勢。因此本實驗旨在初探GSP對BMSCs誘導分化后神經元樣細胞凋亡的影響。
1 材料與方法
1.1 材料 骨髓取材于山西醫科大學動物實驗中心,Wistar大鼠股骨,LG-DM EM(Hyclone)、兔抗鼠MAP-2(博奧森)、羊抗兔二抗(博士德)、即用型SABC試劑盒(博士德)、4%多聚甲醛、PBS、3%H2O2、倒置顯微鏡、5%CO2培養箱、超潔凈工作臺、酶標儀、流式細胞儀等。
1.2 BMSCs的分離及體外擴增 取成年健康雄性Wistar大鼠,用PBS反復沖洗去除股骨表面酒精。一次性注射器抽取含有10%FBS及100 U/mL青霉素、鏈霉素雙抗的 LG-DMEM 5mL,反復沖洗髓腔內容物至培養瓶中。放入37℃、5%CO2培養箱中常規培養72 h,使BMSCs充分貼壁。首次半量換液,以后每3 d~4 d根據細胞代謝狀況全量換液。待BMSCs在顯微鏡下鋪滿瓶底 90%左右傳代:棄上清,PBS沖洗3遍,加入0.25%胰酶1 mL,同時鏡下觀察。用無菌滴管吹打細胞100次~200次,制成單細胞懸液。
1.3 GSP干預 取第5代BMSCs分為 4組:空白對照組,GSP低濃度組、GSP中濃度組、GSP高濃度組。將培養瓶中上清吸棄,PBS沖洗3遍。空白對照組加入LG-DMEM 5mL,低中高濃度組分別加入含有GSP 20 mg/L、40 mg/L、80 mg/L的LG-DMEM 5mL,培養箱孵育24 h。
1.4 BMSCs向神經元樣細胞誘導分化[5]將4組培養瓶中上清吸棄,PBS沖洗3遍。加入含有20%胎牛血清的1 mmol/L BME預誘導24 h,再棄上清,PBS沖洗。加入含有40 ng/mL bFGF的無血清培養基作為誘導液誘導24 h。詳見圖1。

圖1 第五代BMSCs及誘導分化后的神經元樣細胞
1.5 免疫細胞化學法鑒定神經細胞[6]本實驗采用直接在細胞培養瓶中進行免疫細胞化學法鑒定。詳見圖2。
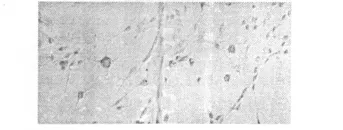
圖2 NSE鑒定陽性及MAP-2鑒定陽性
1.6 M TT法檢測細胞活力 取第五代 BMSCs鋪 96孔板,分組GSP干預及誘導分化方案同上。待誘導分化為神經元樣細胞后,每孔加M TT溶液 20 μ L,放入培養箱,孵育24 h后,每孔的顏色變為紅中帶藍,吸棄上清,每孔加入150 μ LDMSO,室溫震蕩10 min。此時顏色變為紫紅色,放入酶標儀以490 nm波長測OD值。
1.7 神經元樣細胞內游離鈣的測定 以Fluo-3 AM作為鈣離子熒光探針,用流式細胞儀分別對空白對照組,GSP低濃度組、中濃度組、高濃度組干預后BMSCs誘導的神經元樣細胞胞漿中的游離鈣檢測。詳見圖3及圖4。
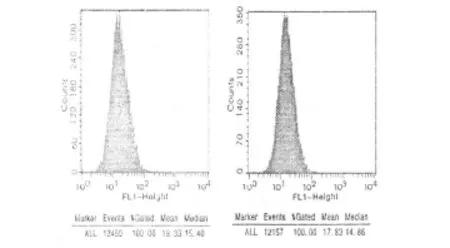
圖3 空白對照組及GSP低濃度組

圖4 GSP中濃度組及GSP高濃度組
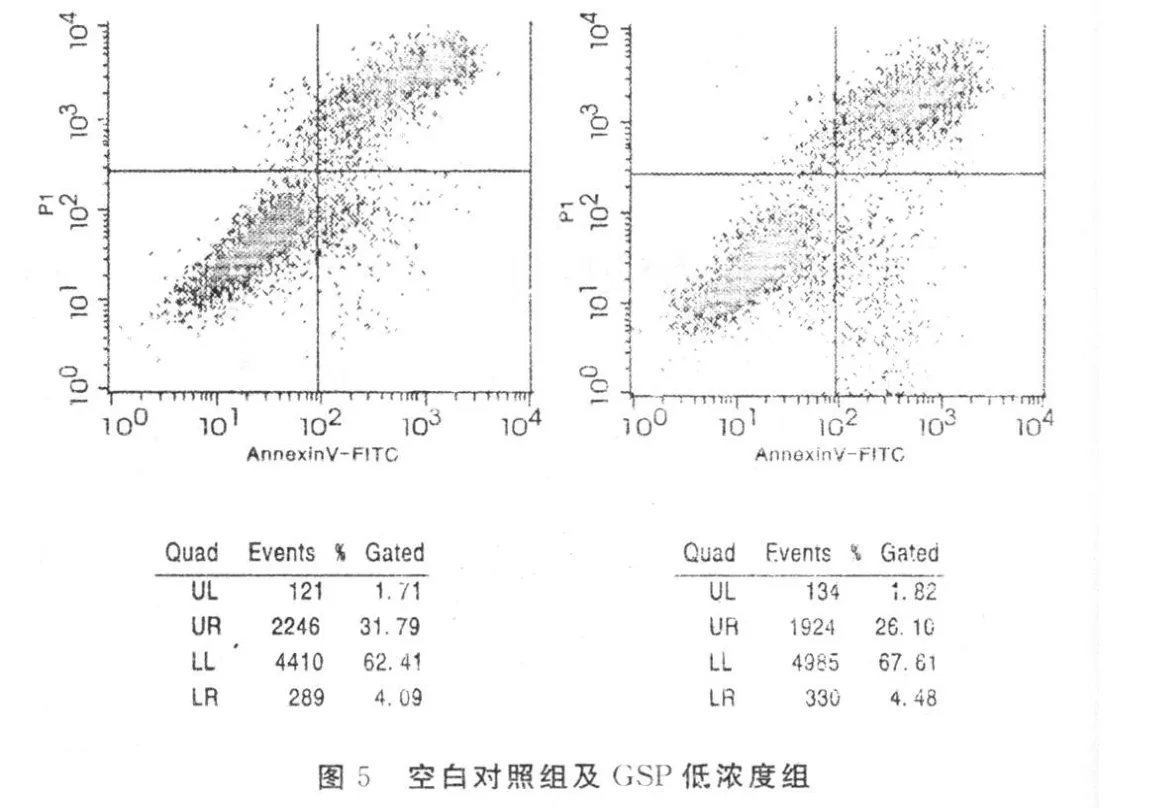
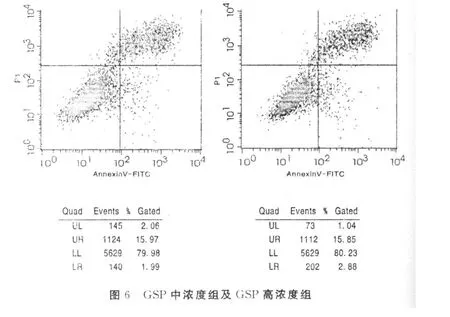
1.8 神經元樣細胞凋亡率的測定 以annexin V和PI雙標細胞,用流式細胞儀分別對空白對照組,GSP低濃度組、GSP中濃度組、GSP高濃度組干預后BMSCs誘導的神經元樣細胞檢測其凋亡率。詳見圖 5及圖 6。
1.9 統計學處理 采用SPSS 13.0軟件,各組間均數比較采用LSD-t檢驗,P<0.05為有統計學意義。
2 結 果
2.1 BMSCs的分離及體外擴增 首次原代培養時沖洗髓腔得到的細胞類型較混雜,鏡下甚至有部分腔內組織碎塊,血細胞較多。72 h半量換液后可見部分BMSCs細胞集落貼于瓶底,呈“菊花”樣或“漩渦”狀排列。每傳代24 h后BM SCs即可恢復活力,貼壁生長迅速,約4 d~5 d可鋪滿瓶底。隨著換液次數的增多,雜細胞逐漸減少。待BMSCs傳至第五代時,雜細胞已消失殆盡。此時BMSCs純度較高,細胞兩極開始有規律的排列成束狀飽滿梭形。邊界清楚,折光性強。
2.2 GSP干預 BMSCs空白對照組及GSP低中高各劑量組干預24 h后,細胞形態無明顯變化。
2.3 BM SCs向神經元樣細胞誘導分化 在用含有20%胎牛血清的1 mmol/L BME預誘導24 h后,部分細胞胞體回縮變圓鈍,個別細胞呈多角形。繼而用含有40 ng/mL bFGF的無血清培養基作為誘導液誘導24 h后,細胞胞體繼續回縮,伸出軸突樹突,部分細胞之間相互連接為網格狀。
2.4 免疫細胞化學法鑒定神經細胞[7]加入DAB顯色液后,NSE及MAP-2陽性細胞均呈棕黃色。不同的是,NSE陽性細胞為胞體胞漿內有棕黃色顆粒,而MAP-2陽性細胞不僅是胞體內,部分軸突也染為棕黃色。用蘇木素復染核后,部分細胞胞體及核均被染為藍紫色。考慮為染色時間控制不佳所致。
2.5 M TT法檢測細胞活力 隨著GSP干預濃度的升高,OD值也呈正比增高。而OD值間接反映細胞內琥珀酸脫氫酶活力,也意味著在GSP濃度為20 mg/L、40 mg/L、80 mg/L的區間的,隨著其濃度的提高,細胞活力不斷增強。
2.6 神經元樣細胞內游離鈣的測定 神經元樣細胞內游離鈣的濃度與GSP的干預濃度呈反比。通過變化“門”位反復取值,經LSD-t檢驗,組間兩兩比較有統計學意義(P<0.05)。
2.7 神經元樣細胞凋亡率的測定 凋亡細胞對所有用于細胞活性鑒定的染料如PI有抗染性,壞死細胞則不能。細胞膜有損傷的細胞的DNA可被PI著染產生紅色熒光,而細胞膜保持完好的細胞則不會有紅色熒光產生。因此,在細胞凋亡的早期PI不會著染而沒有紅色熒光信號。正常活細胞與此相似。在雙變量流式細胞儀的散點圖上,左下象限顯示活細胞,為(FITC-/PI-);右上象限是非活細胞,即壞死細胞,為(FITC+/PI+);而右下象限為凋亡細胞,顯現(FITC+/PI-)。排除吹打細胞時機械性損傷的因素,隨著GSP干預濃度的不斷提高,神經元樣細胞的壞死細胞比例逐漸下降,正常存活細胞比例逐漸升高。通過變化“門”位反復取值,經 LSD-t檢驗,組間兩兩比較,有統計學意義(P<0.05)。
3 討 論
目前已證實BMSCs可在多種誘導體系下向神經細胞分化[8],如:①化學誘導方案:B-BME、DMSO、丁羥茴香醚(BHA)、還原型谷胱苷肽(GSH)等。②以提高胞內cAMP為基礎的誘導方案:異丁甲基黃嘌呤(IBM X)和雙丁酰環腺苷酸(dbcAMP)等。③以細胞生長因子為基礎的誘導方案:神經生長因子(NGF)、表皮生長因子(EGF)、堿性成纖維生長因子(bFGF)、腦源性生長因子(BDNF)、膠質細胞源性神經營養因子(GDNF)等。本試驗采用目前相對穩定成熟的B-BME+bFGF誘導方案。而包括B-BME在內的大部分化學誘導劑有細胞毒性,影響誘導后細胞存活時間與活力。而如何提高細胞存活時間及活力,爭取移植有效時間窗,是影響移植效果的關鍵,也是目前多直接采用BMSCs移植而非誘導后細胞移植的原因之一。
本次實驗研究的GSP目前已知的主要功能有[9]:①抗氧化活性,清除自由基:GSP可以有效地清除超氧陰離子自由基和羥基自由基等,也可中斷自由基鏈式反應,參與磷脂、花生四烯酸的新陳代謝和蛋白質磷酸化,保護脂質免遭病理性的過氧化損傷;其抗氧化作用高于維生素C20倍,高于維生素 E50倍,是目前已知最強的自由基清除劑。②促進細胞內外Ca2+的穩定,減少由于Ca2+異常所造成的細胞損傷,維持細胞膜的穩定性。③可以抑制細胞凋亡的中間環節NF-KB的激活,增加細胞活力,減少凋亡。
GSP應用于心肌細胞、肝臟細胞、視網膜細胞等細胞體內及體外培養抗凋亡研究已有諸多報道。唐瑛等[10]研究發現GSP對H2O2誘導的海馬神經細胞氧化應激損傷具有保護作用。原慧萍等[11]發現GSP對微波誘導視網膜神經節細胞的凋亡有拮抗作用,且濃度在(0~40)mg/L范圍內呈正相關。謝朝陽等[12]發現GSP對β-淀粉樣肽(25.35)誘導PC12細胞的凋亡有保護作用,在(5~50)mg/L的范圍內可呈劑量依賴性提高細胞的存活率。本實驗將目光投到了BMSCs誘導分化后的神經元樣細胞上。研究結果提示GSP濃度在(20~80)mg/L的范圍內,其細胞保護作用與濃度變化呈正相關。不過其抗凋亡具體中間機制是通過上述哪條途徑?還是多途徑聯合?各個途徑之間又有什么聯系?這些問題仍有待進一步研究。
[1]徐隋意,李光來.人骨髓間充質干細胞向神經元樣細胞誘導分析[J].中國組織工程研究與臨床康復,2009,13(27):5385-5388.
[2]井緒東,陳麗,何冬梅,等.誘導大鼠骨髓間充質干細胞表達神經膽堿乙酰化轉移酶[J].中國組織工程研究與臨床康復,2007,11(42):8435-8438.
[3]陳歡意,牛平,趙帥,等.堿性成纖維細胞生長因子預誘導對骨髓基質干細胞向多巴胺能神經元分化的影響[J].臨床神經病學雜志,2007,20(4):274-277.
[4]邢瑩,柴立輝,吳素霞,等.體外誘導人骨髓間充質干細胞分化為多巴胺能神經元[J].神經解剖學雜志,2007,23(2)186-190.
[5]劉雪平,姚紅,張捷,等.堿性成纖維細胞生長因子等體外誘導成人骨髓間充質干細胞分化為神經元樣細胞的研究[J].中風與神經疾病雜志,2003,20(4):312-314.
[6]連霞,李光來.依達拉奉對骨髓間充質干細胞誘導分化后神經元樣細胞生長狀態的影響[J].中西醫結合心腦血管病雜志,2006,4(3):232-234.
[7]王寧,楊樹源,張文治,等.大鼠骨髓間充質干細胞體外誘導向神經元分化[J].中華神經外科雜志,2005,21(1):55-58.
[8]項正兵,吳曉牧.體外誘導骨髓間充質干細胞向神經細胞分化的研究進展[J].中西醫結合心腦血管病雜志,2007,5(7):604-605.
[9]呂麗爽.天然抗氧化劑低聚原花青素的研究進展[J].食品科技,2000,23:147-150.
[10]唐瑛,刁波,王曉昆,等.葡萄籽原花青素對原代培養海馬細胞氧化應激的影響[J].中藥材,2007,30(12):1555-1558.
[11]原慧萍,馬春陽,周欣榮,等.原花青素對微波誘導視網膜神經節細胞凋亡的拮抗作用[J].中國病理生理雜志,2008,24(4):812-814.
[12]謝朝陽,梅寒芳,祝其鋒.原花青素對β-淀粉樣肽(25-35)誘導的PC12細胞凋亡的保護作用[J].中國老年學雜志,2005,25(2):159-161.

