種植骨髓干細胞的多孔人工骨在猴脊柱后外側融合術中的應用
王居勇,沈惠良,折井久彌,張慶明,四宮謙一
為了增強脊柱手術后的穩定性,臨床通常采用自體骨植入脊柱橫突間,達到脊柱融合。自體髂骨骨塊通常被認為是最好的材料,和其他移植材料相比,自體骨仍作為金標準。然而在很多病例,取骨部位的手術通常會出現一些問題,如增加失血、延長手術時間、神經損傷以及取骨部位感染等[1-2]。另外,也有一些研究報道,應用自體骨有30%患者發生非融合和假關節形成[3-4];對于多節段脊柱融合手術,自體骨資源可能不充分。
近年來,利用骨誘導生長因子來誘導骨形成的研究也很多,尤其是骨形態蛋白(BMP)。一些研究者應用工程材料和rhBMP-2成功得到組織工程骨[5-7],目前多數研究都是針對破骨細胞的骨吸收和骨形成這一方面[8-9]。然而,大劑量BMP移植入體內可能引起意想不到的副作用,這些副作用甚至可能發生在遠離BMP使用的部位,所以,很多國家還沒有承認BMP的臨床應用價值。
最近,很多研究證實種植了骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs)的多孔人工骨能夠誘導骨形成[10-12]。BMSCs具有多潛能特性,容易提取并且容易培養增殖。Yoshikawa使用Maniatopoulos方法提高了細胞的培養效率[11,13]。一些學者應用低壓和灌注方法提高了組織工程骨的合成效率[14-16]。傳統方法是將細胞種植入多孔材料后再培養2周,而我們是利用低壓方法將細胞種植入多孔生物材料后,縮短組織工程骨的培養時間。由于生物材料多孔β-磷酸三鈣(β-TCP)植入體內后,具有能夠逐漸被吸收,逐漸被人體自身骨生長替換的特點[17-18],所以,我們采用β-TCP和BMSCs結合合成組織工程骨。本研究將這種方法合成的組織工程骨用于靈長類動物脊柱后外側融合手術,評估組織工程骨能否增強脊柱融合強度,能否作為手術中自體骨的替換物。
1 材料和方法
1.1 多孔生物材料 β-TCP,日本 Olympus公司提供。該材料多孔率為75%,孔徑200~400 μ m,孔與孔之間的連接通道直徑 100~200 μ m[10]。
1.2 BMSCs的分離和培養 BMSCs采自于3~4歲雄性食蟹猴,體重3.3~4.9 kg。全身麻醉下,使用20 ml注射器和16號骨髓穿刺針,于食蟹猴股骨大轉子處抽取骨髓,DMEM(Dubberco's Minimal Essential Medium)懸浮,1000 r/min離心5 min,標準培養液混勻。標準培養液構成:DMEM、1%抗生素/抗真菌藥(10000 U/ml青霉素 、10000 μ g/ml鏈霉素 、25 μ g/ml兩性霉素 B溶入 0.85%鹽水,GIBCO,USA)、10%FBS(Fetal bovine serum,GIBCOBRL,Lot No.3295241S)。將細胞培養于37℃培養溫箱內,3 h后更換培養液,移除漂浮細胞,附著于培養皿的細胞主要是BMSCs[19]。以后培養液每3 d更換1次,大約2周,細胞在培養皿內增殖滿意后,用0.25%trypsin-EDTA從培養皿內分離獲取細胞,然后進行分盤二次培養,大約7 d后培養細胞長滿培養皿。
1.3 組織工程骨的準備 細胞擴增完成后,將擴增培養液改為骨細胞分化培養液,骨細胞分化培養液由下列成分構成:標準培養液內加入100 nmol/L地塞米松(Sigma-Aldrich Co.,St.Louis,MO,USA)、10 mmol/L β-甘 油 磷 酸(Sigma-Aldrich Co.)和 0.25 mmol/L維生素C(Wako)[19]。分化培養4 d,分離細胞在4℃,1000 r/min離心5 min,計數,獲取2×106/ml細胞懸濁液。將β-TCP浸入細胞懸濁液內,然后放入低壓系統,100 mmHg(1 mmHg=0.133 kPa)下處理1 min,37℃溫箱內培養3 h[16,20-21]。部分β-TCP/BMSCs工程骨用于電子掃描顯微鏡觀察(Hitachi S-4500,Japan),證實多孔β-TCP內附著大量 BMSCs(圖1)。細胞附著3 h后,β-TCP/BMSCs工程骨被移植到食蟹猴體內。

圖 1 β-TCP/BMSCs復合物(Bar=30 μ m)
1.4 手術過程 6只食蟹猴,在L4-5節段后外側橫突間植入移植材料行脊柱融合手術[22]。手術在全麻下進行。麻醉成功后,食蟹猴俯臥位,手術區碘酒酒精消毒,通過術前X線確定L4-5位置。取后正中切口,沿棘突切開豎脊肌,顯露椎板和橫突,棘上韌帶和椎小關節保持完整。術者用球磨鉆將橫突上方皮質去除,將移植材料放置于L4-5去皮質化橫突間,縫合筋脈和皮膚。術后肌注頭孢替坦2 d預防感染。食蟹猴在籠內不限制活動和飲食。
1.4.1 移植材料 本研究使用的移植材料有3組(n=4側):①β-TCP/BMSCs工程骨:將 BMSCs種植入30×10×5 mm β-TCP 材料;②自體骨:約同樣大小骨塊取自于髂后上嵴;③單純β-TCP材料:同樣30×10×5 mm大小。
1.4.2 手術分組情況 2只食蟹猴體內一側移植β-TCP/BMSCs工程骨,另一側移植自體骨;另外2只食蟹猴一側為自體骨,另一側為單純β-TCP材料;最后2只猴子為β-TCP/BMSCs工程骨和單純β-TCP材料。
1.5 評估 術后12周通過靜脈注射戊巴比妥處死猴子。手術取出L3~S1脊柱標本,清除周圍軟組織。采用融合節段手法觸壓、微CT、外周定量CT(Peripheral Quantitative Computed Tomography,pQCT)和組織學方法觀察脊柱融合情況。
1.5.1 手法觸壓 手法觸壓測試觀察椎體左右兩個矢狀面。術者雙手把持融合節段的遠近端掰壓標本,移植材料區域沒有活動即為融合,有活動即為非融合。
1.5.2 微CT 標本收獲后用于微CT掃描(SMX-130CT-SV,Shimadzu,Japan)。掃描參數:34 μ A,46 kV,掃描厚度0.16 mm。評估隨機區域骨形成的存在和融合骨量。
1.5.3 pQCT 所有L4-5橫突節段標本都采用pQCT掃描,掃描參數:0.12×0.12×0.77 mm voxel。每個標本取用3個掃描切片,計算新形成骨的骨礦物質密度(BMD)并得出其平均值。同時測量體外未植入的β-TCP的BMD,用于與移植術后 12周的β-TCP/BMSCs工程骨和單純β-TCP的比較。
1.5.4 組織學分析 標本用10%福爾馬林液固定,酒精脫水,脫鈣(Decalcifying Solution A,Wako,Osaka,Japan),石蠟包埋,HE染色,顯微鏡觀察(Olympus,AX-70,Japan)。
2 結果
動物的手術過程均順利,術后動物喂養,動物的活動均無異常。
2.1 手法觸壓 在β-TCP/BMSCs工程骨組和自體骨組,4例標本均有3例達到融合,未融合的工程骨和自體骨標本來源于同一只猴腰椎兩側;而單純β-TCP組無一例融合。β-TCP/BMSCs工程骨組和自體骨組相比較,融合效果沒有明顯不同。
2.2 微CT 在β-TCP/BMSCs工程骨組,術后12周顯示腰椎橫突部位大量的新骨形成,明顯多于自體骨組的骨形成量;自體骨組僅表現為原植入骨的同質融合(圖2)。
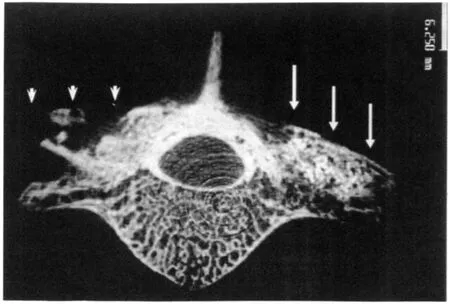
圖2 移植術后12周的微CT圖像(Bar=6.250 mm)
2.3 pQCT β-TCP/BMSCs工程骨組骨形成的BMD平均值明顯高于手術前的β-TCP。單純β-TCP組術后BMD平均值比術前β-TCP的BMD降低(圖3),可能由于β-TCP被吸收。
2.4 組織學觀察 橫斷面切片組織學染色顯示所有β-TCP/BMSCs工程骨內存在骨生長,并與腰椎橫突生長融合(封三彩圖2.1)。矢狀面切片顯示β-TCP/BMSCs工程骨完全出現新生骨,沒有纖維組織形成(封三彩圖2.2);在單純β-TCP組,材料碎裂且沒有形成融合,取出的部分β-TCP材料組織圖像內沒有骨性形成(封三彩圖2.3)。材料移植部位未見任何炎癥細胞存在。
3 討論
在食蟹猴脊柱后外側融合手術,我們嘗試應用了多孔人工骨β-TCP材料,在種植有BMSCs的多孔β-TCP組織工程骨內能夠觀察到大量的新生骨,而單純β-TCP材料內卻觀察不到骨形成。這些結果顯示對于多孔人工骨β-TCP的應用,BMSCs是重要的。TCP材料在體內的降解可以為骨形成提供Ca和P[18,23-24]。在移植手術前,由BMSCs分化得到成骨樣細胞,通過細胞在多孔材料內的種植,大量成骨細胞附著于β-TCP內,這為移植術后多孔材料內廣泛均勻成骨提供了基本保證。本研究使用的β-TCP內具有和松質骨類似的較大孔隙和連接通道,這也有益于多孔材料內細胞的種植和術后組織血管的長入。多孔材料內血運的建立,可以為人工骨內骨形成提供一個較好的營養環境。β-TCP/BMSCs工程骨能夠在多孔材料內誘導早期骨形成,新形成的骨覆蓋在 TCP材料內孔的表面,并且限制TCP材料和組織液的接觸,這將導致β-TCP材料吸收的減慢[25]。
一些研究者在他們的研究里進一步改進骨細胞的
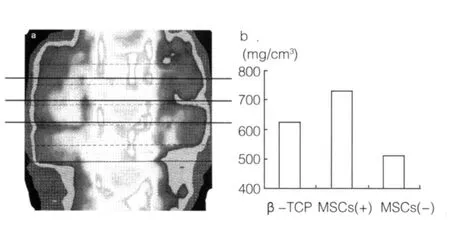
a:pQCT圖像;b:骨密度均值。
圖3 移植術后12周的pQCT結果培養技術[11,26-27]。然而,對于較大尺寸的人工骨材料,不是很容易將細胞種植入材料的中心部位;人工骨移植入體內以后,多孔材料內的BMSCs還需要與周圍組織液和血液進行物質交換;然而,體外培養過程中,多孔材料內的BMSCs并不能得到足夠的氧和其他營養物質的支持。為了避開這一問題,我們把細胞種植進入多孔材料后,很快就將β-TCP/BMSCs工程骨移植入動物體內。
在脊柱后外側融合手術,在脊柱兩側應該植入相同移植物材料來融合固定脊柱。然而在本研究中,我們在脊柱同一節段兩側植入了不同的移植材料,目的在于相同條件下比較不同移植材料的融合固定效果。這種研究方法證明,脊柱融合手術中,β-TCP/BMSCs工程骨能夠替換自體骨。
本研究顯示在移植手術12周后,β-TCP/BMSCs工程骨內存在很好的骨形成。對于本研究的較好成骨結果,去皮質化橫突與β-TCP/BMSCs工程骨的直接接觸可能是導致β-TCP內骨生長的一個原因;分化后BMSCs的骨生成作用更為重要;另外,移植人工骨處存在的生物力學因素可能是保持骨代謝的又一個因素[28]。
在工程組織骨應用在臨床之前,需要解決以下幾個問題:①培養細胞使用的胎牛血清(FBS)不符合醫學倫理,應該用自體血清替換目前的FBS;②即使β-TCP是一個很好的材料,由于其不夠強硬的生物力學特點,它也不是最理想的人工骨。移植脆弱的人工骨將會導致假關節形成,然而,本研究所采用的β-TCP/BMSCs工程骨多數標本全部形成新骨。在移植有多孔人工骨的手術后,必須采取必要的術后指導以防止移植物斷裂和假關節形成等危險發生。然而,這個應用組織工程骨的脊柱融合手術,并未采用釘棒系統固定脊柱。如果將工程組織骨和釘棒系統共同用于手術,應該可以得到確實的脊柱融合固定。
本研究成功地建立組織工程骨脊柱融合手術動物模型。我們推斷在臨床脊柱融合手術中,可以用多孔組織工程骨來建立確實的脊柱融合固定,多孔組織工程骨可以用于替換自體骨。
致謝:感謝Olympus公司無償提供β-TCP人工骨。
[1]Fernyhough J,Schimandle J,Weigel M,et al.Chronic donor site pain complicating bone graft harvesting from the posterior iliac crest for spinal fusion[J].Spine,1992,17(12):1474-1480.
[2]Singh J,Nwosu U,Egol K.Long-term functional outcome and donor-site mo rbidity associated with autogenous iliac crest bone grafts utilizing a modified anterior approach[J].Bull NYU Hosp Jt Dis,2009,67(4):347-351.
[3]DePalma A,Rothman R.The nature of pseudarthrosis[J].Clin O rthop Relat Res,1968,59:113-118.
[4]Steinmann J,Herkowitz H.Pseudarthrosis of the spine[J].Clin Orthop Relat Res,1992,284:80-90.
[5]Boden S,Kang J,Sandhu H,et al.Use of recombinant human bone morphogenetic protein-2 to achieve posterolateral lumbar spine fusion in humans:a prospective,randomized clinical pilot trial:2002 Volvo Award in clinical studies[J].Spine,2002,27(23):2662-2673.
[6]Schimandle J,Boden S,Hutton W.Experimental spinal fusion with recombinant human bone morphogenetic protein-2[J].Spine,1995,20(12):1326-1337.
[7]Jiang X,Sun X,Lai H,et al.M axillary sinus floor elevation using a tissue-engineered bone complex with beta-TCP and BMP-2 genemodified bM SCs in rabbits[J].Clin Oral Implants Res,2009,20(12):1333-1340.
[8]Kanatani M,Sugimoto T,Kaji H,et al.Stimulatory effect of bone morphogenetic protein-2 on osteoclast-like cell fo rmation and bonereso rbing activity[J].J Bone Miner Res,1995,10(11):1681-1690.
[9]Boden S,Martin G,Morone M,et al.Posterolateral lumbar intertransverse process spine arthrodesis with recombinant human bone morphogenetic protein-2/hydroxy apatite-tricalcium phosphate after laminectomy in the nonhuman primate[J].Spine,1999,24(12):1179-1185.
[10]Dong J,Uemura T,Shirasaki Y,et al.P romotion of bone formation using highly pure porous beta-TCP combined with bone marrow-derived osteoprogenitor cells[J].Biomaterials,2002,23(23):4493-4502.
[11]Yoshikawa T,Ohgushi H,Uemura T,et al.Human marrow cells-derived cultured bone in porous ceramics[J].Biomed M ater Eng,1998,8:311-320.
[12]Kotobuki N,Katsube Y,Katou Y,et al.In vivo survival and osteogenic differentiation of allogeneic rat bone marrow mesenchymal stem cells(MSCs)[J].Cell Transplant,2008,17(6):705-712.
[13]M aniatopoulos C,Sodek J,Melcher A.Bone formation in vitro by stromal cells obtained from bone marrow of young adult rats[J].Cell Tissue Res,1988,254(2):317-330.
[14]Uemura T,Dong J,Wang Y,et al.Transplantation of cultured bone cells using combinations of scaffolds and culture techniques[J].Biomaterials,2003,24(13):2277-2286.
[15]Dong J,Uemura T,Kikuchi M,et al.Long-term durability of porous hydroxyapatite with low-pressure system to support osteogenesis of mesenchy mal stem cells[J].Biomed M ater Eng,2002,12(2):203-209.
[16]王居勇,張懷華,沈慧良.低壓細胞灌注法提高多孔人工骨成骨能力的體外研究[J].中國組織工程研究與臨床康復,2007,11(31):6130-6134.
[17]Kurashina K,Kurita H,Wu Q,et al.Ectopic osteogenesis with biphasic ceramics of hydroxyapatite and tricalcium phosphate in rabbits[J].Biomaterials,2002,23(2):407-412.
[18]Damron T.Use of 3D beta-tricalcium phosphate(Vitoss)scaffolds in repairing bone defects[J].Nanomedicine,2007,2(6):763-775.
[19]Jaiswal N,Haynesworth S,Caplan A,et al.Osteogenic differentiation of purified,culture-expanded human mesenchymal stem cells in vitro[J].J Cell Biochem,1997,64(2):295-312.
[20]Dong J,Uemura T,Kojima H.Application of low pressure system to sustain in vivo bone formation in osteoblast/porous hydroxyapatite composite[J].Mater Sci Eng C,2001,17:37-43.
[21]王居勇,沈惠良,麻生義則.低壓細胞灌注多孔人工骨的成骨能力:與常壓灌注的比較[J].中國組織工程研究與臨床康復,2008,12(49):9601-9605.
[22]Akamaru T,Suh D,Boden S,et al.Simple carrier matrix modifications can enhance delivery of recombinant human bone morphogenetic protein-2 for posterolateral spine fusion[J].Spine,2003,1(28):429-434.
[23]Wang J,Chen W,Li Y,et al.Biological evaluation of biphasic calcium phosphate ceramic vertebral laminae[J].Biomaterials,1998,19(15):1387-1392.
[24]Guha A,Sing h S,Kumaresan R,et al.Mesenchymal cell response to nanosized biphasic calcium phosphate composites[J].Colloids Surf B Biointerfaces,2009,73(1):146-151.
[25]Kurashina K,Kurita H,Kotani A,et al.In vivo study of a calcium phosphate cement consisting of alpha-tricalcium phosphate/dicalcium phosphate dibasic/tetracalcium phosphate monoxide[J].Biomaterials,1997,18(2):147-151.
[26]Ohgushi H,Dohi Y,Katuda T,et al.In vitro bone formation by rat marrow cell culture[J].J Biomed Mater Res,1996,32(3):333-340.
[27]Tokumoto S,Sotome S,Torigoe I,et al.Effects of cry opreservation on bone marrow derived mesenchymal cells of a nonhuman primate[J].J Med Dent Sci,2008,55(1):137-143.
[28]Yuan H,Yang Z,Bruij JD,et al.Material-dependent bone induction by calcium phosphate ceramics:a 2.5-y ear study in dog[J].Biomaterials,2001,22(19):2617-2623.

