外源亞精胺(Spd)對鹽脅迫下番茄幼苗生理生化指標的影響
張紀濤,胡曉輝,李翠
(1.西北農林科技大學資環學院,陜西楊凌,712100;2.西北農林科技大學園藝學院)
土壤鹽漬化是影響農業生產和生態環境的主要的非生物脅迫之一,它對農業的影響是一個全球性的問題,全球20%的耕地和近半數的灌溉土地都受到不同程度的鹽害威脅[1]。設施農業由于其自身的特點,一般都會產生不同的次生鹽漬化問題,嚴重限制設施農業的發展。鹽脅迫對植物造成的傷害主要有3種:滲透脅迫、離子毒害、營養失衡[2],表現為植物生長受限、光合速率下降、衰老加快等。
亞精胺(Spd)是生物代謝過程中產生的一種具有生物活性的低分子量脂肪族含氮堿,是多胺家族的一個重要成員。多胺廣泛作用于植物生長、形態建成、衰老和對環境脅迫的反應,在多種逆境條件下,植物體內多胺含量迅速發生變化[3,4]。許多研究表明,適宜濃度的外源Spd可以提高植物的耐鹽性[5~7]。番茄(Lycopersicon esculentumMill.)屬于中度鹽敏感植物,是設施農業栽培的主要蔬菜作物之一。鹽脅迫影響番茄種子的發芽、幼苗的生長發育,導致番茄植物體組織水分虧缺、營養失衡、離子毒害,從而降低番茄產量和品質。因此通過研究Spd對番茄鹽脅迫的緩解效應,對改善番茄的生長和生產,具有十分重要的意義和廣闊的應用前景。
1 材料與方法
1.1 試驗材料
試驗選擇耐鹽性不同的兩個番茄品種:“江蔬14號”(耐鹽性弱)和“白果強豐”(耐鹽性強)。于2007年9~12月在西北農林科技大學園藝場玻璃溫室進行試驗。
1.2 試驗設計
選取大小一致、均勻、飽滿的番茄種子經消毒、催芽,播種于裝滿珍珠巖的穴盤中,早晚澆水各1次,子葉展平后每2 d澆灌1次1/2劑量的山崎番茄配方營養液。當幼苗3葉1心時定植在玻璃溫室中裝有1/2劑量水培槽中。營養液pH值調至6.5~7.0。每3 d調1次pH值,4 d更換1次營養液。當幼苗長到7~8葉片時進行處理(試驗設4個處理,①CKN:培養液+0 mmol/L NaCl+0 mg/L Spd;②CKP:培養液+0 mmol/L NaCl+100 mg/L Spd;③N:培養液+100 mmol/L NaCl+0 mg/L Spd;④P:培養液+100 mmol/L NaCl+100 mg/L Spd),每天于下午4:00噴施Spd一次,噴施到葉片上有欲滴的水珠為止。在處理12 d時,取樣測定植株的干、鮮質量。在脅迫 0(處理前1 d)、4 d、8 d的時候,取樣測定生理指標,每個處理重復3次。
1.3 試驗方法
①番茄幼苗地下、地上部分的干鮮質量的測定處理12 d后,隨機選取10株番茄幼苗,將幼苗用清水洗凈,把地上和地下部分分開,用吸水紙擦干后稱取鮮質量。然后在105℃下殺青15 min,70℃烘干至恒重,稱取干質量。計算根冠比。
②葉片電導率的測定 選擇完整的番茄幼苗葉片洗凈擦干,用打孔器打取12個原片,放入洗凈的試管中,加入10 mL蒸餾水,用真空泵抽氣10 min至呈半透明狀,用電導儀測定初電導值(S1),然后,置于沸水中5 min,冷卻后測定電導值(S2)。按下面的公式計算相對電導率。
相對電導率(L)=(S1-S0)/(S2-S0),S0表示空白電導率。
③葉片丙二醛(MDA)含量的測定 采用硫代巴比妥酸 (TBA)染色法測定,取樣品葉片1 g加10%TCA 10 mL研磨提取,離心后取2 mL上清液,加入2 mL 0.6%的TBA溶液,沸水浴反應15 min,冷卻后于450 nm,532 nm,600 nm下測定吸光值,計算丙二醛的含量[8]。
④葉片脯氨酸(Pro)含量的測定 取0.5 g洗凈的葉片,用3%的磺基水楊酸研磨提取,離心后取上清液用酸性茚三酮染色,于520 nm下比色測定[8]。
⑤葉綠素含量的測定 采用80%丙酮浸提法,在663 nm、646 nm波長下測定吸光值,計算葉綠素a、葉綠素b的含量。
1.4 數據處理
采用SPSS16.0軟件對試驗數據進行處理,Duncan's多重比較進行統計分析,Excel作圖。
2 結果與分析
2.1 外源Spd對番茄幼苗地上及地下部干鮮質量的影響
試驗結果如表2所示,鹽脅迫總體上降低了兩個品種番茄幼苗的根干質量、冠干質量和根冠比。在非鹽脅迫下,外源Spd對這三個指標沒有明顯的影響。而在鹽脅迫下,外源Spd雖然也在一定程度的上降低了兩個番茄品種根、冠干質量,提高了根冠比,但這種影響作用不明顯。
2.2 外源Spd對番茄幼苗葉片細胞質膜透性的影響
試驗結果如圖1所示。鹽脅迫顯著影響細胞膜透性,鹽處理的白果強豐和江蔬14號番茄幼苗在處理4 d,8 d的細胞膜透性分別比對照增加了113.46%,41.92%,37.39%,68.52%。非鹽脅迫下,外源Spd能降低電解質滲出率,處理4 d,8 d時,白果強豐分別比對照降低了4.62%,3.08%,江蔬14號分別降低了0.90%,20.66%。鹽脅迫下,外源Spd能顯著降低細胞膜透性,在處理4 d,8 d時,白果強豐番茄幼苗的相對電導率分別比對照降低了53.69%,17.34%;江蔬14號番茄幼苗的相對電導率分別比對照降低了0.66%,33.66%。說明外源Spd能保護細胞膜的完整性,減少鹽脅迫對細胞膜的傷害。
2.3 外源Spd對番茄幼苗葉片中丙二醛(MDA)含量的影響
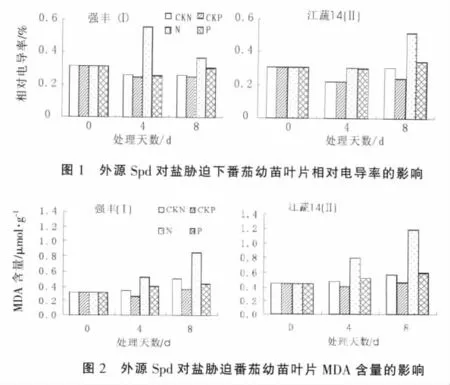
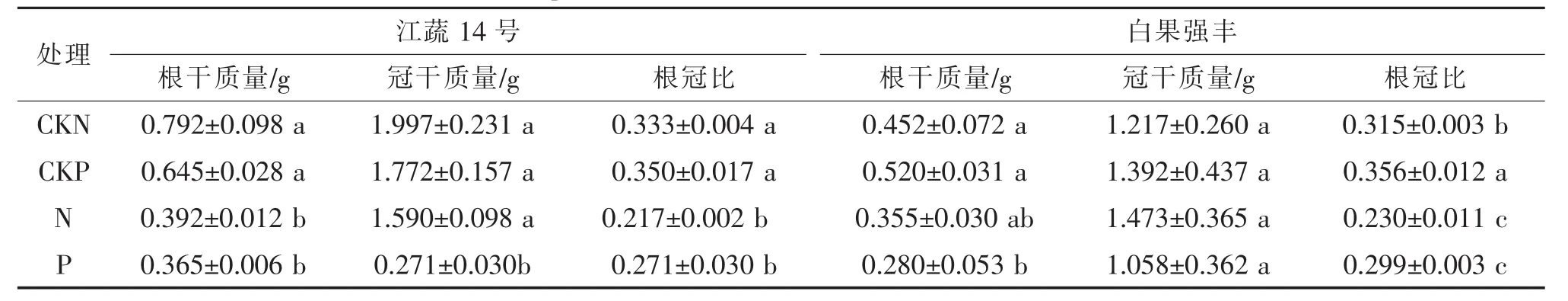
表1 外源Spd對番茄幼苗根質量、地上部質量及根冠比的影響
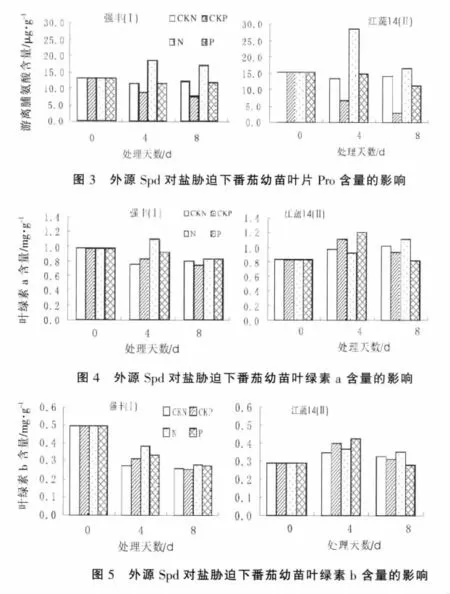
MDA是膜脂過氧化的產物,可用丙二醛的含量高低來代表膜脂過氧化的程度。試驗結果(圖2)顯示,非鹽脅迫下外源Spd能降低番茄幼苗葉片MDA的含量,處理4 d時白果強豐和江蔬14號中MDA含量分別比對照降低了24.29%,11.55%,處理8 d則分別降低了27.50%,18.45%。鹽脅迫增加了番茄幼苗葉片內MDA的含量,處理4 d時白果強豐和江蔬14號中MDA含量分別比對照增加了50.29%,68.91%;處理8 d時分別升高了68.17%,106.55%。鹽脅迫下噴施Spd能降低番茄幼苗葉片內MDA的含量,處理4 d測定白果強豐和江蔬14號兩個品種中MDA含量分別比鹽脅迫處理降低了22.81%,33.71%;處理8 d時兩個品種分別降低了48.25%,49.17%。說明鹽脅迫下番茄幼苗葉片膜脂過氧化程度加重,并隨鹽脅迫時間的延長傷害程度增大;噴施Spd能顯著降低番茄幼苗葉片MDA的含量,即降低膜脂過氧化程度。
2.4 外源Spd對番茄幼苗葉片游離脯氨酸(Pro)含量的影響
試驗結果(圖3)顯示,鹽脅迫處理的番茄幼苗Pro含量明顯升高,白果強豐和江蔬14號兩品種在4 d,8 d時Pro含量分別比對照升高了58.31%,39.30%,112.73%,15.60%。非鹽條件下噴施Spd能降低番茄幼苗葉片內Pro的含量,白果強豐和江蔬 14號兩品種在處理 4 d,8 d時Pro的含量分別比對照降低了26.69%,37.34%,50.79%,79.78%。在鹽脅迫下外源Spd能使葉片Pro的含量明顯降低,白果強豐和江蔬14號兩品種在處理4 d,8 d時的Pro含量分別比對照降低了37.44%,30.60%,47.67%,30.89%。 說明鹽脅迫下番茄幼苗葉片中Pro含量增加,外源Spd能降低Pro的含量,減小鹽脅迫對植物體的傷害程度。
2.5 外源Spd對番茄幼苗葉綠素含量的影響
試驗結果(圖 4,5)表明,在處理 4 d時,在非鹽脅迫下外源Spd在一定程度上提高了白果強豐和江蔬14號的葉綠素a、b含量,其中白果強豐幼苗的葉綠素 a、b的含量分別比對照增加了10.35%,13.82%;江蔬14號幼苗的葉綠素 a、b的含量分別比對照增加了13.74%,15.07%;鹽脅迫增加白果強豐幼苗的葉綠素a、b的含量,分別比對照增加了44.43%,41.09%;江蔬14號幼苗葉綠素b增加了6.38%,而葉綠素a含量降低了4.55%。鹽脅迫下外源Spd降低了白果強豐幼苗的葉綠素a、b的含量;在一定程度上增加了江蔬14號幼苗葉綠素a、b的含量。處理后8 d的結果顯示,非鹽脅迫下外源Spd降低了葉綠素a、b的含量。鹽脅迫處理提高了番茄幼苗的葉綠素a、b的含量。鹽脅迫下外源Spd對抗鹽性較強的白果強豐幼苗影響很小,而對江蔬14號幼苗的葉綠素a、b的含量則有一定的降低,分別比單獨鹽處理的降低了25.38%,21.65%。
3 小結與討論
植物耐鹽性是多基因控制的復合遺傳性狀,同時也受生長環境的影響。試驗結果表明,噴施外源Spd能降低鹽脅迫下番茄幼苗葉片的相對電導率、MDA含量、Pro含量,減少鹽脅迫對細胞結構和生理生化反應的傷害,提高根冠比,增加了植物的耐鹽性。但是對干物質積累量,葉綠素a、b的含量也有明顯的影響,因處理時間和品種不同而產生不同的作用效果。鹽脅迫對抗鹽性較強的白果強豐影響較小,對耐鹽性較弱的江蔬14號影響較大,而外源Spd的效果在耐鹽性較弱的品種上更明顯。胡曉輝等[10~13]的研究也表明,通過Spd浸種可以改善鹽脅迫下番茄種子發芽、幼苗的耐鹽性。這也更充分證明Spd可以作為有效的外源物質,應用在番茄生產上。
植物體是一個相互聯系的綜合體,各種生命活動是相互影響的,因此需要對植物體生理途徑進行綜合研究,闡明之間的聯系。目前對多胺代謝及外源應用做了大量的研究,而對于外源Spd對植物體的調控作用機理還沒有從內在機制闡明,仍然需要從生理和分子水平繼續做深入的研究。
[1]趙可夫.植物抗鹽生理[M].北京:中國科學出版社,1993:1-5.
[2]Zhu J K.Plant salt tolerance[J].Trends in plant science,2001(6):66-71.
[3]Groppa M D,Benavides M P.Polyam ines and abiotic stress:recent advances[J].Amino Acids,2008,34(1):35-45.
[4]Bouchereau A,Aziz A,Larher F,et al.Polyam ines and environmental challenges:recent developments[J].Plant Science,1999,140(2):103-125.
[5]李憬,郭世榮,胡曉輝.外源亞精胺對低氧脅迫下黃瓜根系多胺含量和呼吸代謝酶活性的影響[J].西北植物學報,2006,26(1):92-97.
[6]宋士清,賀字典,郭世榮,等.外源亞精胺對黃瓜幼苗鹽脅迫逆境的誘抗作用機理 [J].河北科技師范學院學報,2006,20(3):1-6.
[7]王素平,賈永霞,郭世榮,等.多胺對鹽脅迫下黃瓜(Cucumis sativusL.)幼苗體內 K+、Na+和 Cl-含量及器官間分布的影響[J].生態學報,2007,27(3):1 122-1 129.
[8]Majerus V,Bertin P,Lutts S.Effects of iron toxicity on osmotic potential,osmolytes and polyam ines concentrations in the African rice(Oryza glaberrimaSteud.)[J].Plant Science,2007,173(2):96-105.
[9]郝再彬,蒼晶,徐仲.植物生理實驗[M].哈爾濱:哈爾濱工業大學出版社,2004:104-108.
[10]胡曉輝,王素平,曲斌.NaCl脅迫下亞精胺對番茄種子萌發及幼苗抗氧化系統的影響[J].應用生態學報,2009,20(2):446-450.
[11]胡曉輝,鄒志榮,楊振超.亞精胺對鹽脅迫下番茄種子萌發的影響[J].北方園藝,2009(7):1-3.
[12]胡曉輝,杜靈娟,鄒志榮.Spd浸種對鹽脅迫下番茄(Solanum lycopersicum)幼苗的保護效應[J].生態學報,2009,29(9):5 152-5 157.
[13]胡曉輝,鄒志榮,楊振超,等.Spd誘導NaCl脅迫下番茄種子萌發和幼苗耐鹽性效應研究[J].北方園藝,2009(10):5-8.

