鹽酸青藤堿延遲起釋型緩釋片釋藥的處方和工藝影響因素
耿燕娜, 張 瑜
(1.河南大學藥物研究所,河南 開封475004;2.河南大學淮河醫院,河南開封475000)
口服擇時釋藥系統是近年來發展的新型控釋制劑,選擇在疾病發作的時候,在預定的時間內自動釋放有效劑量的藥物,從而保證療效,降低藥物毒副作用,提高病人順應性[1],主要包括擇時緩釋釋藥和擇時脈沖釋藥兩大類,其中擇時緩釋釋藥具有時滯后緩慢釋藥特性,可實現擇時釋藥,同時在較長時間內維持穩定的血藥濃度,減少用藥次數,因此,成為口服擇時釋藥系統研究的熱點。關節炎及類風濕性關節炎患者的關節僵硬呈現晝夜節律變化,在凌晨3點左右加重,俗稱“晨僵”[2]。如果患者在睡前服用延遲起釋型緩釋制劑,藥物在預定的滯后時間(疾病發作前)釋放,可有效預防和治療疾病,并且時滯后藥物緩慢釋放,長時間有效維持平穩血藥濃度,減少藥物可能引發的副作用。鹽酸青藤堿是從中藥青風藤中提取的有效生物堿單體,藥用多為其鹽酸鹽,主要用于治療風濕、類風濕性疾病,療效顯著[3]。本文以干法包衣技術制備鹽酸青藤堿延遲型緩釋片,考察片芯骨架材料的種類(HPMC K15M、HPMC K4M、黃原膠和卡拉膠)和用量、外層衣膜骨架材料的種類和用量、衣膜材料制備工藝、緩釋片硬度等因素對制劑釋藥情況的影響,為制備符合時辰治療要求的鹽酸青藤堿延遲型緩釋片提供實驗基礎。
1 儀器與藥品
RCZ—8A智能藥物溶出儀(天津大學精密儀器廠);UV-2000型紫外可見分光光度計(尤尼柯上海儀器有限公司);17沖旋轉式壓片機(上海天和制藥機械廠);78X片劑四用測定儀(上海黃海藥檢儀器廠);鹽酸青藤堿(西安賽邦醫藥科技有限公司,純度98%以上,批號20070802);羥丙基甲基纖維素(HPMC K15M、HPMC K4M,上海 colorcon公司贈送);卡拉膠(CKC101,成都協力魔芋科學種植加工園有限公司);黃原膠(山東阜豐發酵有限公司);其它輔料均為藥用級。
2 方法和結果
2.1 鹽酸青藤堿延遲起釋型緩釋片的制備
2.1.1 片芯的制備 將鹽酸青藤堿與骨架材料、淀粉等輔料混合均勻,采用粉末直接壓片法制備7 mm平沖片芯(每片含鹽酸青藤堿120 mg,片重180 mg)。
2.1.2 外層衣膜材料的制備 濕法制粒:將骨架材料、淀粉等輔料混合均勻,加入適量15%聚乙烯吡咯烷酮(w/v)乙醇溶液制軟材,過40目篩制粒,50℃干燥,整粒,加入1%(w/w)滑石粉,混合均勻,備用。
粉末直接混合:將骨架材料、淀粉及處方中其他輔料混勻,備用。除考察包衣層衣膜材料制備工藝影響外,其他影響因素考察時均采用粉末直接混合制備衣膜材料。
2.1.3 延遲緩釋片的制備 將半量的外層衣膜材料置10 mm沖模中,鋪平;然后將鹽酸青藤堿片芯置于模孔中央,輕壓使片芯一半進入衣膜層中,再將半量衣膜材料加入沖模中,壓片,即得(外層衣膜重270 mg)。
2.2 標準曲線的制備 精密稱取干燥至恒重的鹽酸青藤堿對照品適量,用純化水稀釋配制系列濃度鹽酸青藤堿溶液(分別為 2.03、4.06、8.12、16.24、32.48、48.72 mg/L),在265 nm 波長處測定吸光度,以吸光度A對濃度C進行線性回歸,得標準曲線方程:

表明在純化水中,鹽酸青藤堿濃度在2.03~48.72 mg/L內,吸光度與其濃度間線性關系良好。
2.3 體外釋放度的測定 取鹽酸青藤堿延遲緩釋片,按《中國藥典》(2005版)二部附錄XC項下第一法(轉籃法),以新鮮脫氣純化水為釋放介質,體積500 mL,轉速(100 ±1)r/min,溫度(37 ±0.5)℃,分別于 2、4、5、6、7、8、9、10、12、15 和 24 h 取樣 5 mL(同時補充等量新鮮介質),濾過,取續濾液適當稀釋后于265 nm波長處測定吸光度,計算藥物累積釋放百分數。
2.4 延遲緩釋片釋放度數據處理
2.4.1 釋藥曲線相似性評價 目前,對于藥物釋放曲線的相似性評價,多采用由Moore和Flanner提出的相似因子(f2)法,此法已被FDA指導原則所采用[4]。f2值的計算公式如下:

2.4.2 釋藥時滯的計算 對于擇時釋藥系統,通常用藥物累積釋放達10%的時間代表藥物開始釋放時間,即釋藥時滯Tlag[5]。體外釋放度測定發現,各制劑的藥物釋放曲線均呈S型,因此,采用統計軟件SPSS16.0對釋藥曲線進行擬合,并根據擬合公式計算得出釋藥時滯(Tlag),并對各因素水平的Tlag進行t檢驗,評價各因素水平對Tlag的影響。
3 延遲緩釋片體外釋藥的影響因素研究
3.1 片芯骨架材料的影響 固定衣膜處方和片芯中其它輔料不變,分別采用黃原膠、卡拉膠、HPMC K15M和HPMC K4M作為片芯骨架材料(用量均為片芯重量的20%),制備緩釋片,測定體外釋放度,結果見圖1。

圖1 片芯骨架材料種類對藥物釋放的影響
由圖1可知,不同片芯骨架材料(分別為黃原膠、卡拉膠、HPMC K15M和HPMC K4M)緩釋片的釋藥時滯分別為(4.4882 ±0.0648)h、(4.2663 ±0.0388)h、(4.1595 ± 0.0357)h 和(4.0308 ±0.1163)h,以HPMC K15M為對照,進行統計分析。結果發現,HPMC K4M和HPMC K15M的釋藥時滯無差異(P>0.05),但時滯后的藥物釋放有差異(f2值為47.4),HPMC K4M作為骨架材料的緩釋片釋放較快,15h時藥物已基本釋放完全,這與HPMC K4M黏度較低,溶蝕快有關,而HPMC K15M為骨架材料的緩釋片可在24 h內緩慢釋放,達到每天服藥一次的設計要求;骨架材料為卡拉膠和黃原膠時,藥物的釋藥時滯有顯著性差異(P<0.05),對時滯后的藥物釋放無差異(f2值分別為69.7和64.0),但釋藥24 h后藥物仍未完全釋放,這與鹽酸青藤堿本身帶正電荷,黃原膠和卡拉膠兩種材料均帶負電荷,骨架材料可能通過靜電吸附而影響藥物完全釋放有關[6,7]。
3.2 片芯中骨架材料用量的影響 固定包衣層,改變片芯中HPMC K15M的用量(分別為片芯重量的10%、15%、20%),制備緩釋片,測定體外釋放度,結果見圖2。

圖2 片芯中HPMC K15M用量對藥物釋放的影響
由圖2可知,不同片芯HPMC K15M用量(分別為10%、15%、20%)的緩釋片的釋藥時滯分別為(3.6795 ± 0.0703)h、(3.7950 ± 0.1963)h 和(4.1595 ±0.0358)h,以 20%用量為對照,進行統計分析。結果發現,片芯骨架材料的用量對釋藥時滯有顯著性影響(P<0.05),并且時滯后的藥物釋放有影響,隨其用量增加,時滯延長。緩釋片釋藥過程中,隨著外層衣膜的溶蝕,釋放介質滲入片芯,片芯藥物溶解后,擴散通過凝膠層釋放,當片芯骨架材料用量增加時,骨架材料遇水形成凝膠層強度增加,藥物擴散釋放受阻,釋藥時滯延長,同時藥物釋放速度減慢。
3.3 衣膜中骨架材料種類的影響 固定片芯和衣膜中其他輔料不變,分別用黃原膠、卡拉膠、HPMC K15M、HPMC K4M作為衣膜的骨架材料(用量均為衣膜重量40%)制備緩釋片,測定體外釋放度,結果見圖3。
由圖3可知,不同衣膜骨架材料(分別為卡拉膠、HPMC K4M、黃原膠和HPMC K15M)的緩釋片釋藥時滯分別為(1.4394 ±0.0071)h、(3.0437 ±0.4597)h、(3.8278 ± 0.1910)h 和(4.1595 ±0.0358)h,以HPMC K15M為對照,進行統計分析。結果發現,骨架材料種類對時滯有顯著性差異(P<0.05),并且對時滯后藥物釋放也有影響(f2值分別為26.6、36.5 和49.4)。其中卡拉膠形成的凝膠強度弱,外層衣膜很快溶蝕,時滯短,并且卡拉膠與藥物可發生電荷靜電相吸作用,影響其完全釋放;HPMC K4M、黃原膠和HPMC K15M則存在明顯的釋藥時滯,其中黃原膠與卡拉膠一樣,會影響藥物的完全釋放,而HPMC不影響藥物的完全釋放,但不同規格HPMC的釋藥情況有所不同,HPMC K15的黏度高于HPMC K4M,釋藥時滯延長,這與衣膜凝膠強度增加,其溶蝕減慢,影響介質滲入片芯溶解藥物有關,并且衣膜凝膠層的強度增加,藥物釋放有所減慢。

圖3 衣膜中骨架材料種類對藥物釋放的影響
3.4 衣膜中骨架材料用量的影響 固定片芯,改變衣膜中HPMC K15M的用量(分別為衣膜重量的20%、30%、40%)制備緩釋片,測定體外釋放度,結果見圖4。

圖4 衣膜中HPMC K15M用量對藥物釋放的影響
由圖4可知,衣膜中不同HPMC K15M用量(分別為衣膜重量的20%、30%和40%)緩釋片釋藥時滯分別為(2.8788 ± 0.0224)h、(4.1595 ± 0.0358)h和(4.7997 ±0.0903)h,以 30%用量為對照,進行統計分析。結果發現,HPMC K15M的用量對時滯有顯著差異(P<0.05),隨著HPMC K15M用量的增加,釋藥時滯延長,這與衣膜中骨架材料用量增加,形成的凝膠層強度增加,不易溶蝕,釋放介質不易滲入片芯,藥物開始釋放時間延長有關[8,9],同時釋藥速率隨HPMC K15M用量增加而降低趨勢減緩,釋放曲線相似程度增加(表現為HPMC K15M用量20%與30%比較,f2值為28.2,30%與40%比較,f2值為64.3)。提示,通過調整衣膜中骨架材料用量,可實現不同釋藥時滯,并影響時滯后的藥物釋放。
3.5 衣膜材料制備工藝的影響 固定處方組成,分別采用不同衣膜材料制備工藝制備緩釋片,測定體外釋放度,結果見圖5。
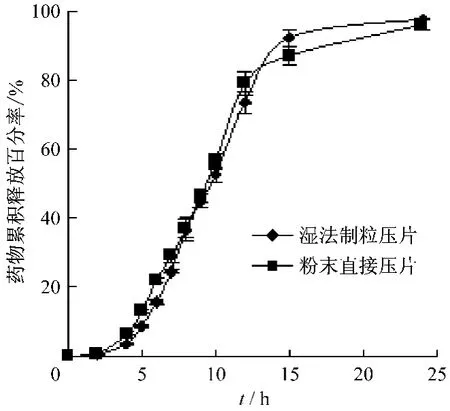
圖5 衣膜材料制備工藝對藥物釋放的影響
由圖5可知,濕法制粒壓片和粉末直接壓片的釋藥時滯分別為(4.2910 ±0.1025)h 和(4.1595±0.0358)h,進行統計分析,結果發現,衣膜材料制備工藝對釋藥時滯無顯著性影響(P>0.05),并且不影響釋藥速度(f2值為67.4)。提示,可根據輔料的性質和生產條件選擇相應的制備工藝進行生產操作。
3.6 壓力的影響 固定處方組成,制備不同硬度分別為(4±1)、(7±1)、(10±1)kg的緩釋片,測定體外釋放度,結果見圖6。
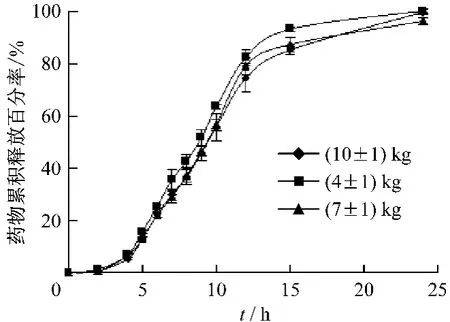
圖6 壓力對藥物釋放的影響
由圖6可知,壓力由小到大緩釋片的釋藥時滯分別為(3.7693 ±0.0357)h、(4.1595 ±0.0358)h和(4.1996±0.0984)h,其中(4±1)kg與(7±1)kg的緩釋片釋藥時滯有顯著性差異(P<0.05),(7±1)kg與(10±1)kg的緩釋片釋藥時滯無顯著性差異(P>0.05),這與壓力增大,造成衣膜材料的凝膠強度增加,溶蝕速率減慢有關,尤其當壓力較小時更為明顯,當壓力增大到一定范圍(7±1)kg時,釋藥時滯變化不明顯;壓力對釋藥時滯后的藥物釋放無影響(f2值分別為66.6和81.0)。
4 討論
鹽酸青藤堿延遲起釋型緩釋片的體外釋藥過程為:外層衣膜表面的骨架材料遇水形成凝膠層,介質滲入較慢,衣膜內側和片芯仍保持干燥,片芯藥物沒有釋放,存在釋藥時滯;隨著釋藥過程進行,衣膜中骨架材料逐漸水化溶蝕并不斷剝落,凝膠層溶蝕變薄,介質滲透進入片芯,藥物溶解后,擴散通過外層凝膠衣膜釋放,同時隨著介質不斷滲入片芯,片芯骨架材料遇水凝膠化,與外層未完全溶蝕的衣膜凝膠層混為一體,有效控制片芯藥物的緩慢釋放;釋藥后期,整個制劑的骨架材料完全水化,并且溶蝕加劇,藥物幾乎完全釋放出來。在處方工藝設計時,應考慮各因素對制劑的釋藥延遲情況和時滯后藥物的緩慢釋放兩方面的影響,其中外衣層膜的溶蝕速率是決定制劑釋藥時滯的關鍵,而衣膜溶蝕速度與衣膜中骨架材料種類和用量有關,衣膜和片芯中骨架材料種類和用量對時滯后藥物的釋放影響較大,提示可通過上述因素調節制劑的擇時釋藥時間和釋藥速度,以滿足制劑時辰治療的設計要求。
[1]張立超,胡晉紅,朱全剛,等.疾病的晝夜節律及脈沖給藥系統[J].中國醫院藥學雜志,2000,20(12):738-739.
[2]何紹雄.時間藥理學與時間治療學[M].天津:天津科學技術出版社,1994:259-268.
[3]劉 強,周莉玲,李 銳.青藤堿的研究概況[J].中草藥,1997,28(4):247-249.
[4]Moore J W,Flanner H H.Mathematical comparison of dissolution profiles[J].Pharm Technol,1996,20(1):64-73.
[5]范田園,魏樹禮,嚴文偉,等.鹽酸地爾硫卓爆破型脈沖控釋片研究[J].藥學學報,2002,37(3):221-225.
[6]劉 凌,薛 毅,王亞南,等.κ-卡拉膠膠凝特性研究[J].鄭州輕工業學院學報,1999,14(1):65-68.
[7]王學艷,趙振宇,寇 欣,等.黃原膠的性質及其在制劑中的應用[J].中國藥學雜志,1996,31(10):581-583.
[8]王寶慶,陸新漢,唐 星,等.烏拉地爾HPMC骨架片的研制及釋放度的考察[J].沈陽藥科大學學報,2001,18(1):5-8.
[9]董志超,蔣雪濤.羥丙基甲基纖維素的性質對藥物親水性骨架片溶出度的影響[J].藥學學報,1994,29(12):920-924.