腸必清栓對UC模型大鼠腸黏膜內IL-1β、TNF-α及SOD的影響
馬建華,鄭繪霞,趙玉澤,趙正保
(1.山西醫科大學藥學院藥化教研室,山西太原 030001;2.山西醫科大學附屬第一醫院病理科,山西太原 030001;3.山西醫科大學兒科系,山西太原 030001)
潰瘍性結腸炎(ulcerative colitis,UC)的病因和發病機制尚未完全明確,已知腸道黏膜免疫系統在UC腸道炎癥發生、發展、轉歸過程中始終發揮重要作用。細胞因子參與免疫反應和炎癥過程,腸道黏膜免疫系統中促炎性細胞因子與抗感染細胞因子之間的平衡失調所致的免疫異常是UC的重要發病機制[1],而促炎性細胞因子IL-1和TNF-α是公認的能介導UC發病的細胞因子[2-3]。另外,UC腸黏膜炎癥導致的損傷可能是活性氧的作用結果[4],有研究認為抗感染作用的主要機制是抗脂質過氧化,抗氧化治療如應用SOD或增強SOD活性均能有效防治結腸黏膜損傷[5]。本實驗旨在通過觀察新藥腸必清栓[6]對UC模型大鼠腸組織中細胞因子IL-1β、TNF-α、抗氧化反應的酶SOD表達的影響,從細胞因子角度進一步探討其治療UC的免疫學機制和抗感染、抗氧化的作用機制,為腸必清栓治療UC提供一定的實驗基礎和理論依據。
1 材料與方法
1.1 材料
健康 SD大鼠 54只,雌雄各半,體重(200±20)g,購自山西醫科大學實驗動物中心;柳氮磺吡啶原料由山西三九同達藥業有限公司提供;腸必清栓由本實驗室自制;IL-1(批號:BA0962200905)、SOD 抗體(批號:BA1401200905),SABC 免疫組化檢測試劑(批號:SA2002200905)購自武漢博士德生物工程有限公司;TNF-α 抗體(批號:J1608200904)、PV-9000二步法免疫組化檢測試劑(批號:K96712E200904)購自北京中杉金橋生物工程有限公司。
1.2 方法
1.2.1 大鼠UC模型的建立及分組治療 用2,4-二硝基氯苯免疫加醋酸局部灌腸法造模后將48只大鼠隨機分為五組:模型對照組(A 組,8 只),腸必清栓低、中、高劑量組(B、C、D組,各 10 只),柳氮磺吡啶(SASP)藥物對照組(E 組,10 只),另設正常對照組(F組,6只)。A、F組給予等量的不含藥物的空白基質,B、C、D 組分別按 160、320、640 mg/(kg·次)給藥,E組按300 mg/(kg·次)給藥,1次/d。給藥2周后將實驗大鼠全部處死取結腸組織,中性福爾馬林固定,病理切片做免疫組化染色。
1.2.2 細胞因子IL-1β、TNF-α、SOD檢測 采用免疫組化法,按試劑盒說明書操作, 其中一抗濃度分別為1∶100、1∶100、1∶200。染色結果以細胞質、胞核出現棕黃色顆粒為陽性。IL-1β、SOD采用BI-2000圖像分析系統對染色結果進行定量分析,在400倍視野下選取5個陽性顆粒清晰、無非特異性染色的視野,測定其灰度值;TNF-α參照Fromowitz半定量法計分[7],陽性細胞率<0.05為0分,0.05~0.25為1分,0.26~0.50為2分,0.51~0.75為3分,>0.75為4分;胞質染色陰性為0分,淺黃色為1分,棕黃色為2分,棕褐色為3分,將前兩個分數相加,每個標本取5個視野進行評分后取其均值。
1.3 統計學處理
用SPSS 16.0軟件進行分析。評分數值應用均數±標準差()表示,多組均數比較采用單因素方差分析,均數的兩兩比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結果
腸必清栓對UC大鼠結腸組織中細胞因子IL-1β、TNF-α、SOD表達的影響:模型組和給藥組大鼠結腸組織中IL-1β、SOD呈彌散性分布,在黏膜上皮均有表達,主要分布于黏膜腺體內及間質炎性細胞胞質;TNF-α在黏膜層間質表達,圍繞炎性細胞核呈團塊狀的胞質表達,模型組見少量胞核著色。模型組大鼠腸組織中IL-1β、TNF-α表達顯著增多(P<0.01),而SOD顯著減少(P<0.01),給藥治療可明顯降低IL-1β、TNF-α的表達;腸必清栓低、中、高劑量組間呈劑量依賴關系,且三組間差異顯著,高劑量組與柳氮磺吡啶藥物對照組間差異無統計學意義(P>0.05);SOD在模型大鼠腸組織中僅少量表達,給藥治療可提高模型大鼠SOD的表達,腸必清栓中、高劑量組、柳氮磺吡啶藥物對照組和正常組間差異無統計學意義(P>0.05)。見表 1。
3 討論
UC腸道炎癥與黏膜免疫系統中細胞因子的失衡和抗氧化系統的失衡有關。細胞因子失衡表現為炎性細胞因子異常增多而抑炎性細胞因子異常減少或相對不足[8-9]。因此,近幾年細胞因子成為UC發病與治療研究中的熱點,其中促炎性因子,如 IL-1、TNF-α、IL-8、IL-15、IL-16、IL-17、IL-18 等,參與細胞免疫反應,與炎癥有關;抗炎性細胞因子主要由T細胞產生,如 IL-10、白介素-1 受體拮抗劑(IL-1ra)、IL-4、IL-11、IL-13等,參與體液免疫反應,在維持機體正常免疫系統中起重要作用[10-11]。研究認為,UC中導致組織損傷的急性炎癥很大程度上是由TNF-α和IL-1β的強大生物活性造成的[2-3]。
表1 腸必清栓對UC大鼠結腸組織中細胞因子IL-1β、TNF-α、SOD表達的影響()Tab.1 Effects of Changbiqing Suppository on the expression of IL-1β,TNF-α and SOD in colonic mucosa of rats with ulcerative colitis()
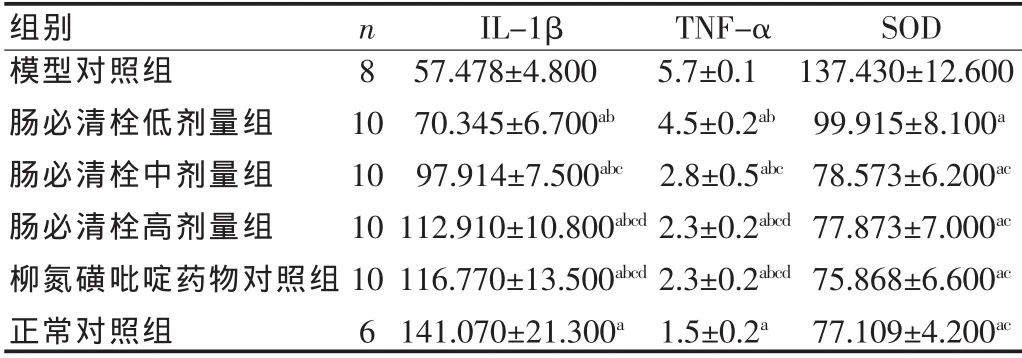
表1 腸必清栓對UC大鼠結腸組織中細胞因子IL-1β、TNF-α、SOD表達的影響()Tab.1 Effects of Changbiqing Suppository on the expression of IL-1β,TNF-α and SOD in colonic mucosa of rats with ulcerative colitis()
與模型對照組比較,a P<0.01;與正常對照組比較,b P<0.01;與腸必清栓低劑量組比較,c P<0.01;與腸必清栓中劑量組比較,d P<0.01Compared with UC model group,a P<0.01;compared with normal control group,b P<0.01;compared with Changbiqing Suppository low dose intervention group,c P<0.01;compared with Changbiqing Suppository moderate dose intervention group,d P<0.01
組別n IL-1βTNF-αSOD模型對照組857.478±4.8005.7±0.1137.430±12.600腸必清栓低劑量組1070.345±6.700ab 4.5±0.2ab 99.915±8.100a腸必清栓中劑量組1097.914±7.500abc 2.8±0.5abc 78.573±6.200ac腸必清栓高劑量組10112.910±10.800abcd 2.3±0.2abcd 77.873±7.000ac柳氮磺吡啶藥物對照組10116.770±13.500abcd 2.3±0.2abcd 75.868±6.600ac正常對照組6141.070±21.300a 1.5±0.2a 77.109±4.200ac
IL-1是重要的免疫調節因子和炎癥介質,它促進淋巴細胞增殖,分泌細胞因子,參與輔助抗原提呈細胞(APC)激活Th細胞,增強CTL的殺傷腫瘤細胞活性,增強NK細胞的殺傷腫瘤細胞活性,增強巨噬細胞的抗腫瘤作用,引起巨噬細胞趨化和合成 IL-1、IL-6、TNF-α、PGE2等;能誘導下丘腦血管內皮細胞膜磷脂釋放花生四烯酸,還能誘導內皮細胞中環氧化酶(cyclooxygenases)基因表達,促進骨髓釋放中性粒細胞誘導單核細胞和多核粒細胞趨化浸潤到炎癥局部,在局部釋放溶酶體酶,還可引起嗜堿粒細胞和肥大細胞脫顆粒,釋放炎癥介質等[12-13]。
TNF-α主要是由單核-巨噬細胞產生,其生物學活性非常復雜,參與免疫和炎癥的調節;可誘導IL-1增加,與IL-2協同促進T細胞產生IFN-γ,增強巨噬細胞的活性,促進免疫應答的能力和殺傷功能,對炎癥局部的中性粒細胞的活性和聚集也有促進作用,抑制B細胞增殖和分泌免疫球蛋白,可活化 NF-κB,誘導 IL-1、IL-6、IL-8 和 TNF 等基因轉錄,促進炎癥反應[9,11,13-14]。
近年來一些研究認為機體氧自由基(oxygen free radical,OFR)的形成和抗氧化系統的失衡在UC發病過程中起重要作用[14-15]。劉穎等[15]報道UC患者結腸黏膜中自由基水平明顯升高,抗氧化系統存在缺陷;鄧莉等[16]用三硝基苯磺酸(TNBS)誘導大鼠UC模型,潘洋等[17]采用二硝基氯苯和乙酸復合方法制備大鼠UC模型,均觀察到大鼠結腸組織中MDA含量顯著升高,SOD活性明顯下降。這些結果與研究的理論一致,進一步印證了UC患者及模型大鼠結腸黏膜中自由基水平升高而抗氧化系統存在缺陷。SOD和GSH-Px是生物體內氧自由基的天然清除劑。UC患者及模型大鼠腸組織中自由基的大量存在及抗氧化系統缺陷如SOD活性下降等,是造成自身組織損傷的關鍵,若用抗氧化治療,清除自由基或提高機體抗氧化酶的活性,能有效防止結腸黏膜損傷;而且,抗氧化劑包括N-乙酰半胱氨酸、SOD、過氧化氫酶、維生素E等可以抑制NF-κB的活化[18],從而間接抑制了由NF-κB轉錄的大量炎性細胞因子如IL-1、IL-6、IL-8和TNF的產生,最終起到減輕炎癥、保護自身組織損傷的作用。
UC的發病是多因素、多環節相互作用的結果,而細胞因子的作用并不是孤立的,是相互正負調節的復雜網絡。本實驗中,腸必清栓可顯著降低UC模型大鼠腸組織中促炎性細胞因子IL-1β、TNF-α的表達,而上調SOD的表達。通過抑制 IL-1β、TNF-α 的表達, 從而抑制 IL-1β、TNF-α 誘生的IFN-α/β、IL-1、IL-2、IL-6、IL-8 等多種炎性 CK 的生成,抑制TNF-α還能阻斷由TNF-α介導的NF-κB的活化,從轉錄水平減少炎癥因子 TNF-α、IL-1β、IL-6、IL-8、IL-12 等的表達,由此形成級聯反應;而SOD活性增強又可進一步抑制炎癥及損傷,從而影響細胞因子相互正性或負性調節的網絡。腸必清栓下調促炎性細胞因子的表達、增強組織中SOD的活性,在治療UC中發揮其免疫調節及抗感染、抗氧化作用。
[1]劉青梅,韓輔,陳曦.腸康飲對潰瘍性結腸炎大鼠血清IL-6、IL-10的影響[J].世界中西醫結合雜志,2008,3(5):266-267.
[2]趙旭東,張薇.潰瘍性結腸炎發病機制研究進展[J].現代醫藥衛生,2008,24(10):1501-1502.
[3]胡潔.Th1/Th2免疫應答與疾病[J].福建醫藥雜志,2000,22(3):118-120.
[4]余穎聰,鄭亮,張品南,等.鉀離子通道開放劑對潰瘍性結腸炎大鼠的作用研究[J].中國藥物與臨床,2008,8(12):967-968.
[5]陶弘武,柳越冬,李開明.潰結安康湯對潰瘍性結腸炎大鼠SOD影響的研究[J].遼寧中醫藥大學學報,2009,11(3):198-199.
[6]馬建華,鄭繪霞,趙玉澤,等.腸必清栓對UC模型大鼠治療作用的實驗研究[J].中國藥物與臨床,2010,10(2):150-152.
[7]郝俊鳴,江學良,佟艷銘.奧沙拉秦鈉對潰瘍性結腸炎一氧化氮合酶表達的影響[J].世界華人消化雜志,2005,13(19):2392-2394.
[8]陳英群,馬貴同.細胞因子與潰瘍性結腸炎相關性研究進展[J].中國中西醫結合消化雜志,2003,11(1):57-59.
[9]魏思忱,李春英.細胞因子與潰瘍性結腸炎治療的研究進展[J].國際消化病雜志,2008,28(5):380-2.
[10]高偉,司雁菱.腫瘤壞死因子-α、白介素-16、白介素-17在潰瘍性結腸炎患者外周血和結腸黏膜中的表達及意義[D].石家莊:河北醫科大學,2006.
[11]龔非力.醫學免疫學[M].2版.北京:科學出版社,2006:61-85.
[12]林平,伍楊,黃華,等.細胞因子與潰瘍性結腸炎[J].湖北民族學院學報:醫學版,2003,20(4):28-30.
[13]鐘燕敏.潰瘍性結腸炎與細胞因子[J].浙江實用醫學,2008,13(3):226-227.
[14]施穎琦.細胞因子在炎癥性腸病免疫調節中的研究進展[J].交通醫學,2009,23(3):310-312.
[15]劉穎,王瑩,齊正,等.甘草酸二銨抗大鼠潰瘍性結腸炎作用及相關機制研究[J].中國新藥雜志,2007,16(24):2027-2031.
[16]鄧莉,胡晉紅.化學誘導型結腸炎動物模型的研究進展[J].中國藥理學通報,2005,21(5):522-526.
[17]潘洋,張洪娟,吳屹波,等.青白栓抗大鼠潰瘍性結腸炎的實驗研究[J].中國中西醫結合消化雜志,2007,15(1):21-24.
[18]王麗珍,錢燕,盧洪勝,等.超氧化物歧化酶和U74389G對新生鼠高氧肺損傷的治療作用[J].溫州醫學院學報,2009,39(2):112-114.

