溴酸根在紫外和氯消毒聯用工藝中的形成
黃 鑫,高乃云,丁國際,盧 寧
(1.上海大學 環境與化學工程學院環境工程系,上海 200444;2.同濟大學污染控制與資源化研究國家重點試驗室,上海200092;3.上海城市水資源開發利用國家工程中心有限公司,上海 200082)
溴酸根(BrO3-)離子具有遺傳毒性和致癌性,被世界衛生組織列為2B類可疑致癌物[1]。中國飲用水標準中的限值是10μg/L(《生活飲用水衛生標準(GB 5749-2006)》)。BrO3-在水體環境中較穩定,即便達到煮沸溫度也不能分解。一旦形成后現有凈水工藝很難有效去除[2]。
除了工業污染的特例,天然水體中BrO3-含量很少。供水過程中最主要的來源是含溴離子原水在臭氧及其高級氧化過程中的形成。使用臭氧消毒的瓶裝水也含有一定濃度的溴酸根,視溴離子濃度和臭氧投加劑量而定[3]。據報道,在氯化海水過程中生成了相當數量的溴酸根,且陽光對于該過程中溴酸根離子的含量有顯著的影響[4]。前期實驗表明,純水體系中溴離子初始濃度100μg/L,在常規氯消毒(避光)劑量下并不會產生超標的溴酸根離子[5]。在前期研究基礎上,該文進一步考查UV輻照氯系消毒溶液(氯,氯胺和二氧化氯)時溴離子減少和溴酸根形成的變化過程。
1 材料與方法
1.1 UV輻照實驗
實驗使用自制平行光束測試儀(城市給排水紫外線消毒設備,GB/T 19837-2005),該裝置將紫外燈管安裝在封閉圓柱體內,筒體底部中央開口,下方接圓管,以達到產生平行紫外線的目的。管下一定高度放置玻璃培養皿,內盛45mL測試溶液,磁力轉子稍微攪拌以達到混合效果(圖1)。測試溶液按照需要在原水或去離子水中加入一定濃度的NaOCl,NH2Cl或ClO2,同時加入溴離子。去離子水中含2.5mmol/L磷酸鹽緩沖溶液(pH=7.2~7.6)以控制pH變化。
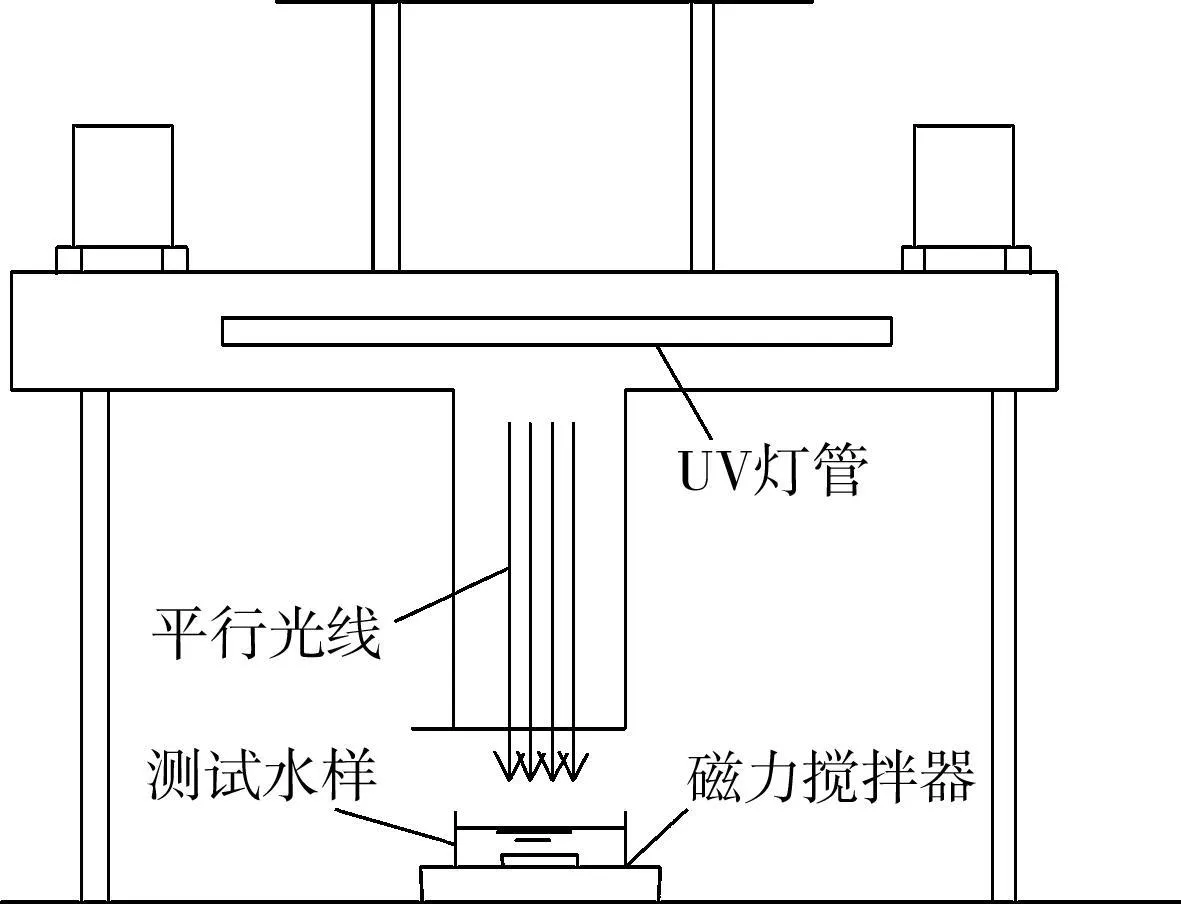
圖1 紫外光照裝置示意圖
紫外燈管購自上海金光特種光源有限公司,UVA(黑光燈)主波長360 nm,功率 12 W,UVC主波長254 nm,功率12 W。
1.2 試劑與原水水質
實驗中所用試劑均為分析純。使用Milli-Q去離子水,電導率小于1μS/cm,PH在6.3~6.5左右。NaOCl溶液使用前測定其中溴酸根的背景值。ClO2自配,采用 NaClO2、HAc和 NaAc 混合,純度>90%[6]。NH 2Cl的配制:按照質量濃度比Cl2:N=4:1混合NaOCl溶液和NH4Cl溶液,PH>9常溫下暗處靜置30min。原水取自某長江水源水廠沉淀池出水(2007年2月),0.45μm濾膜過濾后各水質參數見表1。
1.3 分析方法
紫外輻照計(北京師范大學光電儀器廠)測定玻璃皿中心點254 nm和360 nm光強。使用上海雷磁PHS-3C精密PH計測量溶液PH。總氯的測定采用DPD法,使用哈希公司的便攜式余氯儀(HACH Pocket Colorimeter)。二氧化氯濃度測定采用五步碘量法。

表1 某長江水源水廠沉淀池水質
各種陰離子的分析在戴安公司ICS-1000離子色譜儀上進行(恒溫電導檢測器,Ion Pac AS19高容量陰離子分析柱)。溴酸根和溴離子在0.005~10mg/L濃度范圍內線性良好,溴酸根離子的可靠檢測限為1.5μg/L,線性相關系數R2>0.99。
采用擬一級反應動力學方程擬合總氯在光輻照下的分解:

2 結果與討論
2.1 UVC和Cl2,NH2 Cl聯用生成 BrO3-的效果
長江原水背景下,5mg/L的氯和氯胺(以總氯計)在UVC作用下的分解可用擬一級反應速率方程較好的擬合,其中氯胺的分解稍低于自由氯(圖2(a)),這和文獻報道一致[7]。Ormeci使用 UVC分解1~5mg/L的氯和氯胺,發現前者可用零級和一級反應擬合,后者只可用一級反應擬合,氯胺的分解速率要慢于自由氯[7]。事實上,自由氯在 UVC照射下促成一系列復雜的光化學反應,產生 Cl?、OH?、ClO2-等中間產物;而氯胺的分解更為復雜,最終產物包括Cl-、ClO3-、NO3-等[8-9]。
隨著UVC幅照時間的增加,溴酸根離子的量逐漸增加,30min達到10μg/L以上。而將自由氯改為氯胺時,溴酸根的生成量較少,30min后在3 μg/L左右。推測氯氨和UVC聯合作用不能將Br-氧化成BrO3-,實驗中生成 3.08μg/L BrO3-可能是氯胺溶液中少量游離氯所致。
空白實驗表明,紫外輻照90min原水溶液,溴離子濃度基本不變。UVC/Cl2與UVC/NH 2Cl二者生成溴酸鹽性能的差異或可用次溴酸生成與否進行解釋。次溴酸是氧化反應鏈中生成溴酸鹽的重要中間產物。原水偏堿性時(PH=7.34),自由氯可迅速將溴離子氧化為次溴酸(PKa=8.69)[11]。BrO-溶液堿性條件下經UVC照射可分解成BrO3-和Br-,二者比例大約是1∶4[10]。圖2(b)中自由氯和UV聯用時按最終的生成量計算BrO3-和Br-比值約為1∶5,較為接近。而氯氨幾乎不能氧化溴離子。

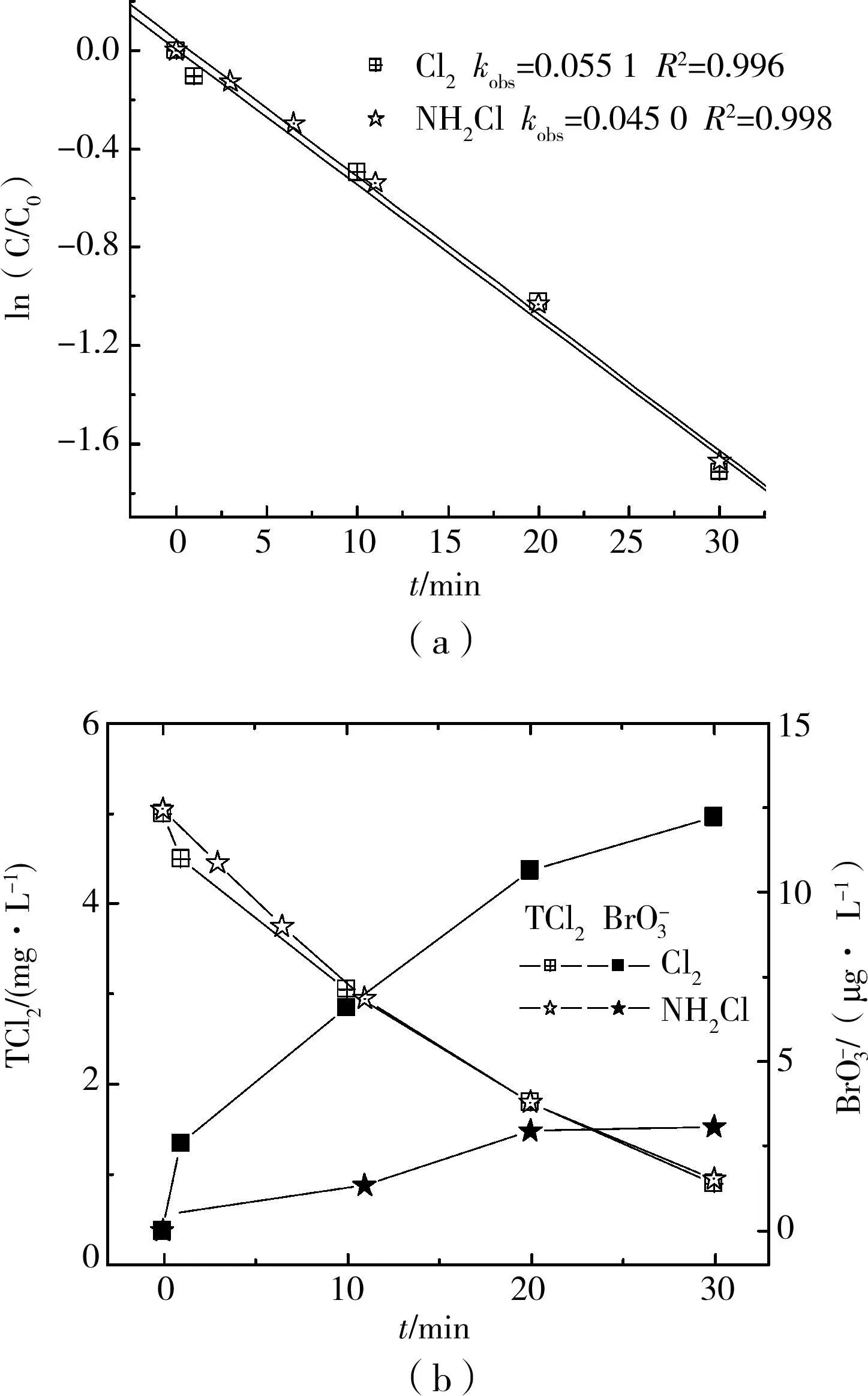
圖2 UVC和Cl2、NH2 Cl聯用處理含溴長江原水
遮光預實驗顯示,5mg/L的氯和氯胺在長江水中的半衰期大約為1 d。避光條件下,堿性溶液中次氯酸和次溴酸混合溶液中緩慢發生交叉氧化反應(cross-oxidation),產物為溴酸根和氯酸根。

但上述反應的速率常數比較小,前期的實驗也表明需要數日才能觀測到一定濃度的溴酸根(<10μg/L)[5]。而UV照射實驗只有短短幾十分鐘,因此這種自氧化現象不大可能是溶液中溴酸根生成的主要原因。
2.2 NH3對UVC/Cl2聯用生成BrO3-的抑制作用
圖3(a)可見,去離子水背景下自由氯和化合氯的分解仍可用擬一級反應速率方程較好的擬合。自由氯的分解速度要稍高于化合氯(Cl2∶N=4∶1的2條曲線)。以上2點和原水實驗(圖2(a))的結論一致。Cl2∶N=10∶1溶液中的總氯分解速度高于其它3條曲線。這是由于此條件處于加氯曲線的“折點”附近,此時氯氧化氨生成氮氣,消耗了一部分氯。而Cl2∶N=4∶1的溶液中氯和氨生成氯胺,所以總氯消耗少。
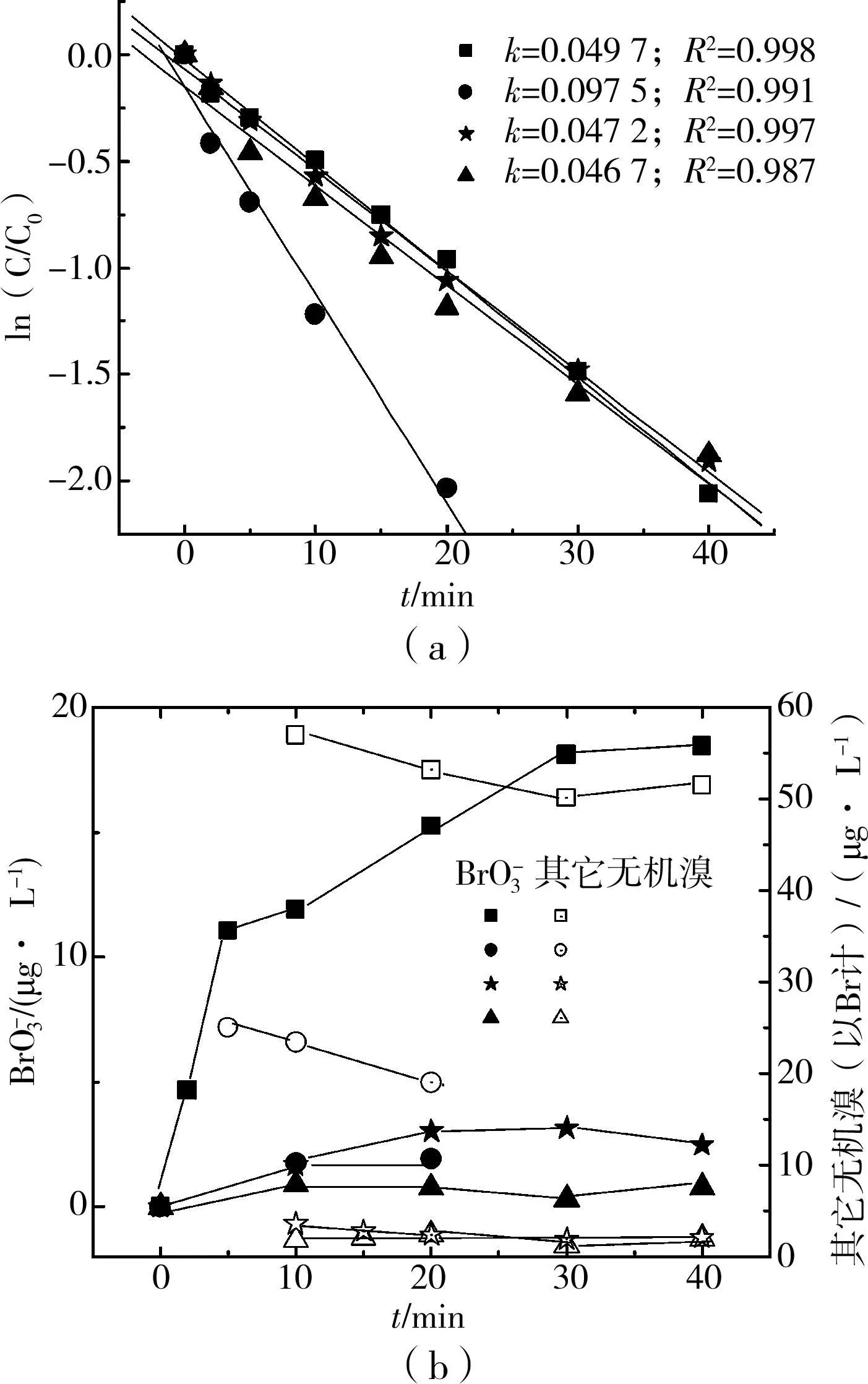
圖3 NH3對于UVC/Cl2過程中氯分解和溴酸根生成的影響
由于去離子水中不存在有機溴,可通過溴元素平衡估算其它價態的溴物質(推測主要以可被硫代硫酸鈉還原的HOBr為主)。實驗中NH 3對BrO3-的抑制作用明顯(圖2(b))。N-NH3≥0.5mg/L(Cl2∶N≤10∶1)時 BrO3-保持在3.5μg/L以下。而不加氨至實驗末產生了BrO3-18.5μg/L。圖3(b)還表明增加氨投量減小了中間價態溴元素。無氨時,中間態溴維持≥50μg/L;加入0.5mg/L左右氨,中間態溴在20~25μg/L之間,加入 1.2mg/L氨,中間態溴則基本沒有。氨和次溴酸可迅速反應[12]。
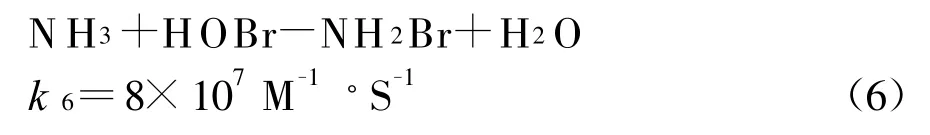
UVC作用下水中溴胺化合物可能快速分解生成含氮副產物和Br-。實驗中也發現溶液中溴離子的回收率很高(≥90%),且未觀察到明顯含量的中間態溴。所以氨濃度越高,中間態溴濃度越低。另外,NH 3在 UVC作用下可以迅速的被氧化成NO2-和NO3-。與BrO3-共存時NH3的光氧化過程可以大幅度加速BrO3-的光降解,可能是因為NH 3光氧化時產生和轉移了水合電子[13]。實驗中M(NH 3∶Br)≈30~70∶1,生成的 BrO3-可以迅速的被UV還原。
比較先加NH 3后加Cl2和先加Cl2后加NH 3 2種順序,二者總氯的分解速率幾乎一致,pH和溫度的變化范圍也幾乎一致。溴酸根的生成量前者要稍微高于后者(圖3(b))。這可從幾個反應的快慢程度加以解釋。
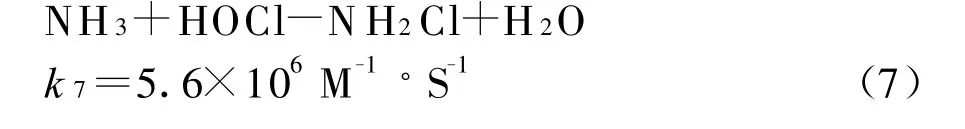
對于先加NH 3后加Cl2,由于事先溶液中已存在溴離子,因此相當于反應1和7之間的競爭,因為k7?k1,氨基本和次氯酸反應完全,溶液實際上是氯氨-溴離子共存體系。產生3.1μg/L的BrO3-可能是殘余的自由氯起了作用。對于先加Cl2后加NH3,是反應6和7的競爭,k6>k7,HOBr基本反應完全。因此BrO3-生成量幾乎測不出。
2.3 UVC、UVA和ClO2聯用生成 BrO3-的效果
同Cl2相比,ClO2/UV作用氧化Br-成BrO3-要困難的多。圖4反映了2種不同波長的UV光照下ClO2-H 2O-Br-體系的變化(去離子水背景)。盡管使用的UVA輻照能量約是UVC的一半,但是消耗的ClO2反而更多。因為ClO2在紫外區的最大吸收波長在360 nm左右(ε360=1 230m-1?cm-1),剛好處于UVA燈管的最大波長處,所以UVA照射下ClO2的分解要快于UVC[13]。BrO3-的生成量則正好相反,UVC的作用強于UVA,并且PH酸性條件下差別更加明顯。pH 2.87和4.81時,2種光輻照下ClO2的消耗量相近,但溴酸根產生量有較大差距。
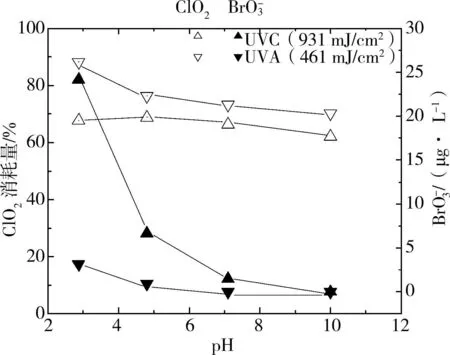
圖4 UVC、UVA和ClO2聯用處理溴離子溶液
實驗中酸性條件下溶液中除Br-和BrO3-還存在其它形態的溴(因數據較少,未在圖中標明),但中性和堿性時基本沒有。因為PH為7時,水體中ClO2氧化還原電位φ=0.95 V,不能氧化Br-成HOBr(k≤10-4m-1?S-1)。二氧化氯在酸性條件下消毒能力提高[14]。推測可能氧化還原電位的提高導致生成了一定濃度的HOBr,HOBr在UVC作用下發生歧化反應產生BrO3-。另外,UVA輻照產生溴酸根的量不高,可能與光能量有關,因為HOBr在270~360 nm之間隨波長減少摩爾吸光系數大幅度增加,在360 nm時吸收最小[13]。
PH=2~10時二氧化氯在水溶液中以分子形式存在,當PH>9時,二氧化氯發生緩慢水解。UV照射下二氧化氯分解的最終產物是ClO3-、H+、ClO-,因此PH偏酸性使得二氧化氯更不易光解。二氧化氯消毒的作用是產生了電子轉移。如前所述,因為充當了電子轉移的媒介,Br-可以使ClO2的分解鏈式反應繼續而不需要UV光輻照[15]。因此,可以推測充當了電子轉移媒介的溴元素,其自身的光氧化和歧化反應也得到了抑制,從而無法生成高價態的溴酸根。
2.4 光分解產物的作用
探究氯和二氧化氯在光解產生溴酸根能力上的區別,除了后者難氧化Br-成HOBr外,不同的光解氧化產物(secondary oxidants)可能也是重要的影響因素。氯在UVC作用下可以分解為一系列自由基包括Cl?和OH?。而羥基自由基可以參與促進整個反應鏈的進行[16]。液相中二氧化氯光分解物質也包括原子氧和原子氯,但羥基自由基可能很少。上述物質在溶液中的濃度和存在時間是影響溴酸根生成的重要因素。
Emmert使用中壓UV燈管(多波長)輻照含溴離子的ClO2水溶液,發現少部分溴離子轉化成溴酸根。但有關PH的結論和本文不一致:轉化率在中性時最低,堿性和酸性都有助于生成[17]。不同波長UV對于氯系消毒劑的影響是不同的。200~400 nm內,NH2Cl在波長250 nm左右具有最大摩爾吸光系數(ε≈420m-1?cm-1),此后隨波長增加急劇降低,到320 nm時基本降為零;OCl-在290 nm附近具有最大摩爾吸光系數(ε≈250m-1?cm-1),而HOCl在 240 nm 附近(ε≈80m-1?cm-1)。由于HOCl/OCl-的pKa=7.5,考慮二者在溶液中所占的比例和吸光系數的高低,當PH為7~8時,自由氯溶液的摩爾吸光系數在240 nm和290 nm分別具有一小一大2個峰值[17]。然而本實驗中NH 2Cl的分解速度還慢于Cl2,這可能是因為Cl2光分解產物Cl?與Cl2發生反應,加快了氯的分解。也有研究表明,Br-存在時,可以與ClO2發生光敏鏈式反應,使得關閉光照后,反應仍可以繼續進行。這些都說明,不同波長UV輻照下氯消毒劑的光解產物的組成可能有所變化。這使得波長的影響較為復雜。相關機理還有待進一步的研究。
3 結論
1)實驗條件下,原水和去離子水背景下自由氯和氯胺在UVC下的分解可用擬一級反應速率方程擬合(R2≥0.98)。
2)Cl2/UVC聯合作用可以氧化部分溴離子生成溴酸根離子,實驗條件下原水中產生12.2μg/L,去離子水中為18.5μg/L。
3)0.5mg/L以上的NH3可以有效的抑制BrO3-生成。氯和氨的投加先后順序對結果無明顯影響。NH 2Cl/UVC作用 Br-時幾乎不生成BrO3-。
3)ClO2/UVC產生 BrO3-的量高于ClO2/UVA。酸性條件同時促進BrO3-的產生和ClO2的分解。
[1]YAMAGUCHI T,WEIm,HAGIHARA N,et al.Lackofmutagenic and toxic effects of low dosEpotassium bromatEon kidneys in thEbig bluErat[J].Mutation Research/Genetic Toxicology and Environmentalmutagenesis,2008,29(1):1-11.
[2]BUTLER R,GODLEYN A,LYTTON L,et al.BromatEenvironmental contamination:review of impact and possiblEtreatment[J].Critical Reviews in Environmental SciencEand Technology,2005,35(3):193-217.
[3]LIU Y J,MOU S F.Determination of bromatEand chlorinated haloacetic acids in bottled drinking water with chromatographicmethods[J].Chemosphere,2004,55(9):1253-1258.
[4]MACALADY D L,CARPENTER JH,MOORECA.Sunlight-induced bromatEformation in chlorinated seawater[J].Science,1977,195(4284):1335-1337.
[5]HUANG X,GAO N Y,DENG Y.BromatEions formation in darkchlorination and ultraviolet(UV)/chlorination processes for bromide-containing water[J].Journal of Environmental Sciences,2008,20(2):246-251.
[6]趙明剛,郝愛友.穩定性二氧化氯的制備方法[J].化學通報,2004,67(6):1-4.ZHAOmING-GANG,HAO AI-YOU.Thepreparation of stablEchlorinEdioxide[J].Chemical Letters,2004,67(6):1-4.
[7]ORMECI B,DUCOSTEJ J,LINDEN kG.Uvdisinfection of chlorinated water:impact on chlorinEconcentration and UvdosEdelivery[J].Journal of Water Supply Research and Technology-Aqua,2005,54(3):189-199.
[8]YANG F,DANIEL W S,JAMES R B.Photolysis of aqueous f reEchlorinEspecies(HOCl and OCl-)with 254 nm ultraviolet light[J].J.Environmental Engineering and Science,2007,6(3):277-284.
[9]MICHAEL J WATTS,KA RL G LINDEN.ChlorinEphotolysis and subsequent OH radical production during Uvtreatment of chlorinated water[J].Water Research,2007,41(13):2871-2878.
[10]SCAICANO JC,KIZYWINSKI Bm,CALABRESES G.Laser flash photolysis determination of absolutEratEconstants for reactions of brominEatoms in solution[J].J.American Chemical Society,1993,115(18):8340-8344.
[11]KRISTINAL,GALLARD H,JOLL C.ThEformation of halogen-specific TOX from chlorination and chloramination of natural organicmatter isolates[J].Water Research,2009,43(17):4177-4186.
[12]DEBORDEAm,GUNTEN U V.Reactions of chlorinEwith inorganic and organic compounds during water treatment-kinetics andmechanisms:A critical review[J].Water Research,2008,42(1):13-51.
[13]PHILLIPN H,GRTEN E,DIYAMANDOLU E.Transformation of brominEspecies during decomposition of bromatEunder Uvlight from low pressuremercury vapor lamps[J].OzonEScience&Engineering,2006,28(4):217-228.
[14]黃君禮.新型水處理劑-二氧化氯技術及其應用[M].北京:化學工業出版社,2002.
[15]WILLIAM JCOOPER,ADAM C JONES,ROBERT F WHITEHEAD et al.Sunlight-induced photochemical decay of oxidants in natural waters:Implications in ballast water treatment[J].Environ.Sci.Tchnol.,2007,41(10):3728-3733.
[16]MIZUNO T,TSUNO H,YAMADA H.A simplemodel to predict formation of bromatEion and hypobromous acid/hypobromitEion through hydroxyl radical pathway during ozonation[J].OzonEScience&Engineering,2007,29(1):3-11.
[17]EMMERT G L.Chemical aspects of water treatment part 1:Chemical characterization of oxidants present in liquors following electrolysis of brine,part 2:BromatEion formation and removal in water treatment[D].Miami:Miami University,1999:167-172.

