惡性瘧原蟲網狀細胞結合蛋白同源體5 F1段的克隆、表達及初步鑒定*
郝文波,李 宏,鄧小英,廖小青,李 明,羅樹紅
惡性瘧原蟲網狀細胞結合蛋白同源體5 F1段的克隆、表達及初步鑒定*
郝文波,李 宏,鄧小英,廖小青,李 明,羅樹紅
目的克隆表達惡性瘧原蟲網狀細胞結合蛋白同源體5(PfRh5)F1片段,并評價其抗原性。方法PCR擴增目的基因片段,克隆到表達載體pET28a(+)中,構建PfRh5F1/pET28a原核表達載體。IPTG誘導表達目的基因,SDS-PAGE電泳分析表達產物,并用Western Blot檢測其抗原性。結果成功構建了PfRh5F1/pET28a原核表達系統,并在大腸桿菌中以包涵體形式高效表達,表達產物能被惡性瘧原蟲感染患者血清識別,而不能被間日瘧原蟲感染患者及正常人血清識別。結論惡性瘧原蟲PfRh5 F1段在大腸桿菌中獲得高效表達且表達產物具有良好的抗原性。
惡性瘧原蟲;網狀細胞結合蛋白同源體5;克隆;表達
惡性瘧原蟲網狀細胞結合蛋白同源體 5(PfRh5)是惡性瘧原蟲(P f)PfRh家族的一個新成員,位于裂殖子頂端的棒狀體內,最近研究發現該蛋白是參與Pf入侵的一個重要蛋白,可與紅細胞上尚未識別的一個新的糖基化的受體結合〔1-2〕,而且該蛋白對蟲體的生存具有關鍵作用〔3〕。本實驗克隆表達了PfRh5蛋白的F1段(K31-F174),該片段預測與紅細胞上受體結合相關,為進一步研究該蛋白在紅細胞入侵中的功能奠定基礎。
1 材料與方法
1.1 材料
1.1.1 質粒與菌株 載體pET28a為Pharmacia產品、大腸桿菌宿主菌Rosetta為本室保存。
1.1.2 蟲株與抗體 惡性瘧原蟲HCC1/HN株由本室保種;惡性瘧原蟲和間日瘧原蟲病人血清由云南省西雙版納傣族自治州疾病預防控制中心提供;H RP標記的羊抗人IgG抗體購自武漢博士德生物工程有限公司。
1.2.3 主要試劑 基因組DNA提取試劑盒、PCR產物純化試劑盒、質粒快速提取試劑盒、瓊脂糖凝膠電泳DNA純化試劑盒、His-Ni-NTA親和層析填料購自QIAGEN公司;限制性內切酶BamH I、Hind III,T4DNA連接酶為NEB產品;化學發光試劑盒(ECL)為美國Pierce公司產品;,其余試劑為國產分析純。
1.2 方法
1.2.1 惡性瘧原蟲的培養 參考 T rager-Jensrn〔4〕等的方法,待原蟲密度達到5%后離心收集含蟲血。
1.2.2 惡性瘧原蟲基因組DNA的提取 按QIAGEN基因組DNA提取試劑盒說明書進行。
1.2.3 PCR擴增惡性瘧原蟲PfRh5基因F1片段根據惡性瘧原蟲(3D7株)PfRh5基因序列,設計并合成一對引物,F1P1:5'-ACGTCGGATCCAAAACGAAGAATCAA -3',F1P2:5'-CGAGCAAGCTTAAAATCCAAATGTCCTTC-3',并分別引入BamH I和Hind III酶切位點,由深圳華大基因科技股份有限公司合成。以惡性瘧原蟲染色體DNA為模板,PCR擴增目的基因。反應在50μ l體系中進行,循環參數為:95℃預變性3min,95℃變性 1min,52℃退火 45s,72℃延伸1min,30個循環后,72℃再延伸10min。擴增產物用1%瓊脂糖凝膠電泳觀察。
1.2.4 PfRh5F1/pET28a重組質粒的構建 PCR產物純化后與質粒pET28a DNA分別用BamH I和Hind III雙酶切,純化酶切產物,在T4DNA連接酶作用下,16℃連接過夜。連接產物轉化 Rosetta感受態細菌。
1.2.5 陽性重組質粒的篩選及鑒定 通過BamH I和Hind III雙酶切及PCR篩選陽性重組克隆菌,送深圳華大基因科技股份有限公司進行測序分析。
1.2.6 重組載體的表達與純化 將重組質粒PfRh5F1/pET28a轉化入表達宿主菌 Rosetta中,IPTG誘導表達,收獲菌體,SDS-PAGE電泳分析表達情況。收集的菌體經超聲破菌、離心、變性、復性等過程處理后,過His-Ni-NTA親和層析柱純化。
1.2.7 Western blot分析重組蛋白的抗原性 重組蛋白純化后進行10%SDS-PAGE凝膠電泳。電泳完畢后,將凝膠經半干轉移儀(美國BIO-RAD公司)轉移至PVDF膜,常規5%脫脂牛奶封閉過夜,分別以惡性瘧原蟲感染患者、間日瘧原蟲感染患者和正常人血清為一抗(1∶1 000),室溫1h,PBS洗滌后加HRP標記的羊抗人二抗室溫孵育2h,PBS漂洗后ECL顯色。
2 結 果
2.1 PCR擴增產物 1%瓊脂糖凝膠電泳觀察PCR產物,可見在400bp和500bp之間有一DNA片段,與目的基因預期一致,見圖1。
2.2 PfRh5F1/pET28a重組質粒的構建與鑒定從連接產物轉化平板上挑取單菌落,提取質粒分別進行PCR及BamH I+Hind III雙酶切鑒定,陽性重組克隆能擴增出429bp的目的片段(圖2),用BamH I+Hind III雙酶切后可產生5 300 bp及429bp兩條帶(圖3),表明表達載體構建成功。將經酶切和PCR鑒定的陽性克隆菌,送深圳華大基因科技有限公司測序。測序結果與NCBI中由Gen-Bank提供的基因序列進行比對,堿基序列完全正確。
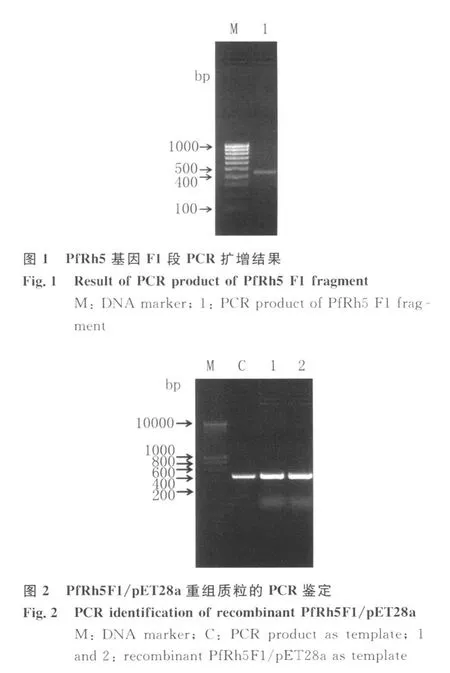
2.3 重組質粒的表達與純化 將陽性克隆菌落及陰性對照同時進行誘導表達,收集菌體,常規處理后進行SDS-PAGE電泳檢測,與空載體對照誘導表達結果相比,PfRh5F1/pET28a/Rosetta菌體在相對分子量約21.8kDa位置有的較強的表達條帶出現。菌體經超聲波破菌后,分別取上清和沉淀少許,常規處理樣品并進行SDS-PAGE分析,發現目的蛋白主要出現在沉淀中,因此目的蛋白是以包涵體的形式表達(圖 4)。包涵體經變性、復性處理后,過His-Ni-NTA親和層析柱純化,得到分子量約20kDa,純度約90%的重組蛋白。
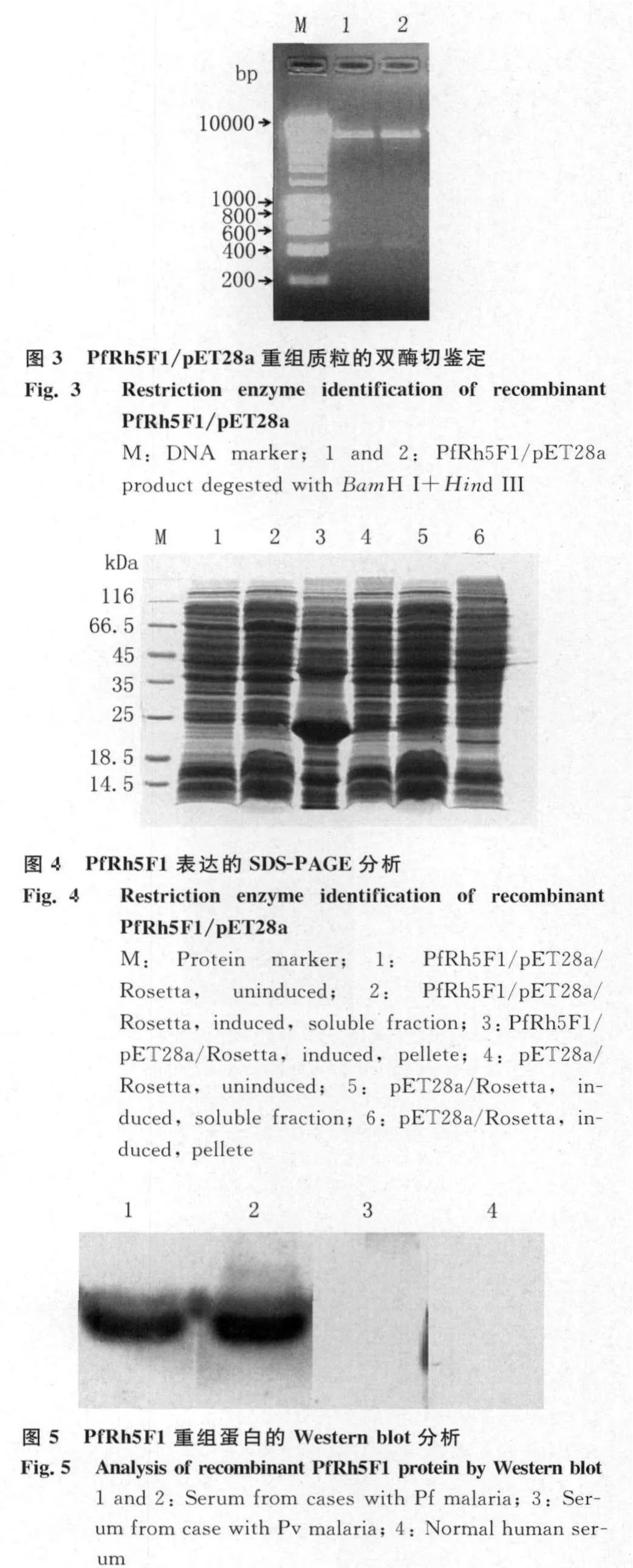
2.4 重組蛋白的抗原性分析 Western blot結果顯示,純化的重組表達蛋白能夠被惡性瘧原蟲感染患者血清識別,而不被間日瘧原蟲感染患者及正常人血清識別,見圖5。
3 討 論
瘧疾是一種嚴重危害人體健康的寄生蟲病。目前,全世界范圍內的瘧疾發病率正在增高〔5〕。隨著P f對多種抗瘧藥產生抗性,瘧疾死亡病例逐漸增多,開發出新的有效的藥物和疫苗已勢在必行。
新藥及疫苗的開發離不開對P.f致病機制的深入理解。裂殖子入侵紅細胞是瘧原蟲在體內繁殖和對宿主致病的一個關鍵過程,阻斷該過程是瘧疾防治的一個重要策略〔6-7〕。PfRh5是最近發現的參與Pf入侵的一個重要蛋白,抗PfRh5抗體在體外具有抑制P f入侵的作用,重組PfRh5蛋白可以被瘧原蟲免疫血清及瘧區暴露人群血清識別,提示P f裂殖子與紅細胞之間存在一條新的入侵途徑〔1,3〕。鑒定PfRh5與紅細胞上的受體的相互作用,有助于我們更深入的理解Pf裂殖子的入侵機制,同時也可為研制P f紅內期亞單位疫苗提供一個潛在的候選抗原。
本實驗成功克隆、表達了惡性瘧原蟲PfRh5蛋白的F1段(K31-F174),該片段預測為PfRh5與受體結合的重要區域,表達產物主要以包涵體形式存在。包涵體經過變性、復性處理后,過His-Ni-NTA親和層析柱純化,獲得了純度較高的重組蛋白產物。通過Western blot分析重組蛋白的抗原性,結果重組蛋白能夠與惡性瘧原蟲感染患者血清發生反應,而不與間日瘧原蟲感染患者和正常人血清反應,說明重組蛋白具有良好的抗原性,可能具有良好的生物學活性,這將為制備抗PfRh5蛋白的單克隆抗體及進一步研究該蛋白的功能奠定了基礎。
〔1〕Rodriguez M,Lustigman S,Montero E,et al.PfRH5:a novel reticulocyte-binding family homolog ofPlasmodium falciparumthat binds to the erythrocyte,and an investigation of its receptor〔J〕.PLoS ONE,2008,3(10):e3300.
〔2〕Baum J,Chen L,Healer J,et al.Reticulocy te-binding protein homologue 5-an essential adhesion involved in invasion of human ery throcytes byPlasmodium f alciparum〔J〕.Int J Parasitol,2009,39(3):371-380.
〔3〕Hayton K,Gaur D,Liu A,et al.Erythrocy te binding protein PfRH5 polymorphisms determine species-specific pathways ofPlasmodium f alciparuminvasion〔J〕.Cell Host Microbe,2008,4(1):40-51.
〔4〕Trager W,Jensen JB.Human malaria parasites in continuous culture〔J〕.Science,1976,193(4254):673-675.
〔5〕Snow RW,Guerra CA,Noor AM,et al.T he global distribution of clinical episodes ofPlasmodium f alciparum malaria〔J〕.Nature,2005,434:214 217.
〔6〕Soldati D,Foth BJ,Cowman AF,et al.Molecular and functional aspects of parasite invasion〔J〕.T RENDS in Parasitology,2004,20(12):568.
〔7〕Cowman AF,Crabb BS.Invasion of red blood cells by malaria parasites〔J〕.Cell,2006,124:755-766.
Cloning,expression and identification of reticulocyte-binding protein homologue 5 F1 fragment inPlasmodium falciparum
HAO Wen-bo,LI Hong,DENG Xiao-ying,LIAO Xiao-qing,LI Ming,LUO Shu-hong
(Institute of Antibody Engineering,Schoolof Biotechnology,Southern Medical University,Guangzhou510515,China)
In order to clone and express reticulocyte-binding protein homologue 5(PfRh5)F1 fragment gene ofPlasmodium falciparum,the 429bp PfRh5 gene(91-519)was specifically amplified by polymerase chain reaction and cloned into pET28a(+)vector.The recombinant plasmid was then transformed and induced to express inE.coliRosetta.The expressed product was analyzed by SDS-PAGE and Western Blot respectively.And the expressed protein was insoluble with a size of about 21.9 kDa as predicted.Also,it exhibited a specific reaction with immune sera obtained from patients with Pf maleria.These results demonstrate that the PfRh5 F1 fragment has been successfully expressed and the expressed protein has certain antigenicity.
Plasmodium falciparum;reticulocyte-binding protein homologue 5;clone;expression
R382.3
A
1002-2694(2010)07-0624-03
*國家重點基礎研究發展計劃973專項(No.2007CB513101)和國家自然科學基金(No.30200238)聯合資助
羅樹紅,Email:shluo815@yahoo.com
南方醫科大學生物技術學院,廣州 510515
2010-03-15;
2010-04-20

