ERK活化對哮喘大鼠氣道重塑及CyclinD1表達的影響
張愛芝,張煥萍,藺鵬翔
(1.山西醫科大學,太原 030001;2.山西醫科大學第一臨床醫學院呼吸內科,太原 030001)
研究報告
ERK活化對哮喘大鼠氣道重塑及CyclinD1表達的影響
張愛芝1,張煥萍2,藺鵬翔1
(1.山西醫科大學,太原 030001;2.山西醫科大學第一臨床醫學院呼吸內科,太原 030001)
目的探討細胞外信號調節蛋白激酶(ERK)對哮喘大鼠氣道重塑及 CyclinD1表達的作用。方法原代培養大鼠的平滑肌細胞(AS MCs),給予 ERK激動劑表皮生長因子 EGF和抑制劑 PD98059干預AS MCs生長,依處理方式不同分為 5組:(1)正常對照組 (2)哮喘對照組;(3)E組:EGF20 ng/mL;(4)P+E組,PD98059 10 μmol/L 1 h后添加 EGF 20 ng/mL;(5)PD組,PD98059 10μmol/L。采用四甲基偶氮唑鹽 (MTT)法檢測氣道平滑肌細胞(AS MCs)增殖能力,流式細胞術 (FCM)測定細胞周期和 cyclinD1的蛋白含量,RT-PCR方法檢測 cyclinD1 mRNA表達水平。結果(1)與哮喘對照組比較,E組AS MCs S+G2/M期比例、吸光度 A值、cyclinD1蛋白陽性表達率和 cyclinD1 mRNA的A值均顯著升高,PD組均顯著降低(P<0.05)。P+E組與哮喘對照在此 4項指標上比較無明顯差異。(2)哮喘(對照組、E組、PD組和 P+E組)組與正常對照組,其 S+G2/M期比例、吸光度 A值、cyclinD1蛋白和 cyclinD1 mRNA的表達均顯著增高 (P<0.05)。結論ERK活性促進哮喘大鼠AS MCs的增殖,增加 cyclinD1在哮喘平滑肌細胞中的表達,導致氣道重塑的形成,提示 ERK可能對 CyclinD1的表達具有調節作用。
CyclinD1;細胞外信號調節激酶;氣道重塑;哮喘
細胞外信號調節蛋白激酶 (ERK)是絲裂原活化蛋 白 激 酶 (mitogen-activated protein kinase, MAPK)家族中的一個亞族,參與細胞增殖、分化、凋亡等多種生理病理過程,特別是在調節細胞增殖過程中起著重要的作用[1],研究證實,D1類細胞周期蛋白 (cyclinD1)主要存在與氣道平滑肌細胞,在調節細胞周期 G1期向 S期轉變的過程中起關鍵作用[2]。細胞周期的進行依賴于 ERK的持續激活和核內的滯留[3]。目前 ERK對哮喘大鼠氣道平滑肌細胞增殖調控的確切機制尚未闡明,以及 ERK對哮喘大鼠平滑肌細胞 CyclinD1調控的相關研究報道甚少。本實驗在細胞水平和基因水平探討 ERK對在哮喘平滑肌細胞增殖的作用和對 CyclinD1表達的影響。
1 材料和方法
1.1 實驗材料
清潔級健康雄性W istar大鼠山西醫科大學實驗動物中心提供 (合格證號:山醫字第 070101)。ERK特異性激活劑表皮生長因子 (EGF)及抑制劑PD98059購自美國 Peprotech公司;抗 cyclinD1抗體購于 Santa Cruz公司;其余為進口或國產試劑。
1.2 方法
1.2.1 AS MCs的培養鑒定:用OVA制備 6周哮喘模型,原代培養大鼠平滑肌細胞,通過形態學觀察和小鼠平滑肌α-肌動蛋白 (α-actin)免疫細胞化學染色鑒定為AS MCs。
1.2.2 實驗分組:實驗用培養的第 3~6代氣道平滑肌細胞,換無血清DMEM培養 24 h,使細胞生長同步于 G0期,換用含 10%FBS的DMEM液,再分別應用 ERK激活劑 EGF及抑制劑 PD98059干預AS MCs,根據給藥方式不同分為 5組:(1)正常對照組;(2)哮喘對照組;(3)E組,EGF 20 ng/mL;(4)P +E組,PD98059 10μmol/L 1 h后添加 EGF20 ng/ mL,細胞培養再持續 24 h;(5)PD組,PD98059 10 μmol/L。干預后的 AS MCs放入 CO2培養箱中共培養 12 h,進行下述實驗。每 5個復孔/瓶為一組,實驗重復 3次。
1.2.3 流式細胞儀分析 AS MCs細胞周期:收集各組的AS MCs用 PBS制成濃度為 1×107/mL的細胞懸液,用 -20℃預冷的 75%乙醇在 4℃過夜固定,離心后加入 RNA酶 37℃作用 30 min后,再加入 PI室溫避光 30 min,直接用 FACsort型流式細胞儀(型號:BECK MAN)檢測,Cell quest軟件分析細胞周期中各期所占的百分比。
1.2.4 四甲基偶氮唑藍 (MTT)微量比色法測定AS MCs增殖:消化各組平滑肌細胞制成濃度為 1.0 ×107cells/L的細胞懸液,每孔 200μL接種于 96孔板。使細胞同步化后再換成各組的培養液培養 16 h,之后每孔加 20μL(5 g/L)MTT溶液,繼續培養 4 h。培養結束后,加入 150μL二甲基亞砜 (DMSO)溶液,振蕩 30 min后,用酶聯免疫檢測儀于 490 nm比色測定。結果以A值表示。實驗重復 3次。
1.2.5 流式細胞儀測定 AS MC中 cyclinD1的表達情況:取同代的各組 AS MC制成 5×107cells/L濃度,用 0.01 mol/LPBS液洗 2次;加 50μL細胞固定液,室溫靜置 15 min,用 0.01 mol/L PBS液洗滌細胞后,1500 r/min離心 5 min,棄上清的細胞碎片;加50μL細胞破膜劑,避光靜置 10 min后,直接加 9 μL鼠抗 cyclinD1單抗 (設一空白對照組),混勻避光室溫孵育 30 min;用 PBS液洗 2次,再加 8μL的FITC標記羊抗鼠 IgG,常溫避光染色 30 min后,再PBS液洗 2次,棄去上清液,加 500μL PBS直接用FACS Calibur流式細胞儀進行檢測,Multicyle軟件分析各組細胞表達 CyclinD1的陽性百分率,用陽性細胞表達百分率值表示 cyclinD1蛋白的相對含量,檢測重復 3次。
1.2.6 逆轉錄聚合酶鏈式反應 (RT-PCR)檢測CyclinD1的 mRNA表達水平:CyclinD1引物序列:上游:5′-GCG TAC CCT GAC ACC AAT CT-3′下游: 5′-GGC TCC AGA GAC AAG AAA CG-3′擴增產物片斷為 232bp。GAPDH引物序列:上游 5′TGA ACG GGA AGC TCA CTG G-3′,下游 5′-TCC ACC ACC CTG TTG CTG GA-3′,擴增產物片斷 307 bp。PCR反應條件:94℃預變性 2 min,94℃變性 20 s,58℃退火 1 min,72℃延伸 30 s,共進行 32個循環,最后72℃延伸 5 min,擴增產物經 2%瓊脂糖凝膠電泳,采用 Quantity one 4.6軟件分析擴增產物條帶灰度值(A):取目的基因與 GAPDH的A值的比值為該目的基因的相對含量。
1.2.7 統計學處理:應用統計分析軟件包 SPSS13. 0進行統計學分析。實驗數據以均數 ±標準差(ˉx± s)表示,多組間比較采用 F檢驗,兩兩之間比較采用 q檢驗。
2 結果
2.1 細胞鑒定(圖 1~2見彩插 2)
經原代培養的AS MCs在倒置顯微鏡下為典型“峰和谷”生長狀態(圖 1)。α-actin免疫細胞化學染色陽性,即所培養的細胞鑒定為平滑肌細胞[4](圖 2)。
2.2 細胞增殖活性檢測
2.2.1 流式細胞儀分析 AS MCs細胞周期:哮喘對照組與正常對照組相比,S+G2/M期細胞所占比例明顯升高(P<0.05)。EGF處理組 S+G2/M期細胞所占比例與哮喘對照組相比,明顯增高 (P< 0.05);PD處理組則明顯減少 (P<0.05)。P+E組與哮喘對照組比較,差異不顯著 (表 1)。
2.2.2 MTT法檢測細胞增殖:與哮喘對照組 A490值相比,哮喘 E組 A490值增高,哮喘 PD組 A值降低,差異均顯著(P<0.05)。哮喘 P+E組與正常對照組比較,A值升高,差異顯著 (P<0.05);哮喘 P+ E組與哮喘對照組比較差異不顯著(表 1)。
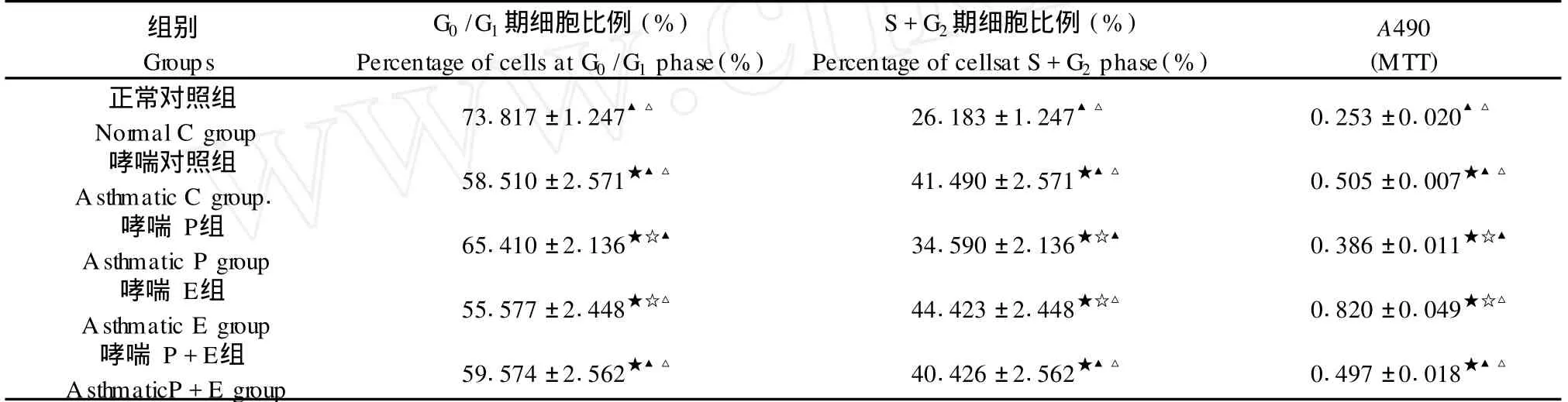
表 1 AS MCs增殖活性表達情況Tab.1 Proliferation levels ofAS MCs in each group
2.3 哮喘大鼠 ASMCs的 cyclinD1蛋白和cycl inD1mRNA表達

圖 3 用 FCM測哮喘平滑肌細胞 CyclinD1的表達Fig.3 CyclinD1 expression ofAS MCswere detected by FCM
如圖 3、4所示,與哮喘對照組比較,EGF組和PD組 cyclinD1蛋白和 cyclinD1 mRNA的表達分別為 (1.419±0.401)、(0.716±0.064),差異顯著 (P <0.01)。P+E組與哮喘對照組比較cyclinD1蛋白和mRNA的表達差異不顯著。P+E組與正常空白組比較,A值比值上升;與 PD組比較A值下降,差異均顯著。cyclinD1蛋白表達與 cyclinD1 mRNA表達呈正相關。
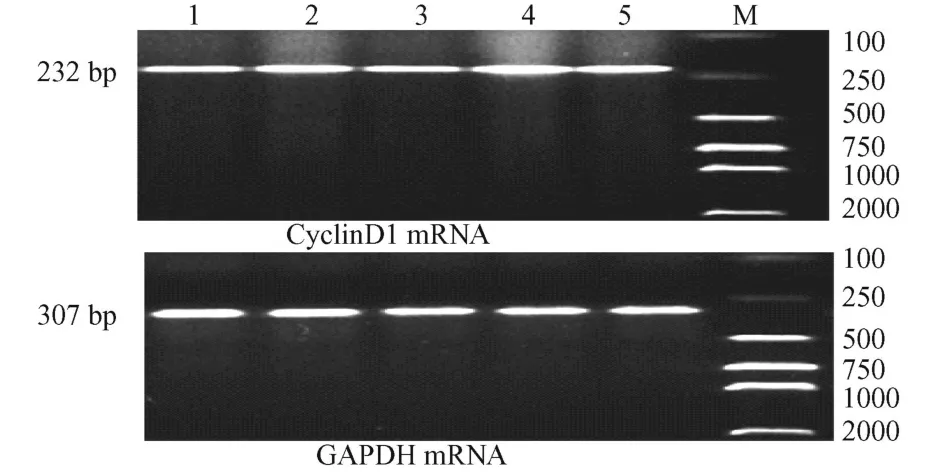
圖 4 大鼠AS MCs CyclinD1 mRNA表達Fig.4 RT-PCR amplification of Expression of CyclinD1 mRNA in AS MCs
3 討論
哮喘是以氣道高反應性、氣道炎癥和氣道重塑為特征的慢性疾病,氣道平滑肌細胞的異常增殖是參與哮喘氣道重塑的重要因素[5]。本研究的目的在于研究 ERK對平滑肌細胞增殖的作用及對CyclinD1表達的調節作用。
Duan和 Wong等[6]研究顯示 ERK抑制哮喘氣道炎癥的形成,激酶抑制劑通過抑制炎癥反應來治療哮喘。目前 ERK對細胞增殖的調控機制是一個研究的熱點[7],為了更好的闡明 ERK信號通道對哮喘大鼠氣道平滑肌細胞增殖的調控作用及對CyclinD1作用的研究,本實驗采用 ERK激動劑 EGF和抑制劑 PD98059分別干預平滑肌細胞的增殖。哮喘對照組AS MCs細胞增殖水平明顯高于正常對照組,提示哮喘平滑肌細胞增殖活躍。給予 ERK激動劑 EGF的刺激后,AS MCs細胞增殖水平明顯增高;給予 ERK抑制劑 PD98059則抑制細胞增殖,提示 ERK的活性與細胞增殖水平密切相關,與張曉宇研究一致[8]。PD98059阻止了部分 EGF的作用,這表明在慢性哮喘大鼠平滑肌細胞增殖中 ERK起了重要的促進作用,進一步證實 ERK信號通路參與了大鼠平滑肌細胞增殖的調控。
近年來對細胞增殖周期的研究表明[9]:細胞周期調控是在各期的控制點上進行的,細胞周期中存在兩個重要的調控點:G1/S和 G2/M期調控點,只要 G1期內的正性調節因子累積達到一定程度,周期越過 G1/S交界點,以后細胞就不再依賴于細胞外促生長因子而順序完成整個細胞周期,因而 G1/S調控點是影響細胞周期的關鍵。CyclinD1特異性地表達于細胞增殖周期的 G1期,調控著 G0期細胞向G1期的轉化,是細胞增殖周期啟動的重要調控因子。Inoue等[10]研究報道在哮喘免疫方面 ERK對SPRED蛋白有調節作用,抑制 SPRED蛋白可作為治療哮喘的新策略,因此推測 ERK在哮喘平滑肌細胞增殖中對 CyclinD1有調節作用,抑制 CyclinD1表達可阻止哮喘氣道重塑。
實驗結果顯示,與正常對照組比較,哮喘對照組 cyclinD1 mRNA和蛋白表達增加,提示在哮喘平滑肌細胞中 cyclinD1表達活性提高。給予 EGF處理之后,cyclinD1 mRNA和蛋白表達水平均顯著增高;給予 PD98059處理AS MCs之后,cyclinD1mRNA和蛋白表達水平均明顯降低;這表明 ERK活性影響了 cyclinD1的表達,同時細胞周期時相也發生了改變,即 S+G2細胞增加或減少,促進或阻止了細胞從 G0/G1期向 S期轉化的進程,提示 ERK的活性影響細胞周期的進行,表明 cyclinD1在平滑肌細胞增殖中的表達與 ERK信號途徑存在密切的關系。聯合應用 EGF和 PD98059組與哮喘對照組比較, cyclinD1 mRNA和蛋白表達水平無顯著變化,細胞周期時相也未發生變化,進一步闡明了 ERK對哮喘大鼠氣道平滑肌細胞增殖周期中的 cyclinD1可能具有調控作用。此外,聯合應用 EGF+PD98059組的cyclinD1 mRNA和蛋白表達水平略低于哮喘對照組,表明 PD98059抑制作用大于 EGF激活 ERK活性促進 cyclinD1表達的作用,提示除了 ERK之外,也可能還存在其他機制對 cyclinD1表達進行調控。
以上實驗結果表明,ERK活化在哮喘大鼠AS MCs增殖中起重要作用,促進哮喘氣道重塑的形成,對細胞周期蛋白 (cyclinD1)可能具有調控作用,明確 ERK對 cyclinD1的調控作用,可以把 ERK或cyclinD1作為靶點來抑制氣道重塑的形成,為治療哮喘提供新方向。但目前 ERK對細胞周期的各個時期和多種蛋白的調控機制尚不清楚,如對 G2/M期及其它周期蛋白 (cyclinE、CDK4等)調控遠未明了,還有待于進一步深入研究。
[1] He H,Pannequin J,Tantiongco JP,et al.Glycine-extended gastrin stimulates cell proliferation and migration through a Rhoand ROCK-dependent pathway,not a Rac/Cdc42-dependent pathway[J].Am J Physiol GastrointestLiver Physiol,2005,289 (3):G478-488.
[2] Liu Y,Templeton DM.Iron-loaded cardiac myocytes stimulate cardiac myofibroblastDNA synthesis[J].Mol Cell Biochem, 2006,281(1-2):77-85.
[3] Ravenhall C,Guida E,Harris T,et al.The importance of ERK activity in the regulation of cyclinD1 levels and DNA synthesis in human cultured air way smooth muscle[J].Br J Pharmacol, 2000,131(1):17-28.
[4] 張曉宇,徐永健,劉先勝,等.香煙提取物經級聯反應促進支氣管哮喘大鼠氣道平滑肌細胞增殖[J].中華結核和呼吸雜志,2009,32(5):390-393.
[5] Wang PY,Weng J,Anderson RG,et al.OSBP is a cholesterol regulated scaffolding protein in control of ERK 1/2 activation [J].Science,2005,307(5714):1472-1476.
[6] DuanW,WongWS.Targetingmitogen-activated protein kinases for asthma[J].CurrDrug Targets,2006,7(6):691-698.
[7] Roberts PJ,Der CJ. Targeting the Raf-MEK-ERK mitogenactivated protein kinase cascade for the treatment of cancer[J]. Oncogene,2007,26:3291– 3310.
[8] 范曉燕,張煥萍.p-ERK1/2及 ERK2mRNA在哮喘大鼠氣道中的表達變化[J].中國比較醫學雜志,2008,18(3):14-18.
[9] Kavurma MM,Khachigian LM.ERK,JNK,and p38 MAP kinases differentially regulate proliferation and migration of phenotypically distinct smooth muscle cell subtypes[J].J Cell Biochem,2003,89(2):289-300.
[10] Inoue H,Fukuyama S,Matsumoto K,et al.Role of endogenous inhibitors of cytokine signaling in allergic asthma.Curr Med Chem.2007;14(2):181-189.
Effect of ERK on Asthmatic Rat A irway Remodeling and CyclinD1
ZHANGAi-zhi1,ZHANG Huan-ping2,L IN Peng-xiang1
(1.Shan XiMedicalUniversity,Tai Yuan 030001,China;2.Department of Respiration First Affiliate Hospital of Shan XiMedicalUniversity,Tai Yuan 030001,China)
ObjectiveTo investigate the effects of ERK on asthma air way remodeling and the expressions of cyclinD1。MethodsThe rat asthma model was made through ovalbumin(OVA)sensitization and excitation.Primary cultures ofAS MCswere established and cells between passages 3 and 6 were used for experiments.AS MCs were treated with ERK activator epidermal growth factor(EGF)and inhibitor PD98059,and then subdivided into 5 groups based on the drug interventions:(1)Normal control group;(3)Asthmatic control group;(3)Asthmatic EGF group;(4)P+E group, PD98059 10μmol/L+EGF 20 ng/mL;(5)PD98059 group.The proliferations ofAS MCswere examined with cell cycle analysis and MTT colorimetric assay,the expressions of cyclinD1 mRNA were detected by RT-PCR,and the protein expression of cyclinD1 wasmeasured by FCM。ResultsCompared to asthmatic control group,the percentage of cells at S +G2/M phase,Avalue,the expression of cyclinD1 mRNA and cyclinD1 protein from E group were significantly increased (P<0.05);the PD group were significantly reduced respectively(P<0.05).There was no significant difference between P+E group and the asthmatic control group in the above four index. (2)Compared with normal control group,the percentage of cells at S+G2/M phase,Avalue,the expression of cyclinD1 mRNA and cyclinD1 protein from asthmatic group(control group,E group,P group and P+E group)were significantly increased(P<0.05)。ConclusionTheactivation of ERK promotesAS MCsproliferation and expressionsof cyclinD1 in asthmatic rats,indicating that the expression of CyclinD1 may be dependenton the ERK activation in asthmatic rats.The findingwill help to understand the mechanisms of airway remodeling.
CyclinD1;Extracellular signal-regulated kinase(ERK);Airway remodeling;Asthma
R563
A
1671-7856(2010)03-0026-04
2009-11-16
山西省教育廳 2005年山西省高校科技研究開發項目(20051001)。
張愛芝(1985-)女,碩士生,研究方向:哮喘發病機制的研究。E-mail:Aizhi2008@126.com
張煥萍,女,博士,碩士生導師。E-mail:zhp326@163.com

