依諾沙星片生產過程的工藝驗證
婁桂芹賈 征
依諾沙星片生產過程的工藝驗證
婁桂芹1賈 征2
目的 驗證依諾沙星片生產工藝的可靠性。方法 采用同步驗證法對依諾沙星片的各個工序的產品進行驗證。結果 制粒含水量、均勻性、壓片硬度、崩解、包衣硬度、溶出度、片重差異、含量測定等均符合要求。結論 該品種生產工藝合理,可在外在正常條件下生產出質量穩定可靠的產品。
依諾沙星片;工藝參數;同步驗證
依諾沙星是喹諾酮類合成抗菌藥,化學名為1-乙基-6-氟-1,4-二氫-4-氧代-7-(1-哌嗪基)-1,8-萘啶-3-羧酸倍半水合物。依諾沙星片具有廣譜抗菌作用,通過作用于細菌DNA螺旋酶的A亞單位,抑制DNA的合成和復制而導致細菌死亡。廣泛應用于呼吸道、泌尿生殖系統、胃腸道、皮膚軟組織、骨和關節、敗血癥等細菌引起的感染[1]。
工藝(工序)驗證是指在完成廠房、設備、設施的鑒定與質控、計量部門的驗證后,對生產線所在生產環境及裝備的局部或整體功能、質量控制方法及工藝條件的驗證,確認該生產過程(工序)是有效的,而且有重現性[2]。驗證的目的是識別出重要的工藝參數,確定這些參數的合格范圍,并提出控制這些參數的方法。以證實所設定的工藝路線和控制參數能確保產品的質量[3]。本實驗采用連續生產的三批依諾沙星片,每批68.6萬片的量,依據工藝規程及質量標準,對混合制粒、干燥、壓片、包衣等關鍵工序的重要參數進行驗證。
1 材料和設備
1.1 材料
依諾沙星,武漢武藥制藥有限公司 C03-L050205;糊精,東莞市東岳葡萄糖廠050901;淀粉,得峰淀粉糖業有限公司淀粉廠04122202;硬脂酸鎂,貴州省桐滓縣光彩化工有限公司 20050402;羧甲基淀粉鈉,湖州展望化學藥業有限公司 20050939;歐巴代,上海卡樂康包衣技術有限公司 20050501。
1.2 儀器設備
蒸汽熱循環烘箱,肇慶市供銷機械廠;搖擺式顆粒機,中南制藥機械廠;V型混合機,江蘇無錫輕化機械設備制造廠;粉碎機,上海制藥機械廠;糖衣機,中南制藥機械廠。
2 依諾沙星片的制備
2.1 處方投料量
依諾沙星68.6kg、糊精6.9kg、淀粉3.4kg、11.0%淀粉漿18.2kg、硬脂酸鎂1.9kg、羧甲基淀粉鈉1.7kg、包衣材料歐巴代6.9kg、純化水25.7~27.4kg。
2.2 工藝操作
按處方量稱取原輔料,并分別過80目篩,備用;按處方量稱取淀粉和純化水,以沖漿法配制成所需濃度的淀粉漿;將過篩后的依諾沙星、淀粉、糊精于混合機中攪拌15~20min,緩慢加入淀粉漿,并攪拌制成軟材,用12~14目尼龍篩制粒,并于(60±5)℃通風干燥約2.5h后收料;干料用18~20目不銹鋼篩網整粒后,加入硬脂酸鎂及羧甲基淀粉鈉混勻,裝桶稱重;壓片;包衣以20%~21%白色歐巴代溶液噴霧進行包衣。
3 生產過程的工藝驗證
3.1 制粒濕混時間的驗證
3.1.1 試驗方法
采用快速攪拌,設置濕混時間為5、10、15、20、25min,并在每一混合時間點觀察軟材的情況,驗證最佳混合時間。觀察結果見表1。
3.1.2 判斷標準
軟材要求握之成團,按之即散。

表1 制粒濕混時間結果
3.1.3 結果
表1表明3批產品制軟材時在15~20min符合要求。
3.2 干燥時間的驗證
3.2.1 試驗方法
調整溫度(60±5)℃;干燥90min后,于干燥箱內4個頂角處取4個樣點,每個取樣點取上、下2個樣品測試顆粒水分,使用電子天平用減量失重法測試。每隔20min取樣測定一次,結果見表2。
3.2.2 判斷標準
水分應<8.2%。
3.2.3 結果
表2表明150min時,各取樣點水分均<8.2%,干燥時間合格。
3.3 原輔料混合均勻性的驗證
3.3.1 方法
分別在90、120、150min每個時間點于四周和中心5個取樣點取樣,每個取樣點取上、下2個樣品,分別使用紫外分光光度測定含量,結果按下式計算相對標準偏差,RSD應≤6%。
3.3.2 判斷標準
根據文獻檢索,確定標準為RSD≤6.0%。
3.3.3 結果
3批產品原輔料在攪拌5min后,RSD均<6.0%,混合均勻,所以混合時間符合要求。
3.4 壓片工藝參數的驗證
3.4.1 試驗方法
當壓片機調試完畢,在壓片過程中每隔10min從左、右出口處用白色塑料瓶各取20片,共取6個樣,分別測片的硬度、崩解時限。
3.4.2 判斷標準
硬度應在60~100N,崩解時限應在15min以內,產品為合格。
3.4.3 結果
壓片壓力在6~8KN時,片重差異、硬度、崩解時限滿足工藝要求,所以壓片壓力符合要求。
3.5 包衣工藝參數的驗證
3.5.1 試驗方法
使包衣機的鍋速在6~12r/min范圍內調整,按包衣的SOP進行包衣,分別測包衣片的片重差異、硬度、溶出度。
3.5.2 判斷標準
包衣片的片重差異不應超過5%,硬度應在60~100KN,溶出度應≥85%,產品為合格。
3.5.3 結果
包衣鍋速在6~12r/min時,硬度、溶出度、片重差異滿足工藝要求,結果符合要求。

表2 干燥樣品水分測定結果
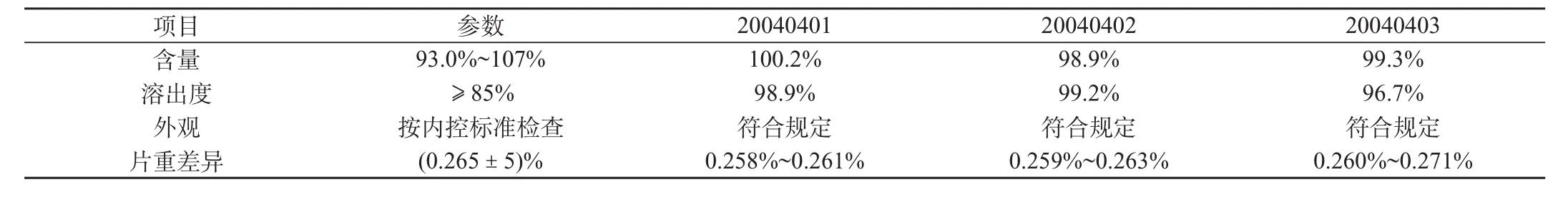
表3 包衣片化驗結果
3.6 包衣片的質量驗證
為整體考察各個工藝參數對質量的影響,對各批包衣片的片重差異、含量、溶出度、外觀進行驗證。結果見表3,符合規定。
4 驗證結論
本驗證全過程都在監控過程中,查全檢合格,根據3批的情況對工藝參數進行確認。按生產工藝要求操作,制粒、總混工序所得的顆粒外觀色澤符合規定,水分分別為6.2%、7.0%、6.7%,<8.2%,顆粒含量分別為0.215%、0.08%、1.5%,均<6.0%;壓片工序所壓出的素片片重差異、硬度、崩解時限;包衣工序所檢溶出度均>85%,片重差異不超過5%,成品檢驗的溶出度、含量、片重差異,外觀均符合要求。
5 討 論
目前國內制藥企業在片劑生產中的問題還較多突出反映在含量、崩解時限和溶出度檢查不符合要求,裂片、松片等現象。因此,為了確保片劑的質量,必須強調在GMP實施過程中的有關驗證工作[4]。此次驗證根據《GMP驗證指南》,用同步驗證法驗證了各個工序的工藝參數,以確保工藝生產出質量穩定可靠的產品,驗證顯示依諾沙星片的生產過程工藝符合預期要求。此次驗證存在著不足,我們在做制粒濕混時的標準仍然是傳統的經驗值,沒有能把標準量化,由于同步驗證與試生產同步進行,因此該驗證取得結果的同時會生產出合格的產品,但也可能生產出不合格的產品,會給產品的質量帶來風險。
[1] 盧文斌.高效液相色譜法測定依諾沙星片的含量[J].海峽藥學,2003,15(3):24-65.
[2] 陳建中,鄭邦一.V型混合機的生產工藝驗證[J].廣東藥學院學報,2004,20(2):46-49.
[3] 白頭翁.GMP生產工藝的驗證[J].畜牧市場,2004(3):54-55.
[4] 張全軍.片劑生產驗證[J].中國藥師,2003,6(3):180-181.
Procedure Process of Enoxacin Tablets Manufacturing Inspect
LOU Gui-qin1, JIA Zheng2
(1 Department of Pharmacy, North China Coal Medical University, Tangshan 063000, China;
2 Department of Clinical Medicine, Tangshan Vocational and Technical College, Tangshan 063000, China)
Objective To discusses the manufacturing procedure of enoxacin tablets to produce reliable quality products. Method Using synchronous methods to inspect the products which were made by the every working procedures. Results The water and the degree of consistency of the particle of the granules; the hardness and the disintegrant of the power compression; the hardness and dissolution of the coated pellet; the dissolution, fi lms on differences and the content of the products are all meet with the compliant. Conclusion Manufacturing procedure of enoxacin tablets reasonable, can produce reliable quality products in external of normal conditions.
Enoxacin tablets; Craft parameter; Synchronization con fi rmation
R954
B
1671-8194(2010)12-0019-03
1 華北煤炭醫學院藥學系(063000)
2 唐山市職業技術學院臨床醫學系(063000)

