雙液相法提取高粱蠟條件優化及其性質研究*
劉明,譚斌,譚洪卓,田曉紅,沈群
1(國家糧食局科學研究院,北京,100037) 2(中國農業大學食品科學與營養工程學院,北京,100083)
雙液相法提取高粱蠟條件優化及其性質研究*
劉明1,譚斌1,譚洪卓1,田曉紅1,沈群2
1(國家糧食局科學研究院,北京,100037) 2(中國農業大學食品科學與營養工程學院,北京,100083)
以蠟提取率為指標,采用乙醇-水-正己烷雙液相溶劑法回流提取高粱蠟,應用三因素二次回歸通用旋轉組合設計,對影響蠟提取的主要因素進行優化。高粱蠟的最佳提取條件為烷料比(mL∶g)7.21∶1,醇料比(mL∶g)9.92∶1,提取時間80 min,在此條件下高粱蠟提取率的理論值可達0.3018%。在優化條件下進行驗證試驗提取率為0.2975%。提取的高粱蠟的基本理化性質為:色度(L*a*b*)分別為45.01±0.05、9.60±0.12和14.80±2.26,酸值10.98±0.29,碘值18.94±0.29,皂化值77.53±0.47。高粱蠟熔點為66.5-77.6℃,與巴西棕櫚蠟接近,高于米糠蠟、蜂蠟和石蠟。高粱蠟中二十八烷醇和三十烷醇含量分別達到21.97%±0.12%和24.73%±0.22%。
高粱蠟,雙液相法,響應面分析,二十八烷醇,三十烷醇
高粱[Sorghum bicolor(L.)Moench]是世界上第五大重要的糧食作物,具有高產、抗旱、抗鹽堿、抗澇、耐貧瘠等特點,是一種生態環境友好型的糧能兼用作物。目前,世界高粱約50%用于飼料,其余用于食品、燃料乙醇等其他用途,在非洲和亞洲部分國家是一種重要的人類口糧,中國的高粱主要用于食用白酒的釀造與飼料[1-3]。近年來,由于具有獨特的環境適應性、不含面筋、不易消化、富含多酚類化合物與高級烷醇等植物化學素組分等獨特的營養保健特性與加工特性,高粱作為一種健康食物資源的開發日益引起了學界的廣泛關注。
高粱蠟是一種主要存在于高粱籽粒外表皮和高粱莖葉表面優良的天然蠟資源,其性質與國際上交易量巨大的巴西棕櫚蠟相似。同時,高級烷醇占高粱蠟的19%-46%,游離形式的二十八烷醇與三十烷醇含量最豐富。高級烷醇的降低血液膽固醇的能力可以與Statins(為目前最流行也是最貴且有潛在副作用的藥物)比美。目前商業化的烷醇類主要是通過對甘蔗蠟水解與進一步純化得到的[2-4]。高粱蠟的開發利用具有極大的開發潛力。國外學者對高粱蠟的研究比較早,采用正己烷、苯、石油醚、三氧甲烷、丙酮、乙醇等有機溶劑提取高粱蠟[4-8],在國內對高粱蠟的提取及其性質研究則剛剛起步。本研究擬采用雙液相溶劑法提取高粱蠟,優化高粱蠟提取溶劑和提取條件,并對高粱蠟的基本理化性質和高級烷醇含量進行了分析研究,以期促進我國高粱及高粱蠟資源的深度開發利用。
1 材料與方法
1.1 材料與試劑
高粱籽粒,阜雜1號,采自遼寧朝陽。收集整個高粱穗,并用封口袋包裝,防止谷粒表皮破損,收集后脫殼4℃保存。正己烷、乙醇、丙酮、三氯甲烷、石油醚、苯、甲醇、異丙醇、乙酸乙酯,乙醇等有機溶劑為分析純;米糠蠟、巴西棕櫚蠟、小燭樹蠟、蜂蠟、石蠟等均為市售。
1.2 儀器與設備
SXT-02索氏提取器(上海洪記),布式漏斗,BCD-187A IC冰箱(合肥美菱),6NS-20-4K W碾米脫皮機(山東激流),TDL-5A臺式離心機(上海安亭),DGG-9140BD鼓風干燥箱(上海森信),DSC 200F3差示掃描量熱儀(德國耐馳),CR400型色差計(日本美能達),萬能粉碎機(天津泰斯特),電子天平(梅特勒-托利多),6890N氣相色譜(美國Agilent Technologies),7683B自動進樣器(美國Agilent Technologies)。
1.3 試驗方法
1.3.1 高粱蠟的制備
高粱籽粒、脫皮高粱和麩皮分別置于裝有有機溶劑的索氏提取器中,在溶劑沸點溫度附近回流2h,采用5000 r/min離心20 min,上清液在-5℃下冷凍12 h將蠟析出,布氏漏斗真空過濾后干燥即為高粱蠟。
1.3.2 高粱蠟含量測定[9]
在-5℃下冷凍12 h析出溶劑后,用布氏漏斗抽濾,為了防止蠟質殘留在漏斗上,冷凍12 h和布氏漏斗真空過濾重復2次。蠟含量按下列公式進行計算:
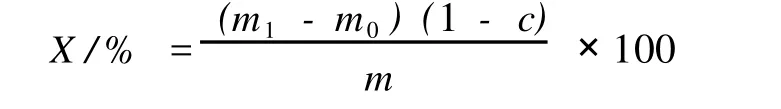
式中:X:蠟含量,g;m:回流固體質量,g;m1:干燥后質量,g;m0:濾紙原質量,g;c:水分含量,%。
1.3.3 水分含量測定
水分含量按照國標方法測定[10]。
1.3.4 顏色測定
色度采用L*a*b*色空間法,其中L*為蠟的亮度;a*和b*為色度,+a*為紅色方向,-a*為綠色方向;+b*為黃色方向,-b*為藍色方向,顏色的校準用CR-400的標準白板。
1.3.5 熱力學性質
采用差示掃描量熱儀(DSC)。稱取蠟樣品5 mg,壓片,以空鋁盒作參比。從25℃加熱至100℃,掃描速率為5℃/min,記錄每份樣品的焓和起始溫度、峰值溫度和終止溫度。
1.3.6 酸值、碘值、皂化值
采用蜂蠟國家標準方法測定[11]。
1.3.7 醇相皂化法制備高級烷醇
稱取從10 g高粱中提取的高粱蠟,置于250 mL三角瓶中,加入100 mL體積分數95%乙醇,同時加入過量的NaOH,85℃水浴加熱攪拌,并置于索式提取器中85℃下回流2 h。降溫至50℃后加入100 mL苯,攪拌40 min,再加入100 mL蒸餾水,倒入分液漏斗中50℃保溫靜置分層液液相分離,取苯萃取物在25℃下冷析結晶,抽濾,洗滌,得長鏈脂肪醇混合物。
1.3.8 二十八烷醇和三十烷醇的測定
1.3.8.1 氣相色譜操作條件
色譜操作條件為:色譜柱,HP-5(30 m×320 μm×0.25μm);柱溫,240℃保持1 min,以20℃/min速度升至300℃保持15 min;汽化室溫度,320℃;檢測器溫度:330℃;載氣(N2)流速,45.0 mL/min;氫氣(H2)流速,40.0 mL/min;助燃氣(air)流速,450 mL/min;進樣量1μL;分流比,4∶1;恒流。
1.3.8.2 二十八烷醇、三十烷醇標準曲線
準確稱取二十八烷醇和三十烷醇標準品各0.0500 g(精確至 0 .0001g)置于25 mL容量瓶中,用環己烷溶解定容作為標準溶液,濃度為2 mg/mL。準確稱取三苯基苯0.0600 g(精確至0.0001)置于100 mL容量瓶中,用環己烷溶解定容作為內標溶液,濃度為 0 .6 mg/mL。分別移取 0 .5、1.0、1.5、2.0、2.5 mL標準溶液,加入0.5 mL內標溶液置于10 mL容量瓶中,配成二十八烷醇和三十烷醇濃度分別為0.1、0.2、0.3、0.4、0.5 mg/mL,三苯基苯濃度為0.03 mg/mL的濃度梯度溶液。梯度標準溶液分別進樣1μL,進行測定,得到氣相色譜圖,時間為橫坐標,相應值為縱坐標的圖譜。以不同梯度標準溶液濃度為橫坐標,分別以各梯度溶液二十八烷醇和三十烷醇的出峰面積與內標三苯基苯的出峰面積的比值為縱坐標,作標準曲線。圖1,圖2分別為高級烷醇混標高級烷醇混標氣相色譜圖和二十八烷醇和三十烷醇標準曲線。由圖1,圖2得到回歸方程為y1=20.365x+0.025,R2=0.9953;y2=18.994x-0.0005,R2=0.9935。
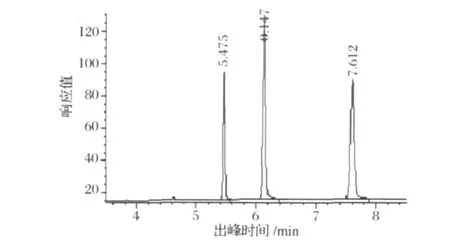
圖1 高級烷醇混標氣相色譜圖
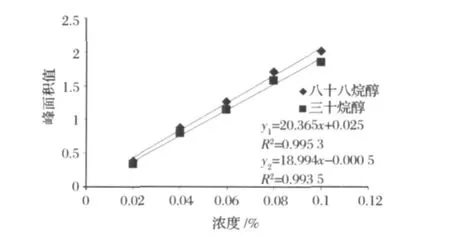
圖2 二十八烷醇和三十烷醇標準曲線
將皂化樣品置于100 mL容量瓶中,加入內標物三苯基苯,用環己烷溶解定容,并超聲溶解。抽取高粱樣品溶液1μL,進樣后測定,得到溶液中二十八烷醇和三十烷醇的峰和內標三苯基苯的峰,分別將二十八烷醇和三十烷醇的出峰面積與三苯基苯出峰面積的比值代入回歸方程得到樣品溶液中二十八烷醇和三十烷醇的含量,從而計算出高粱中二十八烷醇和三十烷醇的含量。
1.3.9 數據處理
不同溶劑提取高粱蠟比較如圖3所示。數據采用統計均數(平均數)±標準差來表示,用t檢驗進行顯著性分析。實驗數據用SAS8.2統計軟件進行方差與回歸分析擬合出模型,并采用Mathematica5.2軟件作圖。
2 結果與討論
2.1 不同溶劑提取高粱蠟能力比較
不同溶劑提取高粱蠟比較如圖3所示。

圖3 不同溶劑提取高粱蠟比較
比較高粱全粉、麩皮和去皮高粱中高粱蠟含量,發現在高粱籽粒中,蠟主要存在于高粱的麩皮中。8種有機溶劑提取高粱蠟的能力依次為乙醇>正己烷>甲醇>乙酸乙酯>石油醚>異丙醇>三氯甲烷>苯。為了進一步提高溶劑對高粱蠟的浸出率,采用乙醇和正己烷2種溶劑復配共同作用提取高粱蠟。
2.2 乙醇-水-正己烷雙液相法提取高粱蠟
為考察乙醇-水-正己烷雙液相法對高粱蠟提取的作用,對乙醇、正己烷及乙醇-水-正己烷體系提取做預試驗,結果顯示,體積分數100%乙醇的提取率為 0 .0967%±0.0081%,100%正己烷的提取率為0.0787%±0.0006%,乙醇-水-正己烷以體積分數4∶1∶5比例的雙液相體系提取率為0.1344%±0.0126%,遠遠高于單獨使用乙醇或正己烷的蠟提取率。
2.3 單因素試驗提取
2.3.1 烷料比對高粱全粉蠟提取率的影響
在預試驗的基礎上,固定單因素試驗的基本參數為醇料比(mL∶g)8∶1,乙醇體積分數80%,回流時間60 min,溫度78.3℃,研究不同烷料比對高粱蠟提取率的影響,其結果見圖4。由圖4可以看出,在烷料比2∶1-4∶1,高粱蠟的提取率隨正己烷加入量的提高而升高,4∶1以后,隨著正己烷加入量的增加高粱蠟的提取率有所下降,在4∶1具有最高點。
2.3.2 醇料比對高粱全粉蠟提取率的影響
固定單因素試驗的烷料比為10∶1,乙醇體積分數80%,回流時間60 min,溫度78.3℃,研究不同醇料比對高粱蠟提取率的影響,結果見圖5。由圖5可以看出,乙醇加入量對于高粱蠟的提取率影響較大,在8∶1前,隨著乙醇加入量的增加,高粱蠟的提取率有所提高,在8∶1以后提取率則隨著乙醇的加入而有所下降。
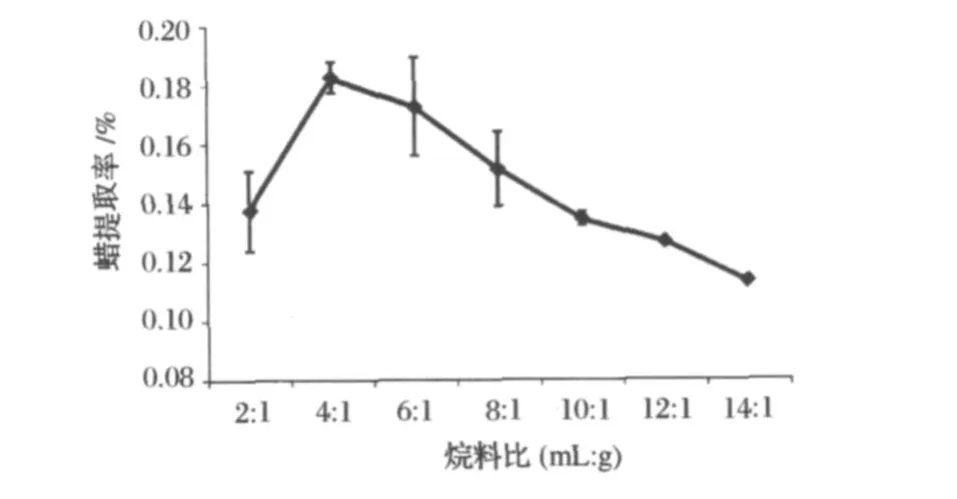
圖4 烷料比對高粱蠟提取率的影響
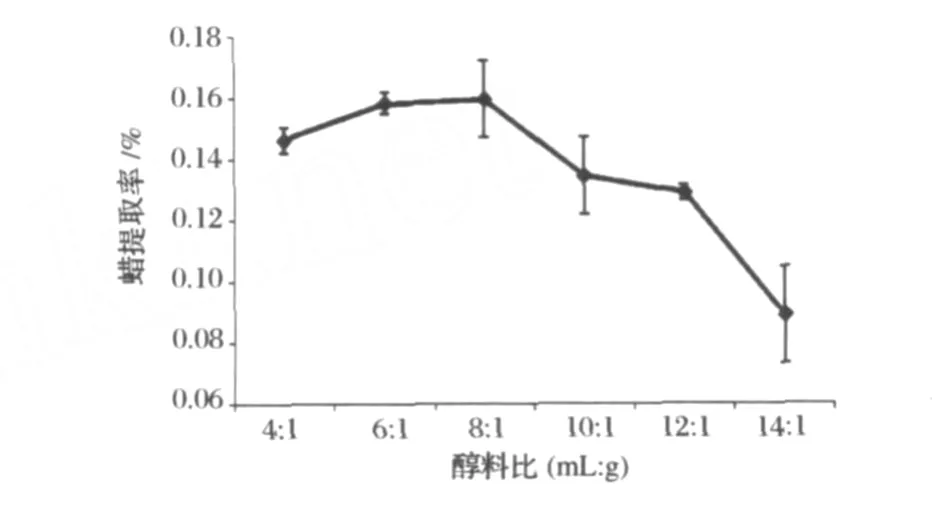
圖5 醇料比對高粱蠟提取率的影響
2.3.3 回流時間對高粱全粉蠟提取率的影響
確定進行單因素試驗的基本參數為烷料比為10∶1,醇料比8∶1,乙醇體積分數80%,溫度68.7-78.3℃,研究回流時間對高粱蠟提取率的影響,其結果見圖6。由圖6可以看出,回流時間對于高粱蠟的提取率影響較大,在70 min前,隨著回流時間的增加,高粱蠟的提取率有所提高,在70 min以后提取率則隨著回流時間的變化不大。
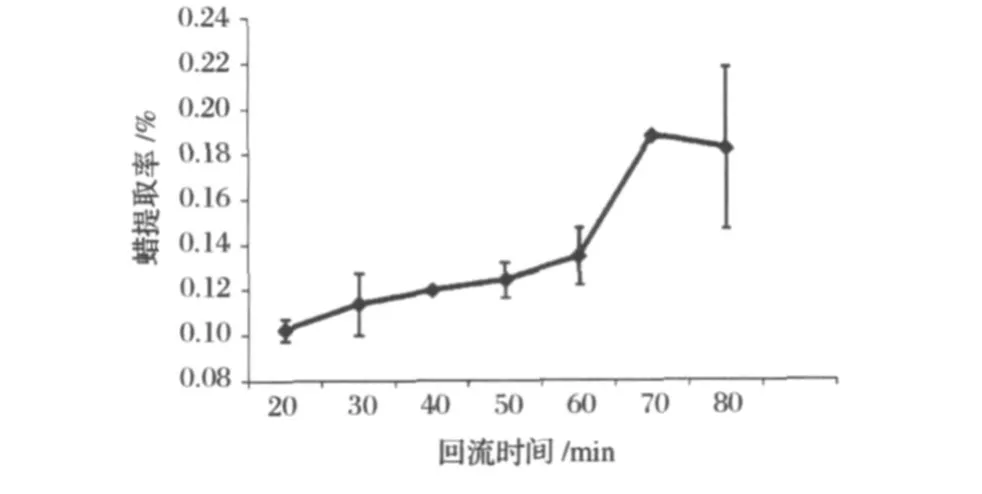
圖6 回流時間對高粱蠟提取率的影響
2.3.4 乙醇體積分數對高粱全粉蠟提取率的影響
確定進行單因素試驗的基本參數為烷料比為10∶1,醇料比8∶1,回流時間60 min,溫度68.7-78.3℃,研究乙醇體積分數對高粱蠟提取率的影響,其結果見圖7。由圖7可以看出,在乙醇體積分數低于60%時,蠟的提取率隨著乙醇體積分數的增加而提高,超過60%后,高粱蠟的提取率有所下降。在乙醇體積分數為60%時獲得最大的蠟提取率。
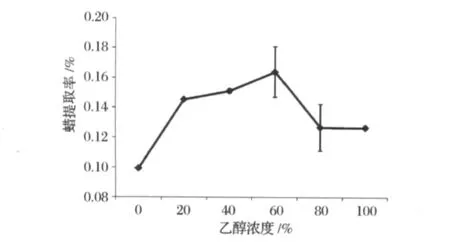
圖7 乙醇體積分數對高粱蠟提取率的影響
2.4 二次回歸旋轉設計
根據Box-Benhnken的中心組合實驗設計原理[12],在單因素影響實驗基礎上,固定乙醇體積分數為60%,選取烷料比、醇料比和提取時間3個因素,進行三因素的響應面分析優化試驗。由p=2查表[13]得m0=5,n=13,r=1.414。確定烷料比x1的零水平為x01=4,△1=2;醇料比x2的零水平為x02=8,△2=2;提取時間x3的零水平為x03=70,△3=20。共有24個實驗點,其中20個為析因子,4個為零點。零點實驗進行3次以估計誤差。設計三因素二次回歸通用旋轉組合試驗,蠟提取率見表2。查表得K=0.2,E=-0.1,F=0.14375,G=0.01875,e-1=0.125和mc-1=0.25,實驗以隨機次序進行,重復3次,獲得的蠟提取率的平均值方程、響應面分析圖和方差分析表。采用回歸方程:,由表3的數據,計算出回歸方程中各系數,見表4。
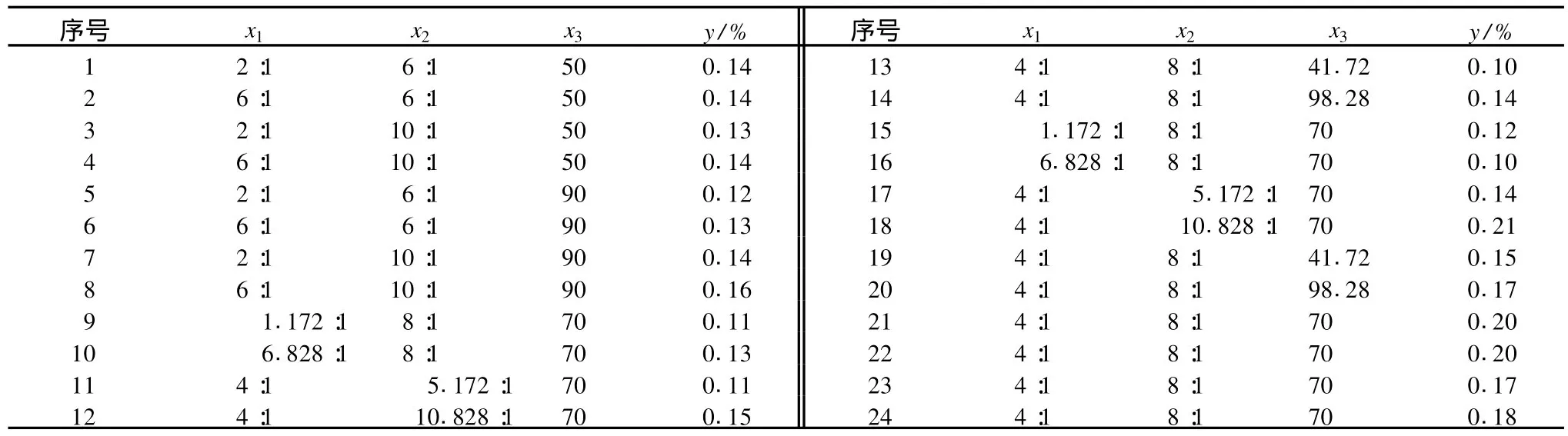
表1 試驗方案及結果

表2 回歸方程的方差分析結果
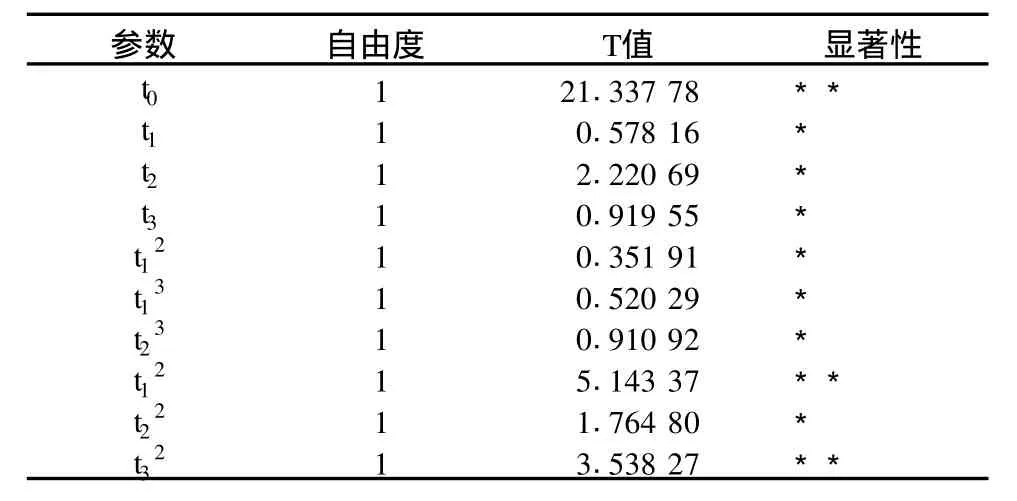
表3 回歸系數取值
查表得P=3,K=0.16634,-E=0.05679,F=0.06939,G=0.00689,e-1=0.0732,mc-1=0.125。根據表1試驗結果進行計算,得到回歸模型為。表2是回歸方程的方差分析結果,由表2可以看出,FLf=2.49522
回歸模型的響應面圖見圖8、圖9和圖10。各圖分別表示x1、x2和x3中一個變量取零時,其余2個變量對蠟提取率的影響。
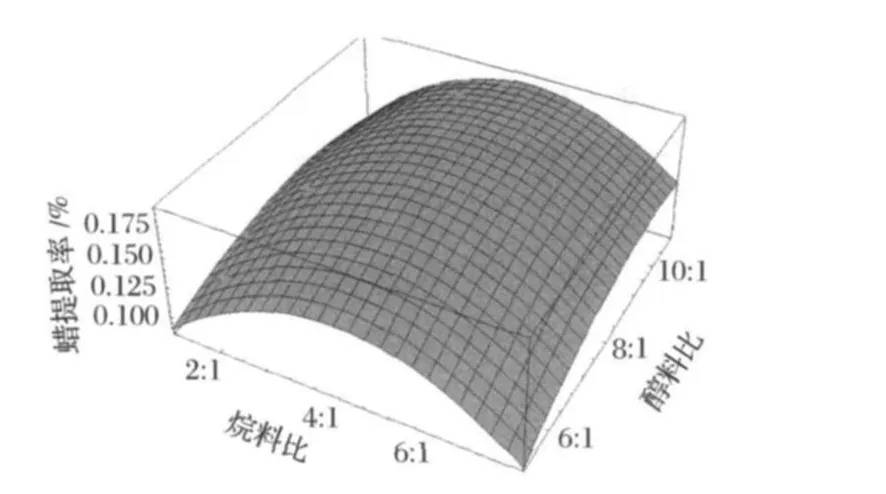
圖8 烷料比x1與醇料比x2對蠟提取率影響響應面分析圖
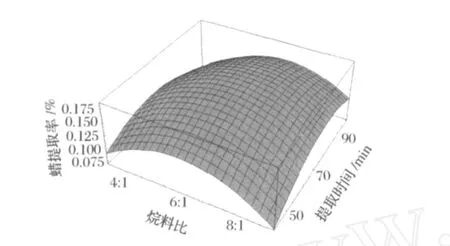
圖9 烷料比x1與提取時間x3對蠟提取率影響響應面分析圖
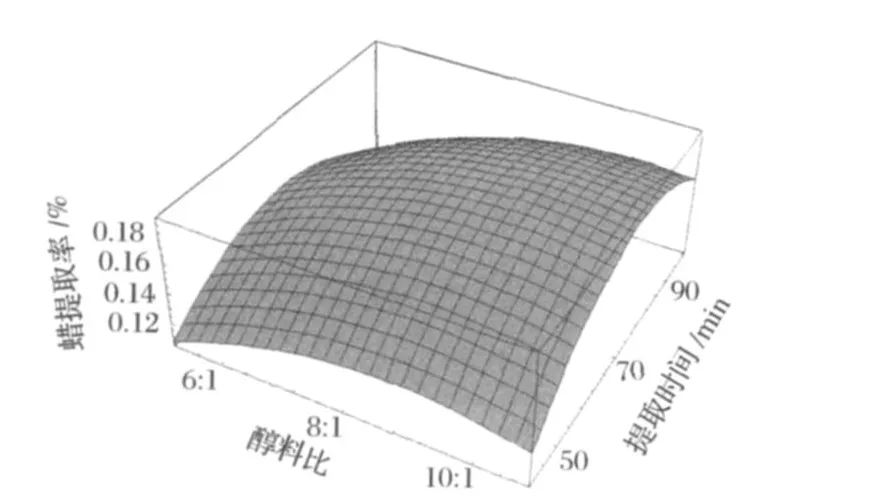
圖10 醇料比x2與提取時間x3對蠟提取率影響響應面分析圖
2.5 高粱蠟理化性質分析
圖11為高粱蠟與幾種常見蠟的DSC分析,表5為高粱蠟與幾種常見蠟理化性質分析。由圖11可以看出,除蜂蠟出現2個峰外,各種蠟的DSC掃描均出現一個寬峰,其中高粱蠟的熔點范圍(66.5-77.6℃),與Kummerow[14]的81℃,Bunger[15]的77-82℃,和Freeman[16]78℃相比略低,與巴西棕櫚蠟(77.7-81.5℃)和小燭樹蠟(83.3-86.7℃)較為接近,但遠遠高于米糠蠟、蜂蠟和石蠟的熔點。由表4可以看出,與其他蠟相比,高粱蠟樣品中顏色較紅,原因在于高粱中含有大量的高粱紅色素,部分色素在乙醇溶液中和蠟一起被溶劑提取。測定高粱蠟的酸值為10.98±0.29,與Bunger[15]的10.5-16.22相同,碘值為18.94±0.29,皂化值為77.53±0.47,高于Bunger[15]的16-44。3項指標均在蜂蠟標準的合格范圍內[11]。由于蠟的酸值、碘值和皂化值隨著貯存時間和貯存條件的不同而明顯變化,因此無法將高粱蠟的這幾項指標與其他蠟作比較。
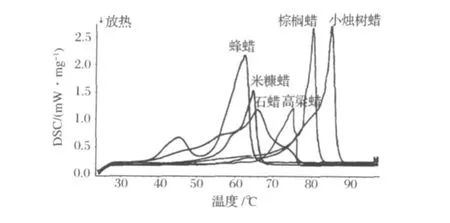
圖11 高粱蠟與幾種常見蠟DSC分析
2.6 高粱蠟中高級烷醇含量分析
高級烷醇(policosanol)是十二個碳原子以上蠟狀飽和脂肪醇[17],對動植物具有重要的生理活性[18],其中高粱中含量較高的是二十八烷醇和三十烷醇,二十八烷醇和三十烷醇分子式見圖12。二十八烷醇具有增進體力、增強耐力、精力[19],提高反應靈敏性和應激能力,提高機體代謝率,改善心肌功能,降低血清膽固醇和甘油三酯含量,降低收縮期血壓等功能;三十烷醇對動植物的生長和發育具有特殊的調節和控制作用[20]。
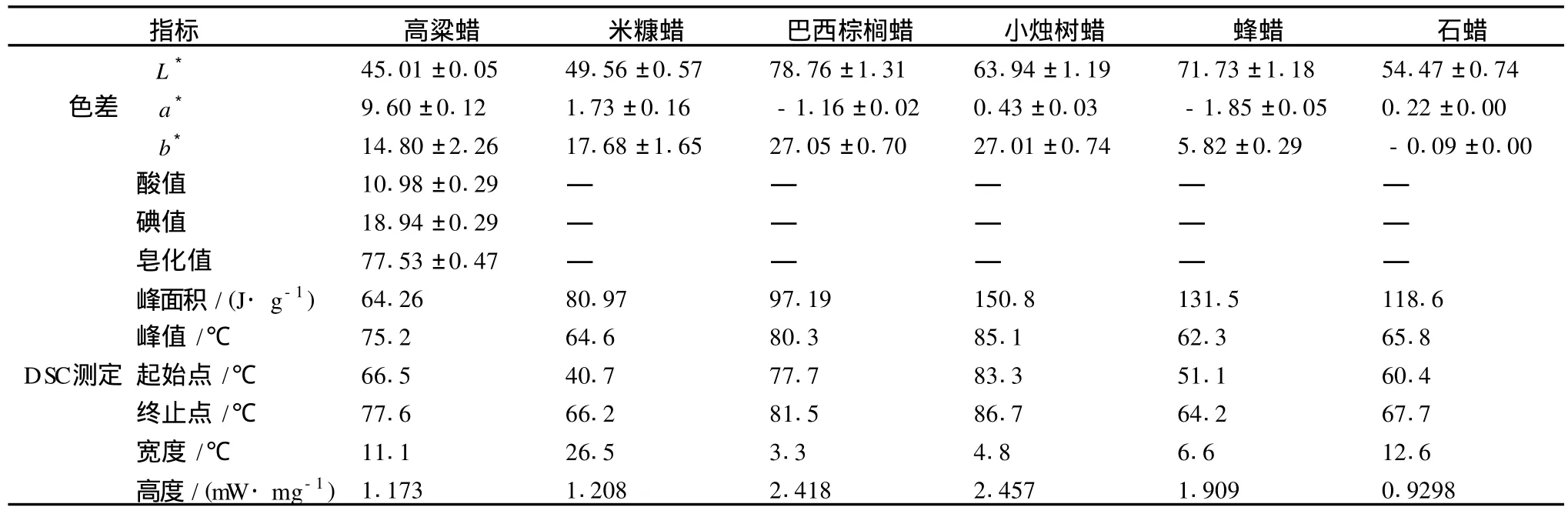
表4 高粱蠟與幾種常見蠟理化性質
圖12 二十八烷醇和三十烷醇分子式
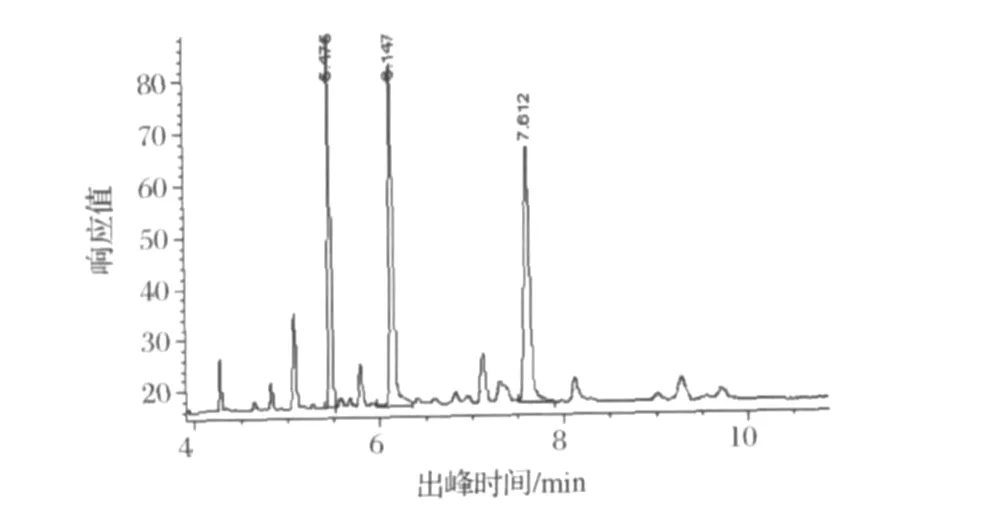
圖13 高粱蠟中高級烷醇含量
高粱蠟是由長鏈脂肪酸和長鏈脂肪醇結合成的脂類。由圖13可以看出,皂化后樣品中含有多種長鏈的脂肪酸和脂肪醇,其中以二十八烷醇和三十烷醇的量居多,對比標準曲線樣品濃度達到(0.06590±0.00036)mg/mL和(0.0742±0.00066)mg/mL。由高粱全粉中高粱蠟含量0.3%,得到高粱蠟中二十八烷醇和三十烷醇含量約為21.97%±0.12%和24.73%±0.22%。與文獻報道高粱蠟中高級烷醇含量近似為19%-46%相符[21-23]。
3 討論
提取出的高粱蠟為暗紅色,說明采用三元雙液相法提取的高粱蠟中含有部分高粱紅色素。而對高粱蠟的性質分析發現高粱蠟具有相對狹小的熔點范圍(66.5-77.6℃),高粱蠟中二十八烷醇和三十烷醇含量之和約為46.70%,近似為高粱蠟含量的50%,含量與文獻報道的相符,說明提取得到的高粱蠟的純度較高。因此該方法是一種較好的高粱蠟提取方法,在后續的研究中可對于三元雙液相方法提取的高粱蠟作進一步的純化。
4 結論
(1)高粱籽粒中蠟主要存在于麩皮中。
(2)比較8種溶劑,乙醇和正己烷對高粱全粉中的高粱蠟提取率較高。
(3)乙醇-水-正己烷三元雙液相法能有效提高高粱蠟的提取率,應用響應面方法進行高粱蠟乙醇-水-正己烷三元雙液相法提取工藝優化,高粱蠟的優化工藝條件為:烷料(mL∶g)比為7.21∶1,醇料比為(mL∶g)9.92∶1,提取時間為80 min,在此條件下提取高粱蠟的理論值可達0.3018%。采用上述最優提取條件進行驗證試驗,實際提取高粱蠟為0.2975%。
(4)提取高粱蠟的性質如下:色度(L*a*b*)分別為45.01、9.60和14.80,酸值10.98,碘值18.94,皂化值77.53。高粱蠟熔點范圍為66.5-77.6℃,與巴西棕櫚蠟接近。
(5)高粱蠟中二十八烷醇和三十烷醇含量分別為21.97%和24.73%。
[1]AdebiyiA O,AdebiyiA P,Olaniyi E O.Nutritional composition of sorghum bicolor starch hydrolyzed with amylase from Rhizopus sp [J].JAOCS,2002,79(6):1089-1094.
[2]譚斌 .粒用高粱的特性及其在食品工業中開發利用前景[J].糧食與飼料工業,2007(7):16-19.
[3]譚斌 .高梁食品研究開發的現狀與展望[C].ICC第十三屆國際糧油科技大會論文集,2007.
[4]Hwang K T,Cuppett SL,Weller C L.Properties,composition,and analysis of grain sorghum wax[J].JAOCS,2002,79(6):521-527.
[5]Lochte K R,Weller C L.Wax Content of grain sorghum(Sorghum bicolor)as affected by mechanical harvesting,threshing,handling methods[J],Appl Engr Agr,1999,15:69-72.
[6]Kummerow F A.The Composition of the oil extracted from 14 different varieties of andropogon sorghum var[J].Vulgaris Ibid,1946,23:273-275.
[7]Avato P,Bianchi G,Murelli C.Aliphatic and cyclic lipid components of sorghum plant organs[J].Phytochemistry 1990,29:1073-1078.
[8]Saraiva R A.Sorghum wax and selected applications[D].Lincoln:University ofNebraska,1995
[9]Karen R L.Recovery of sorghum wax from selected processes[D].Lincoln:University ofNebraska,2001
[10]食物中水分的測定[S].GB/T 5009.3-2003.
[11]蜂蠟[S].LS/T 10190-1993.
[12]Box G E P,Hunter WG,Hunter J S.Statistics for experiments:an introduction to design,data,analysis,and model building[M].New York:W iley,1978:120
[13]袁志發,周靜芋 .試驗設計與分析 [ M].北京:高等教育出版社,2000.
[14]Kummerow F A.The composition of sorghum grain oilandropogonsorghumvar.vulgaris[J].Oil&Soap,1946,23(5):167-170.
[15]Bunger W B,Kummerow F A.A Comparison of several methods for the separation of unsaponifiable material from carnauba and grain sorghum waxes[J].J Am Oil Chem Soc,1951,28:121-123.
[16]Freeman J E,Watson S A.,Peeling sorghum grain for wetmilling[J].Cereal Sci Today,1969,14(2):10-15.
[17]汪小蘭.有機化學[M].北京:人民教育出版社,1979.
[18]McCarthyM F.Policosanol safely down-regulates HMG-CoAreductase potential as a component of the Esselstyn regimen[J].Medical Hypotheses,2002,59,268-279.
[19]Hyunjung K,Sunghee P,Dae S H,et al.,Octacosanol supplementation increases running endurance time and improves biochemical parametersafterexhaustion in trained rats[J].Journal ofMedicinal Food,2003,6(4):345-351.
[20]Kapitsimadi C,Vioryl SA.Effectof a long chain aliphatic alcohol(triacontanol)on growth and yield of different horticultural crops[J].Acta Hort(ISHS),1995(379):237-244.
[21]Hwang K T,Weller C L,Cuppett S L,Et al.,Policosanol contents and composition of grain sorghum kernels and dried distillers grains[J].Cereal Chemistry,2004,81(3):345-349.
[22]Hwang K T,Kim J E,Weller C L.Policosanol contents and compositions in wax-like materials extracted from selected cereals of korean origin[J].Cereal Chemistry,2005,82(3):242-245.
[23]Awika J M,Rooney L W.Sorghum phytochemicals and their potential impact on human health[J].Phytochemistry,2004(65):1199-1220.
ABSTRACTSorghum wax was extracted by means of organic dissolvent reflux with two-liquid-phase system.Extraction solvent and technological conditionswere optimized by response surface methodology(RS M).Based on extraction rate,the optimal extraction conditionswere dete rmined as follows:hexane-material ratio 7.21∶1,ethanol-material ratio 9.92∶1 and extraction t ime 80 min.The theoretical value of extraction rate was 0.3018%at the optimum extraction conditions.The actual extraction rate was 0.2975%.The properties of the extracted sorghum wax as follows:Color intensity(L*a*b*)was 45.01±0.05,9.60±0.12 and 14.80±2.26 respectively;Acid number was 10.98±0.29; Iodine value was 18.94±0.29;Saponification value was 77.53±0.47;Melting range was 66.5℃-77.6℃.TheMelting range of sorghum waxwas similar to thatof carnaubawax,and higher than thatof rice branwax,bee swax,paraffin.The contents of octacosanol and triacontanol of saponified in sorghum wax were 0.06590% ±0.00036%and 0.0742%±0.00066%,respectively.
Key wordssorghum wax,two-liquid-phase,response surface methodology,octacosanol,triacontanol
Optim ization of the Extraction of Orghum Wax with Two-liquid-phase System and Properties of the Sorghum Wax
LiuMing1,Tan Bin1,Tan Hongzhuo1,Tian Xiaohong1,Shen Qun2
1(Academy of State Administration of Grain,Beijing 100037,China)
2(College of Food Science and Nutritional Engineering,China AgriculturalUniversity,Beijing 100083,China)
碩士,助理研究員(譚斌副研究員為通訊作者)。
*科技部“十一五”國家科技支撐計劃重點項目課題資助(No.2006BAD02B01)
2009-08-25,改回日期:2010-03-05

