普魯蘭多糖高產(chǎn)菌株Y68葡萄糖基轉(zhuǎn)移酶的純化及特性研究
段效輝,耿金培,方紹慶,李俊峰
(1.煙臺(tái)出入境檢驗(yàn)檢疫局,山東煙臺(tái) 264000;2.青島科技大學(xué),山東青島 266003)
普魯蘭多糖高產(chǎn)菌株Y68葡萄糖基轉(zhuǎn)移酶的純化及特性研究
段效輝1,耿金培1,方紹慶1,李俊峰2
(1.煙臺(tái)出入境檢驗(yàn)檢疫局,山東煙臺(tái) 264000;2.青島科技大學(xué),山東青島 266003)
運(yùn)用離子交換層析法和凝膠過濾層析法分離純化普魯蘭多糖高產(chǎn)菌株Y68胞內(nèi)葡萄糖基轉(zhuǎn)移酶(簡(jiǎn)稱GTF),并以SDS-PAGE、Native-PAGE對(duì)蛋白質(zhì)進(jìn)行量化、比較及特性鑒定,研究其酶學(xué)特性。結(jié)果表明短梗霉Y68中GTF被分離純化,純化酶在SDS-PAGE凝膠電泳上顯示分子量50.8 ku單一條帶,而在Native-PAGE凝膠電泳上顯示分子量350 ku單一條帶。純化酶的最適酶反應(yīng)pH和最適酶反應(yīng)溫度分別為6.0和40℃,酶對(duì)pH十分敏感,穩(wěn)定性較差,對(duì)溫度的穩(wěn)定性則稍好。GTF為金屬酶,Na+和K+對(duì)酶有激活作用,Ca2+、Mn2+、Mg2+、Ba2+、Cu2+、Fe2+、Hg2+、Co2+對(duì)酶活性有抑制作用,Hg2+對(duì)酶活性的抑制作用說明酶活性中心含有二锍鍵。EDTA、PMSF、SDS和碘乙酸對(duì)GTF活性有很大的抑制作用,而二硫蘇糖醇(DTT)對(duì)酶活性有保護(hù)作用。
短梗霉;葡萄糖基轉(zhuǎn)移酶;胞內(nèi)酶;純化
普魯蘭多糖是一種由出芽短梗霉發(fā)酵所產(chǎn)生的類似葡聚糖、黃原膠的胞外水溶性粘質(zhì)多糖。該多糖有兩個(gè)重要的特性:結(jié)構(gòu)上富有彈性,溶解度比較大。普魯蘭多糖的成膜性、阻氣性、可塑性、粘性均較強(qiáng),并且具有易溶于水、無毒無害、無色無味等優(yōu)良特性,像很多的微生物胞外多糖一樣已廣泛應(yīng)用于醫(yī)藥、食品、輕工、化工和石油等領(lǐng)域[1-2]。2006年5月19日,國(guó)家衛(wèi)生部發(fā)布了第8號(hào)公告,普魯蘭多糖為新增4種食品添加劑之一,可在糖果、巧克力包衣、膜片、復(fù)合調(diào)味劑和果蔬汁飲料中用作被膜劑和增稠劑。普魯蘭多糖在食品領(lǐng)域越來越廣泛的應(yīng)用也使得對(duì)該多糖的工業(yè)化生產(chǎn)變得迫在眉睫。葡萄糖基轉(zhuǎn)移酶(GTF)是糖基轉(zhuǎn)移酶的一種,它具有催化高能底物合成聚糖的功能,來自于微生物的GTF能夠從許多形式的D-葡萄糖基供體物質(zhì)中把非還原的D-葡萄糖殘基轉(zhuǎn)移到合適的受體物質(zhì),它也能夠幫助轉(zhuǎn)移葡萄糖基到C6羥基從而合成寡糖和糖苷,并進(jìn)而組裝成為線性或分枝的糖鏈[3]。目前研究較多的有引起齲齒的變形鏈球菌中的GTF及微生物合成海藻糖必需的GTF等。微生物出芽短梗霉可合成胞外普魯蘭多糖,作為一種具有轉(zhuǎn)葡糖苷作用的轉(zhuǎn)移酶,GTF在普魯蘭多糖的合成中扮演著怎樣的角色,目前還未見報(bào)道。本實(shí)驗(yàn)室保存的短梗霉菌株Y68,不產(chǎn)黑色素,轉(zhuǎn)化率高,胞外普魯蘭多糖產(chǎn)量最高可達(dá)14.7 g/g細(xì)胞干重[4-5],明顯高于目前報(bào)道的其他短梗霉菌株的產(chǎn)量,具備了研究高產(chǎn)菌株普魯蘭多糖產(chǎn)量與GTF間關(guān)系的基礎(chǔ)。本研究對(duì)普魯蘭多糖高產(chǎn)菌株Y68細(xì)胞內(nèi)GTF活力與胞外多糖產(chǎn)量間的關(guān)系進(jìn)行研究,并分離純化其細(xì)胞內(nèi)GTF,研究其酶學(xué)特性,為實(shí)現(xiàn)普魯蘭多糖工業(yè)化生產(chǎn)提供理論基礎(chǔ)。
1 材料與方法
1.1 材料
1.1.1 菌株 普魯蘭多糖高產(chǎn)菌株短梗霉Y68 (本實(shí)驗(yàn)室于-80℃保藏)。
1.1.2 培養(yǎng)基 ①YPD培養(yǎng)基:可溶性淀粉20.0 g,蛋白陳20.0 g,酵母粉10.0 g,葡萄糖20.0 g,蒸餾水1000 mL,115℃,滅菌30 min;②豆餅粉水解液培養(yǎng)基(質(zhì)量體積比,%):葡萄糖2.0,豆餅粉水解液2.0,K2HPO40.5,NaCl 0.1,MgSO4·7H2O 0.02,(NH4)2SO40.06,初始pH 6.5,121℃,滅菌20 min。
1.1.3 儀器 超濾系統(tǒng):LabscaleTMTFF System, Millipore,美國(guó);蛋白質(zhì)純化系統(tǒng):?KTATMpri me with HitrapTM,Amersham,瑞典;雙向電泳系統(tǒng): Amersham,瑞典。
1.2 方法
1.2.1 Y68細(xì)胞外普魯蘭多糖產(chǎn)量與細(xì)胞內(nèi)GTF活力的關(guān)系研究 分別選擇葡萄糖、蔗糖、糊精、果糖、麥芽糖和木糖作為培養(yǎng)基唯一碳源,28℃培養(yǎng)60 h后,測(cè)定不同碳源情況下胞外普魯蘭多糖產(chǎn)量和胞內(nèi)GTF活力。①胞外普魯蘭多糖產(chǎn)量的測(cè)定:Y68菌株28℃發(fā)酵培養(yǎng)60 h,發(fā)酵液沸水浴15min,降溫后離心(12000 r/min,4℃, 6 min)。取上清液3 mL,加入2倍體積的冰凍無水乙醇,混合均勻,將混合物于4℃下放置數(shù)小時(shí),離心(12000 r/min,4℃,6 min)。棄上清液,將獲得的多糖在80℃烘干至恒重,電子天平稱重;②GTF活性測(cè)定:在10 mm×150 mm試管加入0.2 mL,10 mmol 4-硝基-α-D-吡啶葡萄糖苷(PNPG),在40℃水浴中進(jìn)行溫度平衡5 min(4-硝基-α-D-吡啶葡萄糖苷用0.1 mol/L,pH 4.0乙酸鈉緩沖液進(jìn)行配制);在溫度平衡的底物試管中加入0.2 mL經(jīng)過適當(dāng)稀釋的待測(cè)酶液,快速混勻后開始計(jì)時(shí),反應(yīng)時(shí)間共5 min;反應(yīng)達(dá)到預(yù)定時(shí)間時(shí),加入3 mL 0.4 mol/L、pH 10.5的甘氨酸-NaOH緩沖液中止反應(yīng);測(cè)定OD405nm,由標(biāo)準(zhǔn)曲線進(jìn)行計(jì)算。酶活單位定義為每分鐘釋放1μmol 4-硝基酚所需要的酶量[6]。
1.2.2 GTF蛋白的純化 結(jié)合Sephadex G-200凝膠過濾和DEAE-Sephorose Fast Flow陰離子交換2種色譜方法,純化Y68細(xì)胞內(nèi)GTF,收集具有GTF酶活力的洗脫液進(jìn)行酶學(xué)特性分析,并利用蛋白電泳進(jìn)行量化分析。①總蛋白的測(cè)定:蛋白含量測(cè)定采用Bradford的方法,以牛血清白蛋白為標(biāo)準(zhǔn)[7];②粗酶液的制備:活化菌種接種于裝有50 mL豆餅粉水解液培養(yǎng)基的三角瓶中28℃、180 r/min培養(yǎng)8~10 h,4℃、2500 r/min離心5 min收集菌體,冷凍蒸餾水洗滌3次,每50 mL培養(yǎng)液得到的菌體用磷酸鹽緩沖液重新懸浮后加入0.1 mL、10 mg/mL消解酶(zymolyase,Sigma),37℃,酶作用90 min。4℃、14000 r/min離心20 min,去除細(xì)胞碎片,上清即為粗酶液。多次處理得到的粗酶液,在超濾系統(tǒng)濃縮至6~9 mL。整個(gè)超濾過程在4℃下進(jìn)行;③Sephadex G-200凝膠過濾:將超濾后得到的濃縮液上樣至上述平衡后且均勻的凝膠柱。在柱壓0.1 MPa、流速0.5 mL/min條件下洗脫,自動(dòng)分部收集,每管收集3 mL,測(cè)定每個(gè)收集管GTF活力和總蛋白含量。整個(gè)洗脫過程在Amersham蛋白質(zhì)純化系統(tǒng)中4℃下進(jìn)行,波長(zhǎng)280 nm下檢測(cè)樣品光吸收,自動(dòng)分部收集,每管收集3 mL;④DEAE-Sephorose Fast Flow陰離子交換:將凝膠過濾分部收集的具有GTF活力的收集管合并,使用50 ku離心超濾膜(Millipore,美國(guó)),4℃、14000 r/min離心濃縮至4~6 mL,除0.5 mL用于凝膠電泳檢測(cè)外,全部上樣至16 cm×25 cm DEAE-Sephorose Fast Flow陰離子交換層析柱,在柱壓0.3MPa、流速1 mL/min下用1 mol/L NaCl和離子交換緩沖液梯度洗脫,利用Amersham蛋白質(zhì)純化系統(tǒng)自動(dòng)分部收集,每管收集3 mL;⑤超濾濃縮收集液:經(jīng)離子交換層析收集的樣品使用50 ku離心超濾膜(Millipore,美國(guó)),4℃、14000 r/min離心濃縮至4~6 mL;⑥不連續(xù)SDS聚丙烯酰胺凝膠電泳(SDSPAGE):參照Laemmli的方法進(jìn)行SDS-PAGE凝膠電泳[8];⑦連續(xù)常規(guī)聚丙烯酰胺凝膠電泳(N-ative-PAGE):參照Laemmli的方法進(jìn)行SDSPAGE凝膠電泳[8];⑧GTF活力的測(cè)定:同
1.2.1 ②。
1.2.3 Y68細(xì)胞內(nèi)GTF酶學(xué)特性研究 ①酶的最適反應(yīng)溫度和溫度穩(wěn)定性:酶反應(yīng)混合物分別于28、30、37、40、42、45、50、55、60和65℃水浴中反應(yīng)5 min,分別測(cè)定GTF活力,確定酶的最適反應(yīng)溫度。將純化的酶液置于28、30、37、40、42、45、50、55、60和65℃水浴中保溫10 min,按常規(guī)酶活測(cè)定方法測(cè)剩余酶活力,確定酶的溫度穩(wěn)定性;②酶的最適反應(yīng)pH和pH穩(wěn)定性:分別以pH為3.0、4.0、4.6、5.0、5.6、6.0、7.0、8.0的緩沖液取代原測(cè)定方法中的緩沖液,測(cè)定不同pH下GTF的活力,確定酶的最適反應(yīng)pH。使用的緩沖液包括0.01 mol/L乙酸緩沖液(pH 4.0~5.0), 0.01 mol/L磷酸緩沖液(pH 6.0~7.0)和0.01 mol/L Tris-HCl緩沖液(pH 7.5~9.0)。純化的酶液分別與pH為3.0、4.0、4.6、5.0、5.6、6.0、7.0、8.0的緩沖液等體積混合,4℃保溫30 min,按常規(guī)酶活測(cè)定方法測(cè)剩余酶活力,確定酶的pH穩(wěn)定性;③金屬離子對(duì)酶活性的影響:在酶活測(cè)定反應(yīng)混合物中加入Ba2+、Cu2+、Mg2+、Fe2+、Ca2+、Mn2+、Co2+、K+、Na+、Hg+,一價(jià)離子使用濃度為12.5 mmol/L,二價(jià)離子使用濃度為25 mmol/L,測(cè)定GTF活力;④各種蛋白抑制劑對(duì)酶活性的影響:將各種蛋白抑制劑(二硫蘇糖醇(DTT)、乙二胺四乙酸(EDTA)、苯甲基磺酰氟(PMSF)、碘乙酸、十二烷基硫酸鈉(SDS))加入純化的酶液中,4℃保溫10 min,按常規(guī)酶活測(cè)定方法測(cè)剩余酶活力;⑤Km和Vm ax值的測(cè)定:為測(cè)定純化酶液對(duì)PNPG的Km和Vm ax,測(cè)定PNPG的濃度分別為0.5、2.5、5.0、7.5和10 mmol/L時(shí)的GTF活力;以底物濃度的倒數(shù)為橫坐標(biāo),反應(yīng)速度倒數(shù)為縱坐標(biāo)做圖。
2 結(jié) 果
2.1 不同碳源情況下胞外普魯蘭多糖產(chǎn)量與胞內(nèi)GTF活力的關(guān)系
以不同的碳源配制的培養(yǎng)基28℃、180 r/ min培養(yǎng)Y68菌株60 h,測(cè)定其胞內(nèi)GTF的活力和胞外普魯蘭多糖產(chǎn)量,研究碳源對(duì)GTF活力的影響,了解GTF與胞外多糖產(chǎn)量之間的關(guān)系,結(jié)果見圖1。
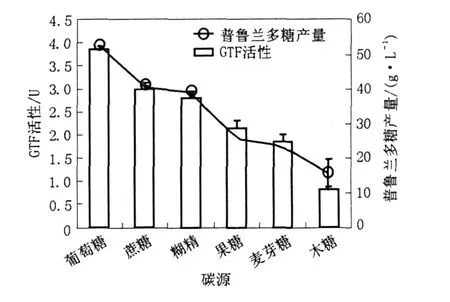
圖1 不同碳源培養(yǎng)基對(duì)胞外普魯蘭多糖產(chǎn)量和胞內(nèi)GTF的影響Fig.1 The changes in pullulan yield and enzyme activity in the fermentation medium with different carbon sources
由圖1看到,當(dāng)葡萄糖作為培養(yǎng)基中唯一碳源時(shí),GTF的活力相對(duì)于其他碳源培養(yǎng)基是最高的,而木糖作為唯一碳源時(shí)活力是最低的,其變化規(guī)律與胞外多糖產(chǎn)量的變化基本相同。這一結(jié)果表明該酶與胞外多糖產(chǎn)量之間關(guān)系密切,很可能碳源通過對(duì)GTF的影響進(jìn)而影響到胞外多糖產(chǎn)量的變化。從另一方面也可以說明胞內(nèi)GTF有效促進(jìn)了胞外普魯蘭多糖的產(chǎn)生。
2.2 GTF的分離與純化
2.2.1 GTF的分離純化 將3.0 mL經(jīng)超濾濃縮的粗酶液上樣至經(jīng)凝膠過濾緩沖液平衡的Sephadex G-200凝膠過濾層析柱上,用凝膠過濾緩沖液洗脫。經(jīng)酶活測(cè)定得知,粗酶液在Sephadex G-200凝膠過濾中出現(xiàn)第1個(gè)洗脫峰具有GTF活性。將Sephadex G-200凝膠過濾自動(dòng)收集的、具有GTF活力的收集管合并,全部上樣至經(jīng)陰離子交換緩沖液平衡的DEAE-Sepharose Fast Flow陰離子交換層析柱,待樣品被凝膠吸收后,陰離子交換緩沖液洗滌層析柱1 h,用1 mol/L NaCl和離子交換緩沖液進(jìn)行梯度洗脫,經(jīng)酶活測(cè)定發(fā)現(xiàn),在NaCl濃度達(dá)到0.59 mol/L時(shí),出現(xiàn)的第1個(gè)峰具有GTF活力。將具有活性的純化酶液用50 ku的離心超濾膜(Millipore,美國(guó))濃縮至4~6 mL,電泳檢測(cè)純度并進(jìn)行分子量測(cè)定,結(jié)果見表1。
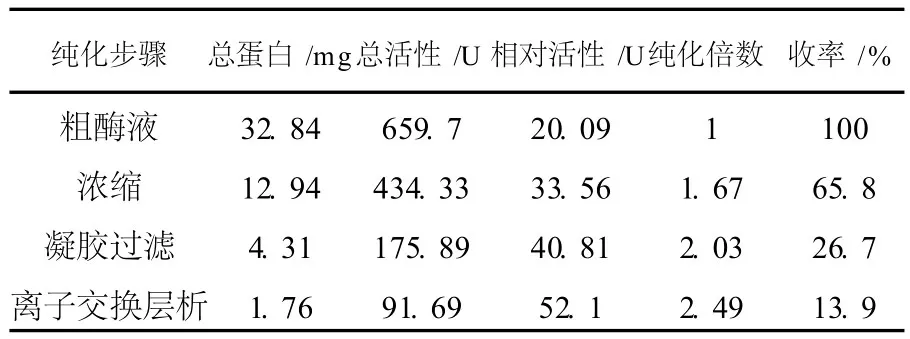
表1 GTF的分離純化結(jié)果Table 1 Summary of purification procedures of glucosyltransferase
普魯蘭多糖高產(chǎn)菌株Y68經(jīng)細(xì)胞破碎釋放胞內(nèi)蛋白、超濾濃縮、Sephadex G-200凝膠過濾和DEAE-Sepharose Fast Flow陰離子交換層析等純化過程,經(jīng)SDS-PAGE和Native-PAGE電泳證實(shí), GTF被純化,純化倍數(shù)2.49倍,收率13.9%。
2.2.2 不連續(xù)SDS-PAGE和連續(xù)Native-PAGE聚丙烯酰胺凝膠電泳 經(jīng)濃縮的純化酶液20μL與等量的SDS-PAGE電泳樣品緩沖液混合,沸水加熱5 min,上樣至5%濃縮膠、12%分離膠制成的非連續(xù)聚丙烯酰胺凝膠上、120 V穩(wěn)壓電泳至溴酚藍(lán)前沿進(jìn)入分離膠,改用200 V穩(wěn)壓電泳至溴酚藍(lán)前沿離凝膠下沿1~2 cm。結(jié)束電泳小心取出凝膠,按上述方法用考馬斯亮藍(lán)進(jìn)行染色,結(jié)果見圖2。圖2顯示目標(biāo)蛋白為單一條帶,經(jīng)凝膠成像系統(tǒng)(G:Box Syngene,英國(guó))分析,純化蛋白的表觀分子量為50.8 ku。
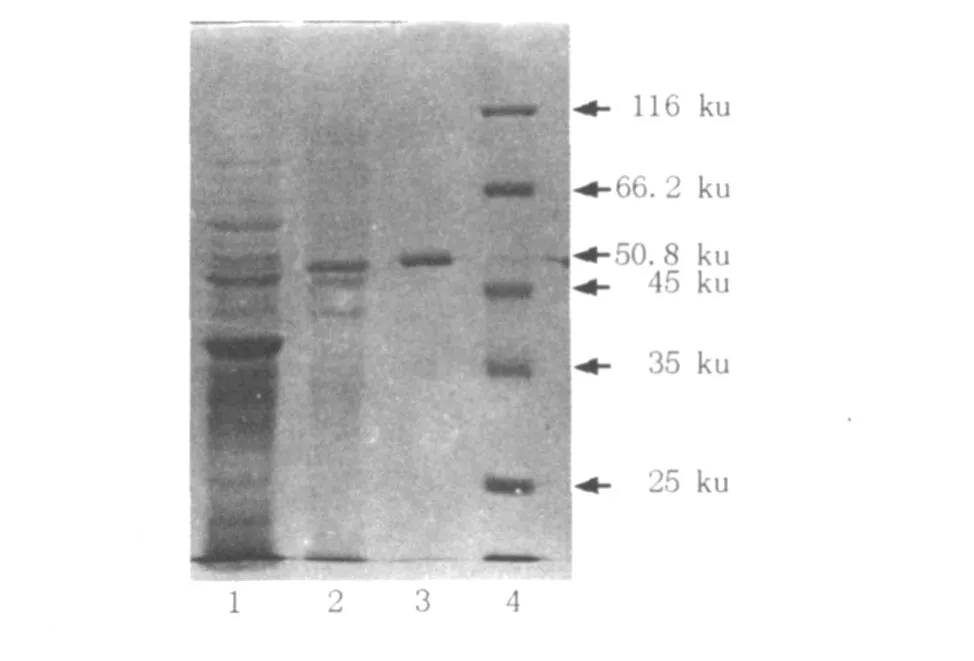
圖2 純化蛋白在SDS-PAGE電泳圖Fig.2 SDS-PAGE analysis of the purified glucosyltransferase 1:粗酶液;2:凝膠過濾層析;3:離子交換層析;4:蛋白Marker
取經(jīng)濃縮的純化酶液20μL與等量的Native-PAGE電泳樣品緩沖液混合,上樣至5%濃縮膠、10%的連續(xù)聚丙烯酰胺凝膠上,120 V穩(wěn)壓電泳至溴酚藍(lán)前沿進(jìn)入分離膠,改用200 V穩(wěn)壓電泳至溴酚蘭前沿離凝膠下沿1~2 cm。結(jié)束電泳小心取出凝膠,按上述方法用考馬斯亮藍(lán)進(jìn)行染色,結(jié)果見圖3。由圖3可看出,純化蛋白仍為單一條帶,但是經(jīng)凝膠成像系統(tǒng)分析,純化蛋白的表觀分子量變?yōu)?50 ku。
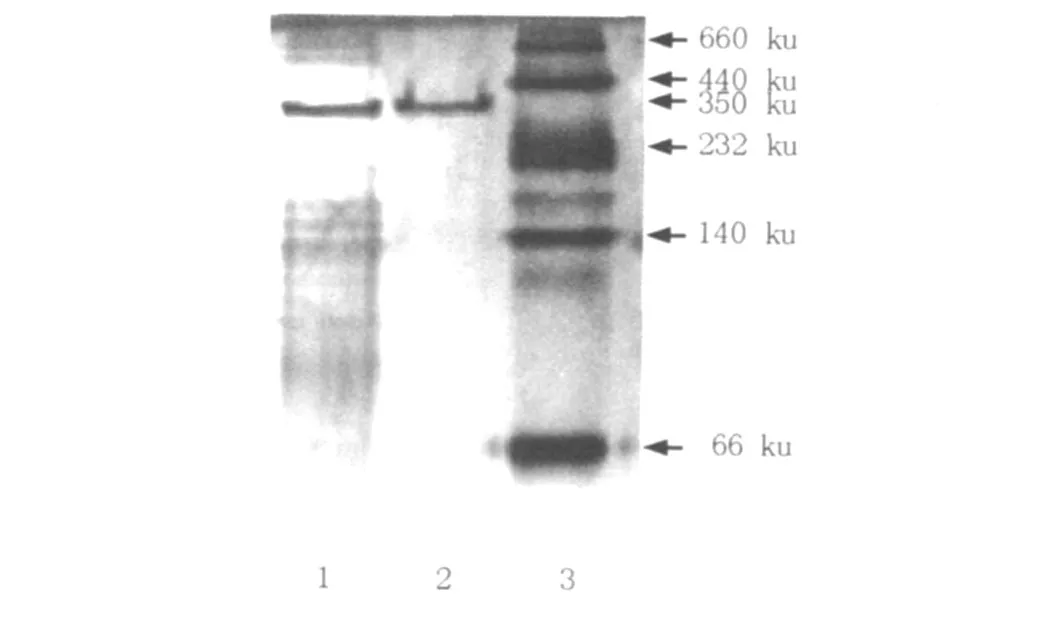
圖3 純化蛋白在Native-PAGE電泳圖Fig.3 Native-PAGE analysis of the purified glucosyltransferase 1:凝膠過濾層析;2:離子交換層析;3:蛋白Marker
實(shí)驗(yàn)結(jié)果表明,短梗霉Y68的GTF在SDS-PAGE和Native-PAGE上都呈現(xiàn)單一條帶,Native-PAGE上的分子量大于McCleary和Gibson[9]報(bào)道的黑曲霉中的GTF分子量(116 ku)。在兩凝膠中呈現(xiàn)的分子量差別較大,其原因可能是該GTF由幾個(gè)分子量相似的亞基組成,從而與黑曲霉中的GTF作用方式也會(huì)有很大不同,很可能是幾個(gè)復(fù)合亞基的共同作用。
2.3 GTF的酶學(xué)特性
2.3.1 酶的最適反應(yīng)溫度和溫度穩(wěn)定性 反應(yīng)混合物分別于28、30、37、40、50、55、60和65℃水浴中反應(yīng)5 min,分別測(cè)定GTF活力,結(jié)果見圖4。由圖4可以看出,純化酶液在反應(yīng)溫度低于40℃的范圍內(nèi),酶活隨溫度的升高而升高,在反應(yīng)溫度為40℃時(shí)達(dá)到最高,當(dāng)反應(yīng)溫度大于40℃時(shí),隨著溫度的升高酶活迅速下降。值得注意的是,作為胞內(nèi)酶,該酶在低于40℃的條件下相對(duì)穩(wěn)定,能保持較高活力。
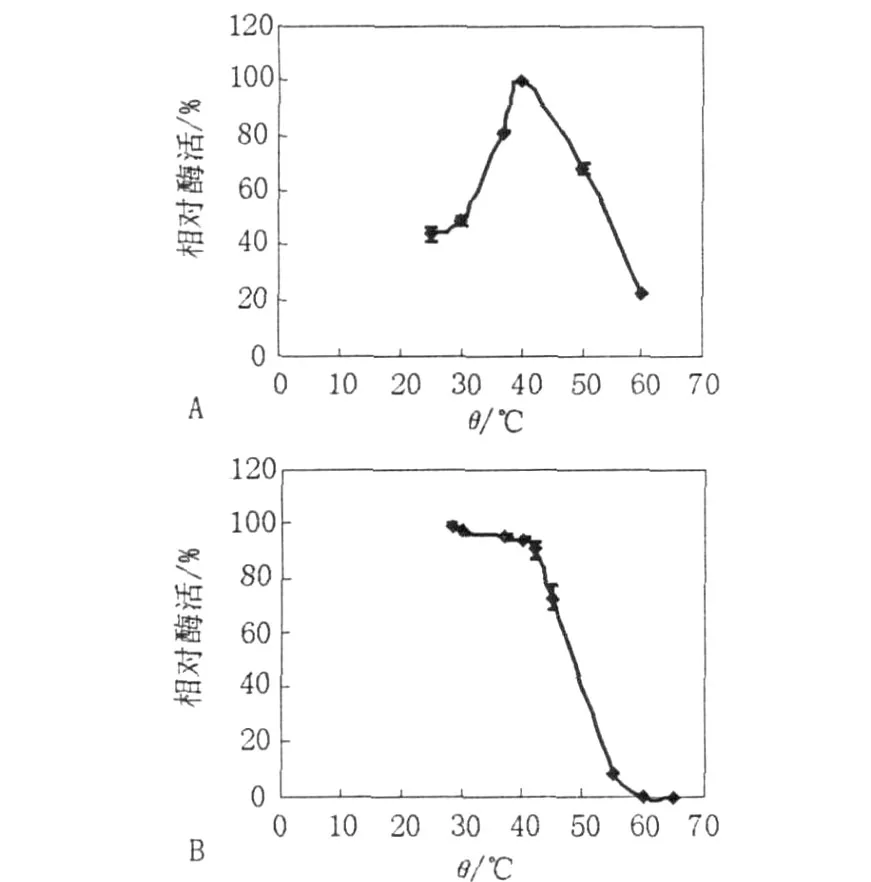
圖4 溫度對(duì)GTF活力(A)及熱穩(wěn)定性(B)的影響Fig.4 Effect of temperature on activity(A)and thermal stability(B)of glucosyltransferase from Y68
溫度對(duì)酶的活力影響主要體現(xiàn)在2個(gè)方面:一方面溫度升高,與一般化學(xué)反應(yīng)一樣,反應(yīng)速度加快;另一方面隨著溫度的升高,酶蛋白逐漸變性,反應(yīng)速率隨之下降。酶的最適反應(yīng)溫度是這2個(gè)方面平衡的結(jié)果。最適反應(yīng)溫度往往受到反應(yīng)時(shí)間、底物濃度、酶濃度、pH值、激活劑或抑制劑等因素的影響。在本實(shí)驗(yàn)條件下,純化的GTF反應(yīng)的最適溫度為40℃。該酶熱穩(wěn)定性差于McCleary和Gibson[9]報(bào)道的黑曲霉中的GTF,其最適溫度也遠(yuǎn)低于黑曲霉中的GTF(70℃)。
2.3.2 GTF的最適作用pH 分別以pH為4.0、5.0、6.0、6.6、7.0、7.6、8.0、9.0的緩沖液,取代酶活測(cè)定中反應(yīng)混合物中的緩沖液,測(cè)定不同pH下GTF的活力,結(jié)果見圖5A。純化的酶液分別與pH為3.0、4.0、4.6、5.0、5.6、6.0、7.0、8.0的緩沖液等體積混合,4℃保持30 min,測(cè)定剩余酶活力,結(jié)果見圖5B。
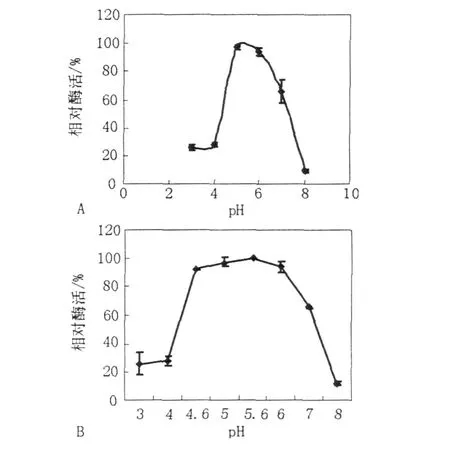
圖5 pH對(duì)GTF活力(A)及穩(wěn)定性(B)的影響Fig.5 Effects of pH on activity(A)and stability(B)of glucosyltranslase
從圖5A可看出,GTF酶在pH 3.0~6.0之間隨著pH的上升酶活提高,在pH 6.0時(shí)酶活最高,當(dāng)pH大于6.0時(shí),酶活迅速下降,說明該酶對(duì)pH的變化也非常敏感。pH變化對(duì)酶活的影響主要是由于酸堿改變酶的空間結(jié)構(gòu)使酶失活,或酸堿影響酶的活性部位使可解離基團(tuán)解離、酶分子活性中心催化基團(tuán)和結(jié)合基團(tuán)的解離、底物的解離以及酶-底物復(fù)合物的解離,從而影響反應(yīng)動(dòng)力學(xué)性質(zhì),影響酶反應(yīng)速度。最適反應(yīng)pH也不是酶的特征性物理常數(shù),它往往受到反應(yīng)時(shí)間、底物、酶濃度、反應(yīng)溫度、激活劑或抑制劑等因素的影響,因此酶的最適反應(yīng)pH只是一定反應(yīng)條件下的結(jié)果。圖5B表明,在本實(shí)驗(yàn)條件下,純化的GTF反應(yīng)的最適pH為6.0,在低于pH 4.6或高于pH 6.0的環(huán)境中保持30 min,酶活均迅速下降,說明類酵母GTF的pH穩(wěn)定性相對(duì)較差。這一特性與McCleary和Gibson[16]報(bào)道的該酶的最適pH(4.0~4.5)不同而pH穩(wěn)定性則幾乎相同。
2.3.3 金屬離子對(duì)GTF活性的影響 將酶活性測(cè)定反應(yīng)混合物中加入Cu2+、Mg2+、Fe2+、Ca2+、Mn2+、Co2+、Ba2+、K+、Na+、Hg+,一價(jià)離子的濃度為12.5 mmol/L,二價(jià)離子的濃度為25 mmol/L,測(cè)定GTF活力,結(jié)果見圖6。
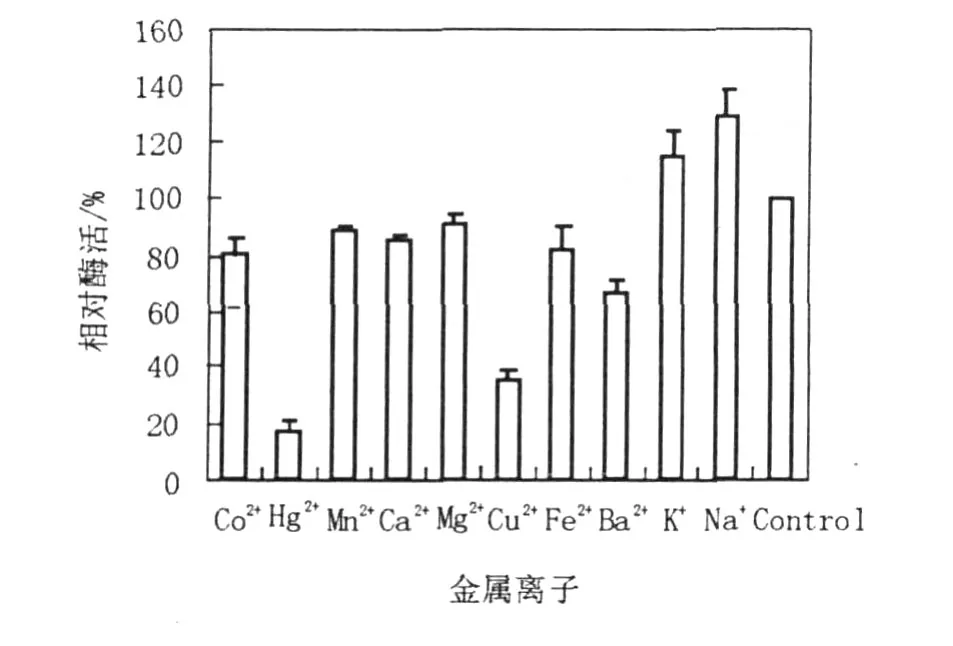
圖6 金屬離子對(duì)GTF活力的影響Fig.6 Effects of different ions on activity of glucosyltransferase in Aureobasidium pullulans Y68
實(shí)驗(yàn)中測(cè)定了10種金屬離子對(duì)純化的GTF活性的影響。結(jié)果發(fā)現(xiàn)K+和Na+對(duì)酶活性有激活作用,酶活力分別提高了15.4%和29.1%。而Hg2+、Co2+、Mn2+、Cu2+、Ca2+、Ba2+、Mg2+和Fe2+對(duì)酶活有抑制作用,酶活力分別被抑制82.8%、19.8%、11.1%、64.7%、15.3%、14%、8.9%和17.9%。酶活性被Hg2+離子抑制表明酶活性中心二硫鍵被破壞。
2.3.4 不同蛋白質(zhì)抑制劑對(duì)酶活力的影響 將各種蛋白質(zhì)抑制劑加入純化的酶液中,4℃保持10 min,測(cè)定剩余酶活,結(jié)果見表2。表2顯示, EDTA、PMSF、碘乙酸和SDS對(duì)酶活均有很大的抑制作用,而DTT對(duì)酶活性有保護(hù)作用。EDTA抑制酶活性說明GTF是金屬酶。PMSF和碘乙酸對(duì)酶活有抑制作用,說明該酶的活性中心存在絲氨酸(Ser)殘基和半胱氨酸(Cys)殘基。
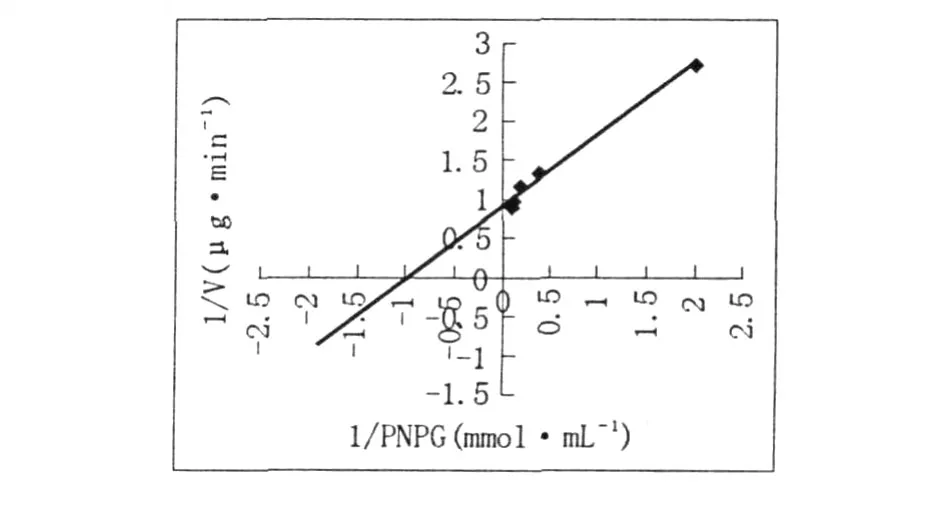
2.3.5 酶的動(dòng)力學(xué)常數(shù) 以Lineweaver-Burk雙倒數(shù)作圖法測(cè)定米氏常數(shù)Km。GTF對(duì)PNPG的Km如圖7所示,Km和Vm ax分別為1.03 mmol/ mL和1.107μg/min。
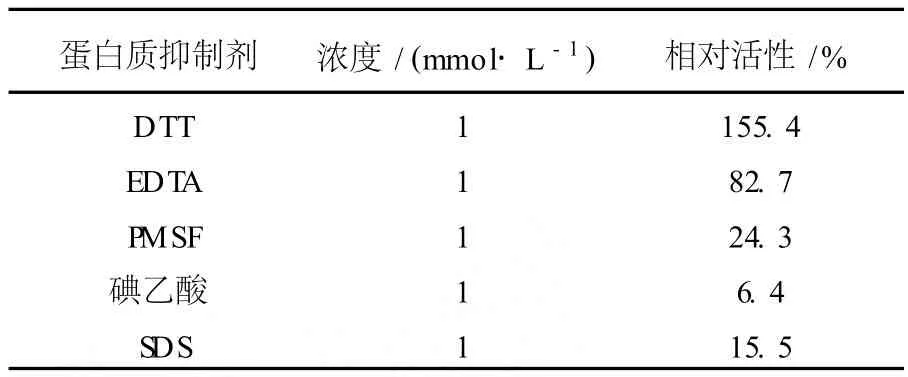
表2 不同蛋白質(zhì)抑制劑對(duì)GTF活力的影響Table 2 Effects of different compounds on glucosyltransferase activity
3 討 論
本研究表明,短梗霉菌株Y68合成的胞外多糖產(chǎn)量與胞內(nèi)GTF活力成正比例關(guān)系。與口腔內(nèi)變形鏈球菌合成胞外多糖形成齲齒相似[10], GTF活力高的情況下,其胞外多糖產(chǎn)量也高;同樣GTF活力低的情況下,胞外多糖產(chǎn)量也低。葡萄糖是產(chǎn)生高活力GTF和高產(chǎn)量胞外多糖的最佳碳源。適宜的碳源促進(jìn)了GTF活力,高的GTF活力是較高胞外普魯蘭多糖產(chǎn)量的必要前提。本研究還純化了高產(chǎn)普魯蘭多糖菌株Y68胞內(nèi)GTF,結(jié)果表明:在酶學(xué)特性上,與已有相關(guān)報(bào)道相比,本研究中短梗霉Y68胞內(nèi)GTF與之前報(bào)道的黑曲霉中的相應(yīng)酶從分子量和酶學(xué)特征方面都有很大差異。如其分子量為350 ku,明顯高于黑曲霉中116 ku的分子量。另外,Y68細(xì)胞中該酶只在40℃以下、pH 4.6~6.0條件下保持較好穩(wěn)定性,明顯差于黑曲霉GTF在65℃、pH 4.0~7.0還保持較高活力的穩(wěn)定性。同樣,金屬離子對(duì)2種生物內(nèi)的GTF活力也有不同的影響,Mn2+對(duì)Y68細(xì)胞中GTF活力有微弱抑制作用而對(duì)黑曲霉中GTF活力則有顯著的促進(jìn)作用。多方面物理生化特征的差異導(dǎo)致了不同生物細(xì)胞內(nèi)GTF作用方式的不同。可以推測(cè),正是這種作用方式的不同才使得不同微生物合成了多種結(jié)構(gòu)不同的胞外多糖。本實(shí)驗(yàn)室還會(huì)繼續(xù)對(duì)短梗酶菌株Y68細(xì)胞內(nèi)其他與胞外多糖合成相關(guān)的酶,如磷酸葡萄糖變位酶、尿嘧啶二磷酸葡萄糖焦磷酸化酶等進(jìn)行研究。一方面通過分離純化得到各相關(guān)酶,并模擬胞外多糖合成條件,進(jìn)行體外胞外多糖合成的試驗(yàn),了解胞外普魯蘭多糖合成的機(jī)理;另一方面希望通過對(duì)各相關(guān)酶基因的克隆與表達(dá),從基因水平上調(diào)節(jié)其胞外多糖的合成,從而可以從分子水平探究其胞外多糖合成機(jī)理并建立起GTF高表達(dá)株,最終實(shí)現(xiàn)胞外多糖的工業(yè)化生產(chǎn)。
[1]Sutherland I W.Novel and established applications ofmicrobial polysaccharides[J].TI BTECH,1998,16(1):41-46.
[2]王長(zhǎng)海,李焰紅,鞠寶.短梗霉多糖在海產(chǎn)品保鮮方面的應(yīng)用研究[J].煙臺(tái)大學(xué)學(xué)報(bào)(自然科學(xué)與工程版),1999,12 (2):148-152.
[3]Madlova A,Antosova M,Polakovic M.Thermal Stability of Fructosyl-transferase from Aureobasidium Pullulans[J].Chem. Pap.,2000,54(6a):339-344.
[4]Chi Z M.,Zhao SZ..Optimization of medium and cultivation conditions for pullulan production by a new pullulan-producingyeast[J].Enzyme and Microbial Technology,2003,33:206-211.
[5]Duan XH,Chi Z M,Li HF,et al.High pullulan yield is related to low UDP-glucose level and high pullulan-related synthases activity in Aureobasidium pullulans Y68[J].Annals ofMicrobiology,2007,57(2):243-248.
[6]Duan XH,Chi Z M,WangL,et al.Influence of different sugars on pullulan production and activities of alpha-phosphoglucose mutase,UDPG-pyrophosphorylase and glucosyltransferase involved in pullulan synthesis in Aureobasidium pullulans Y68 [J].Carbohydrate Polymers,2008,73(4):587-593.
[7]Bradford MM.A Rapid and Sensitive Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein-Dye Binding[J].Anal.Biochem,1976,72:248-254.
[8]郭堯君.蛋白質(zhì)電泳技術(shù)(第2版)[M].北京: 7030152832,2005-05-01.
[9]McCleary RV.,Gibson TS.Purification,properties,and industrial significance of transglucosidase from Aspergillus niger[J]. Carbohydrate Research,1989,185:147-162.
[10]姬德衡,孔繁東,侯青春.蘋果多酚的開發(fā)與應(yīng)用[J].蔬菜加工,2001,(2):26.
Purification and Features of Glucosyltransferase from Pullulan High-Yielding Stra in Y68
DUAN Xiao-hui1,GENG Jin-pei1,FANG Shao-qing1,L IJun-feng2
(1.Yantai Entry-Exit Inspect.&Quar.Bureau.,Yantai264000;2.Qingdao Uni.of Sci.&Technol.,Qingdao266003)
Intracellular glucosyltransferase(GTF)from pullulan high-yielding strain Y68 was isolated and purified by ion exchange chromatography and gel filtration chromatography,the protein was qualified,compared and characterized to study its enzymological features by SDS-PAGE and Native-PAGE.The results showed that GTF from Aureobasidium pullulans was isolated and purified and its molecular mass 350 ku with single band on the Native-PAGE gel,but 50.8 ku with single band on the SDS-PAGE gel which indicated the enzyme was composed of several subunits.The most suitable reaction pH and temperature of purified GTF was 6.0 and 40℃respectively,and the enzyme was very sensitive to temperature and had poor stability.GTF was an metallic enzyme,Na+and K+could activate it.However, Ca2+,Mn2+,Mg2+,Ba2+,Cu2+,Fe2+,Hg2+,and Co2+inhibited its activity.The inhibition of Hg2+against it indicated that the activity core of the enzyme contained bi-sulphonium bond.EDTA,PMSF,SDS,and iodo-acetidin greatly inhibited GTF’s activity;but dithiothreitol(DTT)had protective role of its activity.
Aureobasidium pullulans;glucosyltransferase;purification
Q55
A
1005-7021(2010)06-0032-07
國(guó)家質(zhì)檢總局科研項(xiàng)目(20051K022)
段效輝 女,工程師,博士。主要從事食品微生物檢測(cè)和研究工作。
Tel:0535-6665905,E-mail:xiaohuiduan66@yahoo.com.cn
2010-07-28;
2010-10-29

