抗噬菌體重組鈍齒棒桿菌的生理穩定性
胡永飛,李鐵民,張 博,楊志勇,李 玉
(遼寧大學生命科學院,遼寧沈陽 110036)
抗噬菌體重組鈍齒棒桿菌的生理穩定性
胡永飛,李鐵民*,張 博,楊志勇,李 玉
(遼寧大學生命科學院,遼寧沈陽 110036)
為了探索抗噬菌體重組鈍齒棒桿菌的應用可行性,對重組質粒pJL23-cglⅠ在鈍齒棒桿菌中的穩定性以及其對宿主細胞生長代謝的影響進行了研究。實驗結果表明,重組質粒在鈍齒棒桿菌中具有較好的穩定性,它在鈍齒棒桿菌中的存在對重組菌株的早期生長有些影響,但未影響重組菌株的谷氨酸產生量。
鈍齒棒桿菌;重組質粒;質粒穩定性;生長速率;谷氨酸
鈍齒棒桿菌是產生谷氨酸的菌株之一,其不同衍生株在生產中得到了廣泛應用。然而,由于發酵生產的規模化和連續性,生產中的菌種極易感染噬菌體,所以噬菌體污染一直是影響谷氨酸發酵生產的關鍵因素之一。雖然通過改進生產工藝,改善衛生條件,控制生產環節,噬菌體污染現象有所減輕,但仍時常發生[1-2]。為了解決谷氨酸發酵中的噬菌體污染問題,利用質粒攜帶的cglⅠ基因復合體構建了抗噬菌體鈍齒棒桿菌基因工程菌,證實了cglⅠ基因復合體在鈍齒棒桿菌中的抗噬菌體功能活性[3]。由于構建抗噬菌體基因工程菌的策略采用的是質粒表達外源基因,而且表達的外源基因是限制修飾(RM)系統基因復合體,所以重組質粒以及其所攜帶的RM在鈍齒棒桿菌中的行為如何尚需實驗證實。為此,本文對重組質粒在鈍齒棒桿菌中的穩定性以及其對宿主細胞生長代謝的影響進行了研究。
1 材料與方法
1.1 材料
1.1.1 菌株 鈍齒棒桿菌T6-13(野生型)購自中國典型培養物保藏中心,含有質粒pJL23-cglⅠ的重組鈍齒棒桿菌由本實驗室構建[3]。
1.1.2 噬菌體 5株噬菌體AS-I V3C44~ASI V3C48購自武漢病毒研究所。
1.2 方法
1.2.1 菌株培養 鈍齒棒桿菌T6-13(野生型)和重組鈍齒棒桿菌培養于LB培養基(固體或液體),需要時添加50μL/mL卡那霉素。
1.2.2 噬菌體裂解液的制備 具體方法參見文獻[4]。
1.2.3 噬菌體效價測定 具體方法參見文獻[4]。噬菌體效價(pfu/mL)=噬菌斑數×稀釋倍數×10。
1.2.4 噬菌體抗性檢測 采用平板空斑法,成斑率(Efficiency of plaquing,EOP)計算方法見下式[5],敏感菌株的EOP等于1。

1.2.5 菌株傳代[6]在LB/Km-平板上劃線接種重組鈍齒棒桿菌,30℃培養24 h后挑取單菌落,連續劃線接種傳代100次。將傳代次數為1、10、20、30、……80、90、100的平板4℃保存。
1.2.6 質粒分離穩定性測定[6]從不同傳代次數(1、10、20、30、……80、90、100)的LB/Km-平板上,用無菌牙簽分別挑取100個單菌落,分別在LB/Km-和LB/Km+平板對應位置上劃短線,30℃過夜培養。計數不同代次重組菌株在LB/Km-和LB/Km+平板上的生長數,計算重組菌株在無Km選擇壓力條件下質粒的丟失率。質粒穩定性(%)=(LB/Km+平板上的生長數)/(LB/Km-平板上的生長數)×100%。
1.2.7 質粒結構穩定性測定[6]從不同傳代次數(原代、20、40、60、80、100)的LB/Km-平板上,用無菌牙簽分別挑取菌落接種于LB液體培養基中,30℃過夜培養后,采用噬菌體抗性實驗檢測重組菌株質粒的結構穩定性。
1.2.8 生長曲線測定[7]以野生菌株作對照,測定重組菌株的生長曲線,實驗重復3次,實驗數據為3次實驗的平均值。
1.2.9 谷氨酸測定[7]重組菌株與野生菌株(對照)分別搖瓶發酵培養48 h,從20 h起開始取樣,每隔4 h取樣1次,取樣時間分別設為20、24、28、32、36、40、44、48 h。采用大腸埃希菌L-谷氨酸脫羧酶解法使谷氨酸分解成CO2氣體,用微量呼吸檢壓儀定量測定產生的CO2量,根據反應方程式計算出谷氨酸含量。實驗重復3次,實驗數據為3次實驗的平均值。
2 結 果
2.1 重組質粒pJL23-cglⅠ在鈍齒棒桿菌中的分離穩定性
重組鈍齒棒桿菌在無卡那霉素抗性選擇壓力的條件下,在LB固體平板上連續傳代100次,每隔10代次檢測1次質粒丟失情況。實驗結果表明,重組質粒pJL23-cglⅠ在重組鈍齒棒桿菌中未見明顯丟失現象(見表1)。
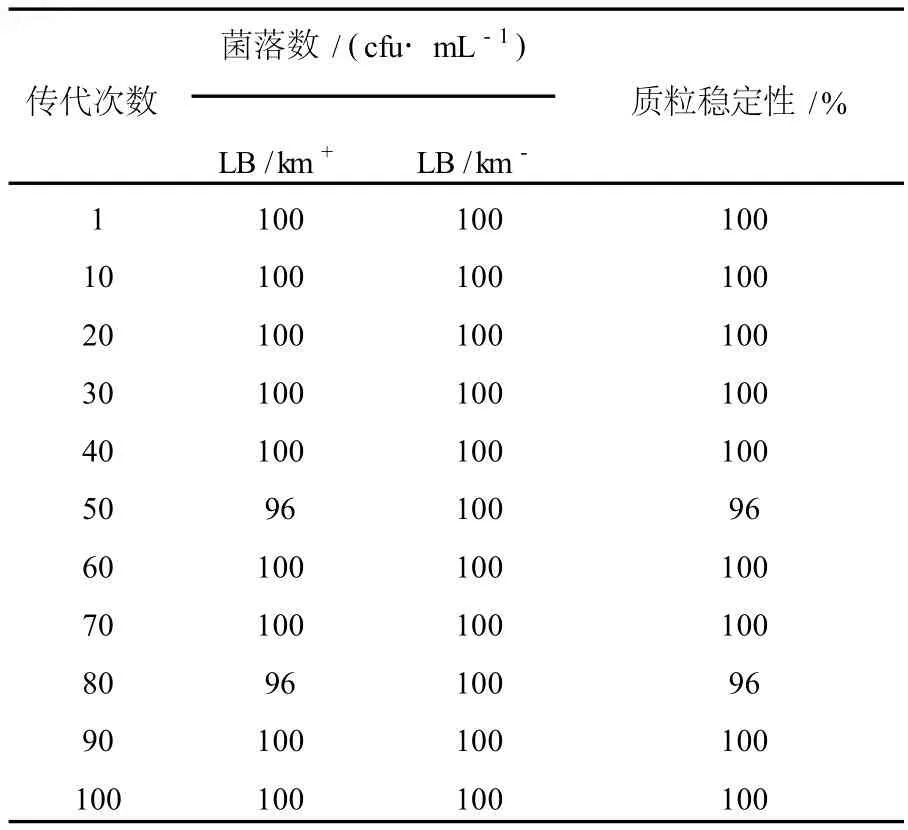
表1 重組質粒pJL23-cglⅠ在鈍齒棒桿菌中的分離穩定性Table 1 Segregation stability of recombinant plas mid pJL23-cglⅠinC.crenatum
2.2 重組質粒pJL23-cglⅠ在鈍齒棒桿菌中的結構穩定性

表2 重組鈍齒棒桿菌在不同傳代次數中的噬菌體抗性(EOP)Table 2 Resistance of recombinant C.crenatum in times of culture transferred against phages
取傳代次數分別為原代、20、40、60、80、100次的重組鈍齒棒桿菌進行噬菌體抗性定量檢測,通過噬菌體感染實驗分析cglⅠ基因在傳代過程中是否正常表達,以此考察重組質粒pJL23-cglⅠ在鈍齒棒桿菌中的結構穩定性。由表2可以看出,重組鈍齒棒桿菌在傳代過程中一直保持抗噬菌體活性,與原代菌株相比,EOP均小于10-8。表明cglⅠ基因在重組鈍齒棒桿菌株中穩定表達,即在傳代培養過程中,重組質粒的結構穩定。
2.3 重組質粒pJL23-cglⅠ對鈍齒棒桿菌生長的影響
從野生鈍齒棒桿菌和重組鈍齒棒桿菌的生長曲線可以看出(見圖1),在相同培養條件下,野生鈍齒棒桿菌培養到3 h左右便達到對數生長期,而重組鈍齒棒桿菌達到對數期的時間約延遲1 h左右,但二者達到穩定期的時間趨于相同。總體上2個菌株的生長率相差不大,只是重組鈍齒棒桿菌進入對數期生長速度要略晚于野生鈍齒棒桿菌。
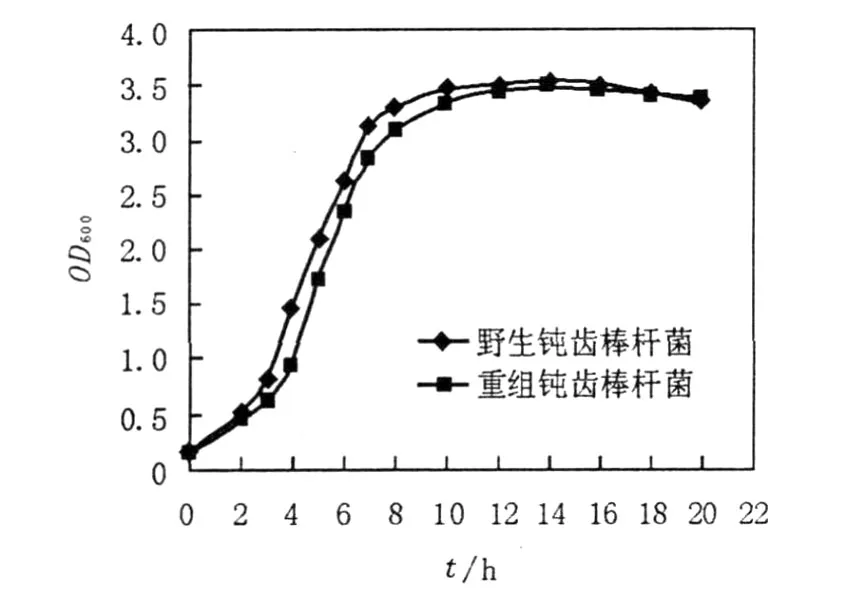
圖1 野生鈍齒棒桿菌和重組鈍齒棒桿菌的生長曲線Fig.1 The growth curves of wild C.crenatum and recombinant C.crenatum
2.4 重組質粒pJL23-cglⅠ對鈍齒棒桿菌產生谷氨酸的影響
由圖2可以看出,重組鈍齒棒桿菌和野生鈍齒棒桿菌在發酵過程中谷氨酸積累量的變化趨勢基本一致,具有相同的谷氨酸積累高峰,即在發酵32 h有最大的谷氨酸積累量,分別為277.74 mg/ L和261.39 mg/L,表明重組質粒pJL23-cglⅠ的導入并未影響鈍齒棒桿菌的代謝產酸量。
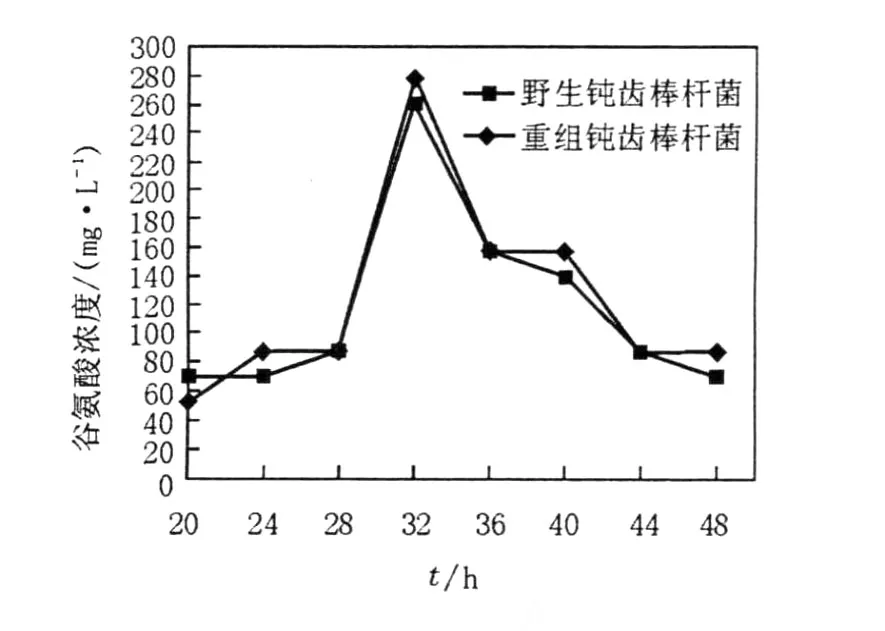
圖2 谷氨酸產生動力學曲線Fig.2 Dynamics curves of glutamate production
3 討 論
對重組鈍齒棒桿菌質粒穩定性的研究結果表明,重組菌株連續傳100代次后,沒有發生質粒丟失現象,且仍具有原代菌株的功能活性,表明重組菌株中的質粒具有結構穩定性和分離穩定性,推測重組質粒穩定性可能與質粒上攜帶的RM系統cglⅠ基因復合體有關。報道表明,一些Ⅱ型RM基因系統具有分離后殺死活性,可以介導維持質粒穩定性[8-11]。正常情況下,細胞中的M酶保護宿主染色體免遭R酶的致死性裂解。然而,一旦RM基因系統從細胞中被根除,隨著細胞分裂,由于稀釋,子代細胞中含有的M酶將越來越少,結果是M酶保護新復制的染色體上的許多識別位點的能力漸漸減弱。這樣,染色體DNA上未被甲基化的位點將受到攻擊,最終導致細胞死亡。同樣,RM基因系統丟失后,隨著細胞分裂,R酶也將被稀釋。然而,M酶和R酶在作用方式上存在不平衡,也就是說,R酶殺死細胞時,只需染色體上一處斷裂就可以充分有效(除非DNA被修復),而對于M酶而言,對宿主的保護,則需要染色體上上百個識別位點被甲基化[12]。雖然推測重組菌株的質粒穩定性與質粒上攜帶的RM基因復合體有關,但其確切原因和機制還有待進一步研究證實。
cglⅠ基因復合體在鈍齒棒桿菌中表達后,首先通過甲基轉移酶在特異識別序列上使宿主基因組DNA胞嘧啶甲基化,以避免相應限制酶的裂解。這樣,宿主基因組DNA胞嘧啶被甲基化后,是否對重組棒桿菌的生長代謝產生影響尚不清楚。本實驗結果顯示,重組菌株達到對數期時間略晚于野生菌株,表明重組菌株對數期生長有些緩慢,但進入穩定期后兩者趨于一致。分析原因可能有以下幾方面:①重組質粒在宿主菌中復制、外源基因產物的表達增加了細菌細胞的代謝壓力;②含有質粒的重組菌株需要更多的能量和營養合成更多的DNA、RNA和蛋白質等物質;③質粒的復制和表達也將與宿主細胞競爭可用的原料物質,從而影響細菌的生長速率[13-14]。
重組鈍齒棒桿菌產生谷氨酸的研究結果表明,重組菌株和野生菌株在實驗發酵過程中谷氨酸積累量的變化基本趨于一致,表明重組質粒的導入并未影響菌株的代謝產酸量。
[1]Sander M E.Bateriophages in industrial fer mentations.In:Webster R G,Granoff A(Eds.)[J].Encyclopedia of Virology. Lodon:Academic Press,1993:117-121.
[2]袁品坦.再談噬菌體的污染及其預防[J].發酵科技通訊, 1999,28(4):22-27.
[3]胡永飛,李鐵民,楊智勇,等.限制修飾系統cglⅠ賦予鈍齒棒桿菌抗噬菌體功能活性[J].生物工程學報,2008,24 (5):760-765.
[4]余茂效,司穉東.噬菌體實驗技術[M].北京:科學出版社, 1991:11-12.
[5]Kong J,Josephsen J.The ability of the plas mid-encoded restriction and modification system Lla B Ⅲ to protect Lactococcus lactis against bacteriophages[J].Lett Appl Microbiol,2002,34(4): 249-253.
[6]葛保勝,任育紅,唐志紅,等.表達重組別藻藍蛋白質粒在工程菌株中的遺傳穩定性研究[J].微生物學通報,2005,32 (4):37-41.
[7]沈萍,范秀容,李廣武.微生物學實驗(第3版)[M].北京:高等教育出版社,1999:141-143.
[8]Nakayama Y,Kobayashi I.Restriction-modification gene complexes as selfish gene entities:Roles of a regulatory system in their establishment,maintenance,and apoptotic mutual exclusion[J].Proc Nat Acad Sci USA,1998,95(11):6442-6447.
[9]Naito T,Kusano K,Kobayashi I.Selfish behavior of restriction modification systems[J].Science,1995,267(5199):897-899.
[10]Kulakauskas S,Lubys A,Ehrlich S D.DNA restriction-modification systems mediate plasmid maintenance[J].J Bacteriol, 1995,177(12):3451-3454.
[11]Kusano K,Naito T,Handa N,et al.Restriction-modification systems as genomic parasites in competition for specific sequences [J].Proc Natl Acad Sci USA,1995,92(24):11095-11099.
[12]Kobayashi I.Restriction-modification systems as minimal for ms of life.In:Pingoud A.(ed.),Restriction endonucleases[J]. Berlin,Ger many:Springer-Verlag,2004:19-62.
[13]Ricci JCD,Hernandez ME.Plasmid effects on Escherichia coli metabolism[J].Crit Rev Biotechnol,2000,20(2):79-108.
[14]Lee K,Moon SH.Growth kinetics of Lactococcus lactiss sp.diacetylactis harboring different plasmid content[J].Curr Microbiol,2003,47(1):17-21.
Physiological Stability of the Recombinant Corynebacterium cretanum with Phage Resistance
HU Yong-fei,L I Tie-min,ZHANG Bo,YANG Zhi-yong,LI Yu
(Sch.of Life Sci.,Liaoning Uni.,Shenyang110036)
In order to explore the feasibility to apply to an engineered phage-resistant Corynebacterium cretanum strain,a recombinant plasmid pJL23-cglI in C.crenatum and the effect of it on the growth metabolism of host cells was studied.The results showed that the recombinant plasmid pJL23-cglI stably maintained inC.crenatum,and the recombinant plas mid pJL23-cglI had some impact on the early growth of the recombinant C.crenatum,but no effect was found on its production of glutamate.
Corynebacterium cretanum;recombinant plas mid;plasmid stability;growth rate;glutamate
Q78
A
1005-7021(2010)06-0051-04
遼寧省科技廳自然科學基金(20082501);沈陽市科技局計劃項目(1091187-1-00)
胡永飛 男,博士。研究方向為微生物生物工程。
*通訊作者。Tel:024-62202232,E-mail:tieminli@lnu.edu.cn
2010-08-25;
2010-11-01

