單端孢霉烯族毒素轉化降解研究進展
鄒忠義,賀稚非,李洪軍*,鄒程焓,韓鵬飛,楊佳藝
(西南大學食品科學學院,重慶 400716)
單端孢霉烯族毒素轉化降解研究進展
鄒忠義,賀稚非,李洪軍*,鄒程焓,韓鵬飛,楊佳藝
(西南大學食品科學學院,重慶 400716)
單端孢霉烯族毒素廣泛存在于糧食、動物飼料及以被污染糧食為原料的食品中,給食品安全帶來了一定的隱患。許多學者正在研究用物理、化學以及生物的方法將單端孢霉烯族毒素進行轉化降解。本文就這些方法進行概述,重點闡述化學法和生物法的最新研究進展,包括轉化作用機理、轉化產物及其毒性,旨在為單端孢霉烯族毒素的轉化降解研究提供參考。
單端孢霉烯族毒素;轉化;降解;機理;產物;毒性
Abstract:Trichothecenes are commonly found in grain and animal feed and human food produced from contaminated grain,which brings a food safety risk. Physical, chemical and biological methods have been posed to evaluate their usefulness in the transformation and degradation of trichothecenes. These methods are reviewed in this paper and their research progress is discussed in detail. Meanwhile, the mechanisms of transformation, transformation products and toxicity are also elucidated,This paper is expected to provide some references for further studying the transformation and degradation of trichothecenes.
Key words:trichothecenes;transformation;degradation;mechanism;product;toxicity
單端孢霉烯族毒素(trichothecenes)是一大族化學性質相關的真菌毒素,由鐮刀菌屬、漆斑霉屬、木霉屬、單端孢屬、頭孢霉屬、輪枝孢霉屬和黑色葡萄狀穗霉屬中的一些真菌產生。它們具有相同的基本環結構和一個特征性的C-12,13-環氧基團。根據它們的化學結構,單端孢霉烯族毒素劃分為4種類型:A、B、C、D型,其中,A、B型單端孢霉烯族毒素比較常見,它們的結構和簡稱如圖1和表1所示[1]。A型單端孢霉烯族毒素在C8位上不含有羰基官能團,B型單端孢霉烯族毒素在C8位上含有羰基官能團。

圖1 A、B型單端孢霉烯族毒素的基本結構Fig.1 Basic structures of type A and B trichothecenes
單端孢霉烯族毒素對真核細胞具有多重抑制作用,通過對蛋白質、DNA和RNA合成的抑制,以及對線粒體功能、細胞分裂和膜功能的抑制,從而對人類和動物的健康產生免疫抑制作用[2]。在食品和飼料中,單端孢霉烯族毒素主要來源于被真菌污染的小麥、大麥和玉米等糧食。由這些原料加工成的早餐麥片、焙烤制品、啤酒及配合飼料等產品中,往往含有單端孢霉烯族毒素[3-4]。如果飼養動物的飼料中含有單端孢霉烯族毒素,它們可能通過奶、肉及蛋進入人類和動物的食物鏈[5-7]。因此,防止單端孢霉烯族毒素進入人和動物食物鏈的策略包括:防止單端孢霉烯族毒素污染糧食;對已經存在于食物和飼料中的毒素進行降解處理;抑制胃腸道對毒素的吸收[8]。但目前能有效防止毒素污染糧食及抑制胃腸道吸收毒素的方法不多,對單端孢霉烯族毒素進行轉化降解的研究就有了比較重要的意義。
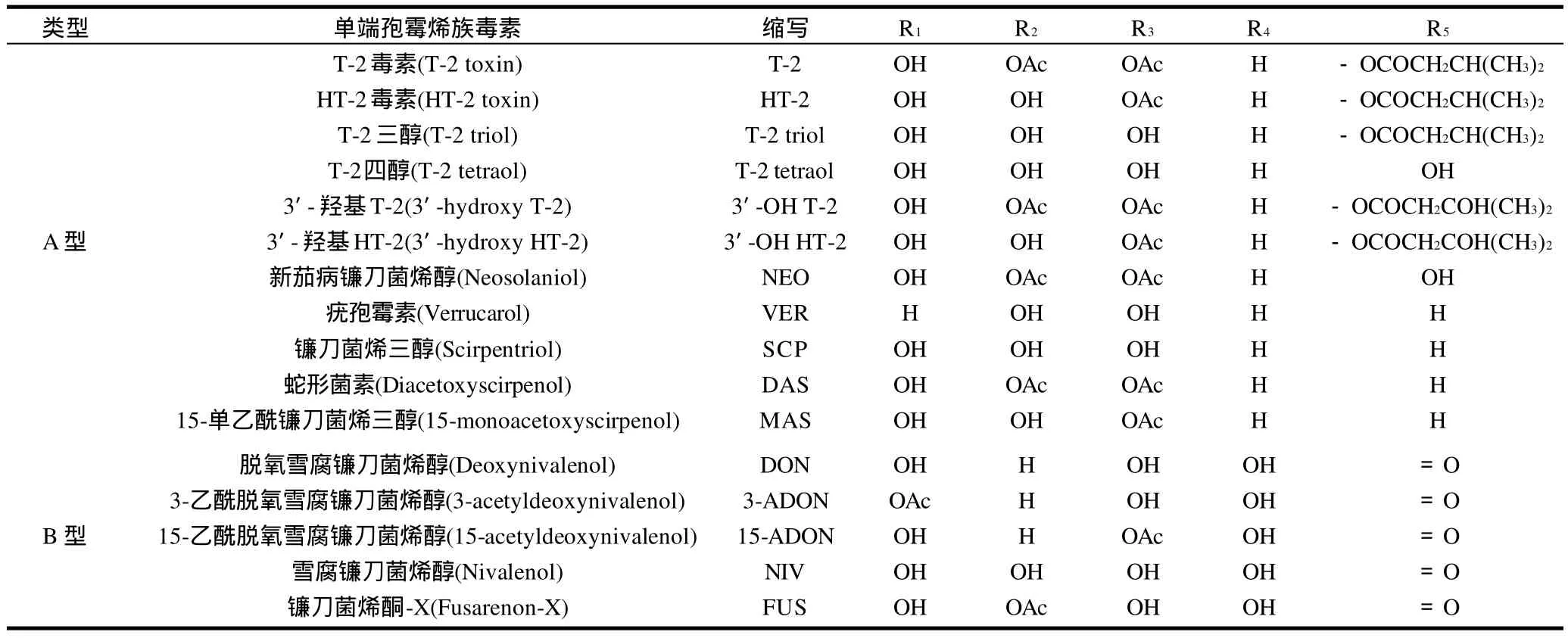
表1 A、B型單端孢霉烯族毒素及其結構Table 1 Type A and B trichothecenes and their respective structures
目前已經有許多學者開展了物理、化學和生物的方法對單端孢霉烯族毒素進行轉化降解研究。本文對各種方法的研究報道進行綜述,重點闡述化學法和生物法的研究進展,旨在為單端孢霉烯族毒素的轉化降解研究提供參考。
1 物理方法
物理方法去除單端孢霉烯族毒素包括清洗、加熱、微波、超聲波、吸附等,其中一些方法已經取得了一定的進展,但這些物理方法的效果不太理想,不能完全清除受試的真菌毒素或降低其毒性,并且往往會改變營養成分,這使得它們在實際應用中受到了限制[9-13]。
1.1 熱處理
脫氧雪腐鐮刀菌烯醇(DON)在120℃時很穩定,在210℃部分分解[14]。Bretz 等[15-16]、Abramson 等[17]報道了在高溫條件下,DON的濃度會降低,當DON和3-乙酰脫氧雪腐鐮刀菌烯醇(3-ADON)被加熱時(特別是在堿性條件下),產生了6種化合物的混合物,經細胞毒性實驗,轉化產物的毒性低于DON。Beyer等[18]研究在烘烤和烹飪過程中T-2毒素的穩定性,發現T-2毒素的轉化產物毒性下降了。目前還沒有確鑿的證據表明高溫分解是DON或T-2降解的原因,它的反應機制還需要進一步的研究。
1.2 輻照
大多數的真菌毒素具有復雜的分子結構,一般不受輻照影響。已經有學者研究了伽馬射線和電子束對糧食中單端孢霉烯族毒素的降解作用。為了分解DON、3-ADON和T-2毒素,干物料所需要的輻照劑量要高于濕物料的輻照劑量。水分子輻照后產生的自由基會與真菌毒素反應。隨著伽馬射線輻照劑量的增加,DON和3-ADON在水溶液的濃度降低,水溶液的毒性下降[19-20]。但在電子束輻照實驗中,沒有發現降解產物[21-22]。輻照可能是工業上脫毒的一個方法,但是應用于干燥的糧食或其他干燥物料脫毒時,效果就很有限。
2 化學方法
2.1 堿處理
單端孢霉烯族毒素與堿反應后,結構會發生變化。例如,Young等[23]研究發現,DON在0.1mol/L的NaOH溶液中,75℃處理1h,產生3種相對分子質量為266的同分異構體混合物,將其命名為norDON A、norDON B和norDON C。Bretz等[15-16]發現,在相同的反應條件下,雪腐鐮刀菌烯醇(NIV)產生norNIV A、norNIV B、norNIVC和NIV內酯,3-ADON產生norDON A、norDON B、norDON C和其他4種產物(9-羥甲基DON內酯、norDON D、norDON E和norDON F)。用人類腎臟永生上皮細胞(IHKE)進行細胞毒性實驗表明,NIV和DON的半數有效濃度(EC50)分別為0.89、1.1μmol/L,而其轉化產物濃度高達100μmol/L時,沒有產生任何明顯的毒性效應,這表明了NIV和DON的轉化產物的毒性要低于NIV和DON。在實際應用堿處理時,應該考慮其可能導致的營養特性的改變,但這方面的報道不多,需要更加深入的研究。
2.2 氧化劑
氧化劑的氧化作用也能使單端孢霉烯族毒素的分子結構發生改變,從而使其生物活性發生改變。化學氧化試劑能與許多功能基團發生反應,例如臭氧最有可能攻擊單端孢霉烯族毒素中的雙鍵[24]。Young等[25]提出,臭氧對單端孢霉烯族毒素氧化作用,是在C-9,10雙鍵上加上兩個原子氧,分子的其他部分沒有發生改變。DON氧化作用轉化過程中,水分子起到了很重要的作用。例如:當濕潤的臭氧(2.88%)以150mL/min的低速,通過霉變玉米(DON含量為1000μg/g)1h,能減少90%的DON,而當臭氧和霉變玉米都處于干燥狀態時,DON的減少量卻很小[11]。此外,在臭氧飽和水蒸氣體系中,pH值的大小對單端孢霉烯族毒素的氧化作用也很重要,在pH4~6時,DON、3-ADON、15-ADON、DAS、MAS、FUS、NEO和VER完全降解;在pH7~8時,受試的單端孢霉烯族毒素與臭氧之間反應的程度取決于C8位的氧化狀態;在pH9時,幾乎沒有反應發生。
Burrows等[26-27]報道,在室溫條件下,次氯酸鈉(NaClO)將疣孢霉素(Verrucarol,VER)轉化成兩種產物,將DON轉化成一種產物。VER的氧化包括在C-9,10雙鍵中C9上的親核進攻,C-12,13環氧基團的開環,C10、C13單鍵的形成,C4的氧化、氯化及環化形成半酮縮醇。而NaClO對DON的氧化作用不會使C-12,13環氧基團開環,而是形成C-9,10環氧化合物和C8、C15半酮縮醇。這表示在C8位上的羰基可能有催化NaClO對DON的氧化作用,DON的轉化速率是VER的10倍證明了這一點。用0.25% NaClO-0.025mol/L的NaOH溶液處理T-2毒素4h,能抑制T-2毒素的生物活性,NaClO被推薦作為T-2毒素和其他單端孢霉烯族毒素的凈化劑[28-29]。
2.3 還原劑
食品添加劑中的還原劑,例如抗壞血酸、亞硫酸氫鈉(NaHSO3)和焦亞硫酸鈉(Na2S2O5),具有轉化糧食中DON的能力。用2%抗壞血酸,22℃處理小麥24h,能將DON濃度降低50%。用NaHSO3處理小麥粉后,DON的殘留量只有5%。在100℃,輸入水分含量為22%的飽和蒸汽,并不斷攪拌,1%的Na2S2O5能使霉變小麥中DON的含量從7.6mg/kg 降到0.28mg/kg[11]。
3 生物方法
3.1 羥基化和羰基化氧化作用
灌木酒神菊屬(Baccharisspp.)微生物和豬能將T-2毒素通過羥基化作用氧化成3'-OH T-2或者3'-OH HT-2[31-32]。Kobayashi等[33]指出,細胞色素P-450依賴的單加氧酶系能催化雙羥基化反應。Yoshizawa等[34]指出,羥基化氧化作用發生在肝微粒體中,需要NADPH的參與。苯巴比妥能誘導大多數細胞色素P-450同工酶系,起到催化作用,從而加強這一反應,苯巴比妥能在肝中通過羥基化和糖酯化作用代謝掉。
土壤微生物能使DON中C3位上的羥基通過羰基化作用氧化成3-酮-DON[35]。Shima等[36]報道,一株土壤桿菌屬-根瘤菌屬(Agrobacterium-Rhizobiumsp.)的菌株E3-39,能將DON轉化成3種產物,其中主要產物是3-酮-DON,它的免疫抑制力是DON的1/10。在細胞培養液和濾液中發現了該菌株產生的DON轉化酶(系),但在細胞提取液中沒有發現該酶(系),這表明可以用分析生物化學技術從細胞培養液中分離純化DON轉化酶(系)。等[37]推測,乙醇脫氫酶能協同輔酶NADH或NADPH,將DON轉化成3-酮-DON,但沒有去證明這一機制。
Yoshizawa等[38]報道,3'-OH T-2毒素的急性毒性(LD50=4.63 mg/kg)略高于T-2毒素的急性毒性(LD50=5.31mg/kg),而3'-OH HT-2毒素的急性毒性(LD50=22.8 mg/kg)遠低于HT-2毒素的急性毒性(LD50=6.50mg/kg)。然而,Islam等[39]通過羅伊貝爾肝癌細胞株(H4-II-E)測試T-2毒素、HT-2毒素及它們羥基化產物的細胞毒性時,發現毒性大小順序為:T-2>HT-2>3'-OH T-2>3'-OH HT-2,他們報道的結果有所不同,目前還沒有見到其他有關氧化產物毒性的報道。
3.2 脫環氧作用
Zhou等[40]發現微生物能將單端孢霉烯族毒素代謝成脫環氧產物,例如將DON代謝成脫環氧DON (DOM-1)。Swanson等[41]、Young等[42]沒有發現T-2毒素、NEO、DAS和FUS的直接脫環氧產物,這可能是因為這4種單端孢霉烯族毒素C4位上存在著乙酰基,從而不利于反應的發生。
Eriksen等[43]通過DNA合成中5-溴-2'-脫氧尿苷(尿嘧啶)合成實驗分析,DOM-1的毒性是DON的1/54,脫環氧NIV的毒性是NIV的1/55。Swanson等[44]用脫環氧T-2毒素(人工合成)刺激大鼠皮膚,發現它的毒性是T-2毒素的1/400。目前,還沒有見到其他有關單端孢霉烯族毒素脫環氧產物毒性的報道。
目前真細菌菌株BBSH 797是唯一商品化運用于動物飼料脫毒的微生物,這種膠囊化的微生物產品被用于家禽和豬的飼料,其中就有BIOMIN股份有限公司的品牌產品(Mycofix),動物實驗結果顯示,這個品牌的產品能顯著降低DON對母豬和奶牛,以及T-2毒素對肉雞的不良反應。Hochsteiner等[45]認為該產品對奶牛的積極作用可能是因為該產品增強了瘤胃微生物的活性。He等[46-47]先用來自于雞大腸的微生物發酵含有DON的發霉玉米,然后再喂食幼豬進行性能測試,與喂食未經處理發霉玉米的幼豬對比,發現幼豬每日進食量、體質量增加量、飼料利用率分別高出19%、54%、37%,但是這些指標仍低于喂食不含DON飼料的幼豬,沒對微生物進行分離鑒定。Li等[48]用含有DON的玉米(其中DON含量等同于5μg/g)喂食幼豬,豬表現出了明顯的不良反應,豬每日進食量、體質量增加量、飼料利用率均出現了明顯的下降,而用發酵了的發霉玉米喂食幼豬,豬的反應與喂食不含毒素玉米時相同。
最近,Guan等[49]、Islam等[50]報道,來源于鯰魚和土壤的微生物能將DON脫環氧化形成DOM-1。
3.3 水解脫乙酰基作用
除了C-12,13環氧基團和C-9,10雙鍵之外,大多數的單端孢霉烯族毒素都含有乙酰基,它的數量和位置也影響單端孢霉烯族毒素的毒性。脫乙酰基作用能使單端孢霉烯族毒素的毒性發生改變,例如T-2毒素脫乙酰產物HT-2毒素毒性降低[51]。
T-2毒素能被土壤細菌短小桿菌屬菌株114-2水解成HT-2毒素,再脫去兩分子乙酰基,形成T-2三醇[52],瘤胃細菌菌株BBSH 797能進一步脫乙酰基形成脫環氧T-2 四醇[53]。
不同來源的微生物和動物器官(如肝臟)能進行脫乙酰化作用,這表明在不同的生物體系中,廣泛分布著負責該反應的酶類。幾種常用的酯酶抑制劑被用來測試豬肝對T-2毒素的脫乙酰基作用。相對于一般性的非特異性酯酶,乙酰膽堿型酶類更加可能是T-2毒素脫乙酰基作用的原因[54]。肝微粒體中的羧酸酯酶同工酶或白細胞中的羧酸酯酶能將T-2毒素轉化成HT-2毒素,紅細胞中一種羧酸酯酶能將T-2轉化成NEO[55-56]。目前關于這種生化途徑,以及單端孢霉烯族毒素水解酶類還不是很清楚,因此,單端孢霉烯族毒素水解作用的機制還需要進行更深入的研究。
3.4 水合作用
He等[57]用以DON作為唯一碳源的無機鹽培養基,從土壤中分離得到一株曲霉屬菌株NJA,經過兩個星期的孵化,改菌株能將94.4%的DON轉化成一種相對分子質量比DON大18.1的化學物質,但其沒有描述其分子結構和轉化產物的毒性,這可能是水分子的OH-和H+加到碳碳雙鍵兩個碳原子上的水合作用產物。
3.5 苷化共軛作用
單端孢霉烯族毒素的苷化共軛物可能是葡萄糖醛酸苷和葡萄糖苷。單端孢霉烯葡萄糖醛酸苷很可能是單端孢霉烯族毒素C3位上的羥基通過糖苷鍵連接葡萄糖醛酸的一類化合物。大鼠肝微粒體葡萄糖醛酸基轉移酶(或葡萄糖苷酸酶)能將單端孢霉烯族毒素葡萄糖苷酸化[58]。而單端孢霉烯葡萄糖苷是單端孢霉烯族毒素通過糖苷鍵連接葡萄糖異頭碳的一類化合物。從DON處理過的玉米懸浮微生物培養物中分離得到了DON-3-葡萄糖苷[59],在小麥[60]和啤酒[3]中也發現了該物質。擬南芥中的UDP-葡萄糖基轉移酶,催化UDP-葡萄糖中的葡萄糖轉移到DON和15-DON的C3位羥基上[61]。
4 結 語
雖然已經有許多關于單端孢霉烯族毒素轉化降解的研究報道,但得到實際應用的卻不多。這可能主要是因為還不夠了解轉化作用的機理,轉化產物的結構、穩定性和毒性,以及轉化作用對食物和飼料營養價值的影響等副作用,這些方面還需要深入的研究。
物理方法的效果不太理想,不能完全清除受試的真菌毒素或降低其毒性,并且往往會改變營養成分。雖然許多化學處理能顯著降低單端孢霉烯族毒素的濃度,但化學轉化作用可能會降低食物和飼料中的營養價值,也有可能殘留有毒物質,這些副作用限制了它們的應用[62]。生物方法通過脫環氧化、羰基化、羥基化、水解及葡萄糖苷酸化等反應,在溫和的條件下,將單端孢霉烯族毒素轉化成低毒或無毒產物。在這些反應中,酶起到了關鍵的作用。研究轉化降解單端孢霉烯族毒素的酶類,將它們分離純化,了解它們的特性。應用高級分子生物學和基因工程技術,來確認產生脫毒酶類的基因[63-65]。得到這些基因后,一方面可以在農作物中克隆和表達,開發具有降解單端孢霉烯族毒素的品種,另一方面可以在微生物中克隆和表達,構建微生物重組體,工業化大規模生產具有轉化降解單端孢霉烯族毒素作用的酶類。因此,在食品和飼料工業中,轉化降解單端孢霉烯族毒素的酶類具有廣闊的應用前景。
[1] HE Jianwei, ZHOU Ting, YOUNG J C, et al. Chemical and biological transformations for detoxification of trichothecene mycotoxins in human and animal food chains:a review[J]. Trends in Food Science &Technology, 2010, 21(2):67-76.
[2] ROCHA O, ANSARI K, DOOHAN F M. Effects of trichothecene mycotoxins on eukaryotic cells:a review[J]. Food Additives and Contaminants,2005, 22:369-378.
[3] LANCOVA K, HAJSLOVA J, POUSTKA J, et al. Transfer of Fusarium mycotoxins anddeoxynivalenol (deoxynivalenol-3-glucoside)from field barley through malt to beer[J]. Food Additives and Contaminants,2008, 25:732-744.
[4] PITTET A. Natural occurrence of mycotoxins in foods and feeds:a decade in review[C]//de KOE W J, SAMSON R A, van EGMOND H P.Mycotoxins and phycotoxins in perspective at the turn of the millennium.Proceedings of the 10th International IUPAC Symposium on Mycotoxins and Phycotoxins. Wageningen, Netherlands, 2001:153-172.
[5] GOYARTS T, DNICKE S, VALENTA H, et al. Carry-over ofFusariumtoxins (deoxynivalenol and zearalenone) from naturally contaminated wheat to pigs[J]. Food Additives and Contaminants, 2007, 24(4):369-380.
[6] SEELING K, DNICKE S, VALENTA H, et al. Effects ofFusariumtoxin-contaminated wheat and feed intake level on the biotransformation and carry-over of deoxynivalenol in dairy cows[J]. Food Additives and Contaminants, 2006, 22:1008-1020.
[7] VALENTA H, DNICKE S. Study on the transmission of deoxynivalenol and deepoxy-deoxynivalenol into eggs of laying hens using a highperformance liquid chromatography-ultraviolet method with clean-up by immunoaffinity columns[J]. Molecular Nutrition and Food Research,2005, 49:779-785.
[8] KABAK B, DOBSON A D W, VAR I. Strategies to prevent mycotoxin contamination of food and animal feed:a review[J]. Critical Reviews in Food Science and Nutrition, 2006, 46:593-619.
[9] PRONYK C, CENKOWSKI S, ABRAMSON D. Superheated steam reduction of deoxynivalenol in naturally contaminated wheat kernels[J].Food Control, 2006, 17:789-796.
[10] SHETTY P H, JESPERSEN L.Saccharomyces cerevisiaeand lactic acid bacteria as potential mycotoxin decontaminating agents[J]. Trends in Food Science & Technology, 2006, 17:48-55.
[11] YOUNG J C. Reduction in levels of deoxynivalenol in contaminated corn by chemical and physical treatment[J]. Journal of Agricultural and Food Chemistry, 1986, 34:465-467.
[12] YOUNG J C, SUBRYAN L M, POTTS D, et al. Reduction in levels of deoxynivalenol in contaminated wheat by chemical and physical treatment[J]. Journal of Agricultural and Food Chemistry, 1986, 34:461-465.
[13] KARLOVSKY P. Biological detoxification of fungal toxins and its use in plant breeding, feed, and food production[J]. Natural Toxins, 1999, 7(1):1-23.
[14] WHO. Food additives series 47:Safety evaluation of certain mycotoxins in food[S]. Geneva:WHO, 2001:419-528.
[15] BRETZ M, BEYER M, CRAMER B, et al. Thermal degradation of theFusariummycotoxin deoxynivalenol[J]. Journal of Agricultural and Food Chemistry, 2006, 54:6445-6451.
[16] BRETZ M, KNECHT A, GCKLER S, et al. Structural elucidation and analysis of thermal degradation products of theFusariummycotoxin nivalenol[J]. Molecular Nutrition & Food Research, 2005, 49:309-316.
[17] ABRAMSON D, HOUSE J D, NYACHOTI C M. Reduction of deoxynivalenol in barley by treatment with aqueous sodium carbonate and heat[J]. Mycopathologia, 2005, 160:297-301.
[18] BEYER M, FERSE I, MULAC D, et al. Structural elucidation of T-2 toxin thermal degradation products and investigations toward their occurrence in retail food[J]. Journal of Agricultural and Food Chemistry,2009, 57:1867-1875.
[19] HOOSHMAND H, KLOPFENSTEIN C F. Effects of gamma irradiation on mycotoxin disappearance and amino acid contents of corn, wheat, and soybeans with different moisture contents[J]. Plant Foods for Human Nutrition, 1995, 47:227-238.
[20] O'NEILL K, DAMOGLOU A P, PATTERSON M F. The stability of deoxynivalenol and 3-acetyl deoxynivalenol to gamma irradiation[J].Food Additives and Contaminants, 1993, 10(2):209-215.
[21] STEPANIK T, KOST D, NOWICKI T, et al. Effects of electron beam irradiation on deoxynivalenol levels in distillers dried grain and solubles and in production intermediates[J]. Food Additives & Contaminants:Part A, 2007, 24(9):1001-1006.
[22] KOTTAPALLI B, WOLF-HALL C E, SCHWARZ P. Effect of electronbeam radiation on the safety and quality ofFusariuminfected malting barley[J]. International Journal of Food Microbiology, 2006,110:224-231.
[23] YOUNG J C, BLACKWELL B A, APSIMON J W. Alkaline degradation of the mycotoxin 4-deoxynivalenol[J]. Tetrahedron Letters, 1986,27:1019-1022.
[24] MCKENZIE K S, SARR A B, MAYURA K, et al. Oxidative degradation and detoxification of mycotoxins using a novel source of ozone[J].Food and Chemical Toxicology, 1997, 35:807-820.
[25] YOUNG J C, ZHU Honghui, ZHOU Ting. Degradation of trichothecene mycotoxins by aqueous ozone[J]. Food and Chemical Toxicology, 2006,44(3):417-424.
[26] BURROWS E P, SZAFRANIEC L L. Hypochlorite-promoted transformations of trichothecenes, Verrucarol[J]. Journal of Organic Chemistry,1986, 51:1494-1497.
[27] BURROWS E P, SZAFRANIEC L L. Hypochlorite-promoted transformations of trichothecenes, 3. Deoxynivalenol[J]. Journal of Natural Products, 1987, 50(6):1108-1112.
[28] THOMPSON W L, WANNEMACHER R W. Detection and quantitation of T-2 mycotoxin with a simplified protein synthesis inhibition assay[J].Applied and Environmental Microbiology, 1984, 48:1176-1180.
[29] FAIFER G C, VELAZCO V, GODOY H M. Adjustment of the conditions required for complete decontamination of T-2 toxin residues with alkaline sodium hypochlorite[J]. Bulletin of Environmental Contamination and Toxicology, 1994, 52:102-108.
[31] MIROCHA C J, ABBAS H K, TREEFUL L, et al. T-2 toxin and diacetoxyscirpenol metabolism byBaccharisspp.[J]. Applied and Environmental Microbiology, 1988, 54(9):2277-2280.
[32] CORLEY R A, SWANSON S P, GULLO G J, et al. Disposition of T-2 toxin, a trichothecene mycotoxin, in intravascularly dosed swine[J].Journal of Agricultural and Food Chemistry, 1986, 34:868-875.
[33] KOBAYASHI J, HORIKOSHI T, RYU J C. The cytochrome P-450-dependent hydroxylation of T-2 toxin in various animal species[J]. Food and Chemical Toxicology, 1987, 25:539-544.
[34] YOSHIZAWA T, SAKAMOTO T, OKAMOTO K.in vitroFormation of 3'-hydroxy T-2 and 3'-hydroxy HT-2 toxins from T-2 toxin by liver homogenates from mice and monkeys[J]. Applied and Environmental Microbiology, 1984, 47:130-134.
[35] HE J. Microbial strategies for management ofFusarium graminearumand transformation of deoxynivalenol[D]. Guelph:University of Guelph,2008:153.
[36] SHIMA J, TAKASE S, TAKAHASHI Y, et al. Novel detoxification of the trichothecene mycotoxin deoxynivalenol by a soil bacterium isolated by enrichment culture[J]. Applied and Environmental Microbiology,1997, 63:3825-3830.
[38] YOSHIZAWA T, SAKAMOTO T, AYANO Y, et al. 3'-Hydroxy T-2,3'-hydroxy HT-2 toxins:new metabolites of T-2 toxin, a trichothecene mycotoxin, in animals[J]. Agricultural and Biological Chemistry, 1982,46:2613-2615.
[39] ISLAM Z, NAGASE M, OTA A, et al. Structure-function relationship of T-2 Toxin and its metabolites in inducing thymic apoptosisin vivoin mice[J]. Bioscience, Biotechnology and Biochemistry, 1998, 62:1492-1497.
[40] ZHOU T, HE J, GONG J. Microbial transformation of trichothecene mycotoxins[J]. World Mycotoxin Journal, 2008, 1(1):23-30.
[41] SWANSON S P, ROOD J H D, BEHRENS J C, et al. Preparation andcharacterization of the deepoxy trichothecenes:deepoxy HT-2, deepoxy T-2 triol, deepoxy T-2 tetraol, deepoxy 15-monoacetoxyscirpenol, and deepoxy scirpentriol[J]. Applied and Environmental Microbiology, 1987,53:2821-2826.
[42] YOUNG J C, ZHOU Ting, YU Hai, et al. Degradation of trichothecene mycotoxins by chicken intestinal microbes[J]. Food and Chemical Toxicology, 2007, 45(1):136-143.
[43] ERIKSEN G S, PETTERSSON H, LINDBERG J E. Absorption, metabolism and excretion of 3-acetyl don in pigs[J]. Archives of Animal Nutrition, 2003, 57:335-345.
[44] SWANSON S P, HELASZEK C, BUCK W B, et al. The role of intestinal microflora in the metabolism of trichothecene mycotoxins[J].Food and Chemical Toxicology, 1988, 28:823-829.
[45] HOCHSTEINER W, SCHUH M, LUGER K, et al. Influence of mycotoxins contaminated feed blood parameters and milk production[J].Berliner und Munchener Tierrztliche Wochenschrift, 2000, 113:14-21.
[46] HE Ping, YOUNG L G, FORSBERG C. Microbially detoxified vomitoxin-contaminated corn for young pigs[J]. Journal of Animal Science,1993, 71:963-967.
[47] HE Ping YOUNG L G, FORSBERG C. Microbial transformation of deoxynivalenol (vomitoxin)[J]. Applied and Environmental Microbiology,1992, 58:3857-3863.
[48] LI Xinzhen, ZHU J, LANGE DE C F M, et al. Microbial detoxification of deoxynivalenol (DON) demonstrated in a swine feeding trial[C]//The 2008 Canadian Institute of Food Science & Technology Conference.Charlottetown, Canada, 2008-05-25.
[49] GUAN Shu, HE Jianwei, YOUNG J C, et al. Transformation of trichothecene mycotoxins by microorganisms from fish digesta[J].Aquaculture, 2009, 290(3/4):290-295.
[50] ISLAM M R, HE Jianwei, PAULS P P, et al. Isolation and characterization of soil bacteria capable of detoxifying the mycotoxin deoxynivalenol(DON)[C]//The American Phytopathological Society 2008 Meeting. 2008-07-26, Minneapolis, USA.
[51] BETINA V. Structure-activity relationships among mycotoxins[J].Chemico Biological Interactions, 1989, 71:105-146.
[52] UENO Y, NAKAYAMA K, ISHII K, et al. Metabolism of T-2 toxin inCurtobacteriumsp. strain 114-2[J]. Applied and Environmental Microbiology, 1983, 46(1):120-127.
[53] FUCHS E, BINDER E M, HEIDLER D, et al. Structural characterization of metabolites after the microbial degradation of type A trichothecenes by the bacterial strain BBSH 797[J]. Food Additives and Contaminants,2002, 19:379-386.
[54] WEI R D, CHU F S. Modification ofin vitrometabolism of T-2 toxin by esterase inhibitors[J]. Applied and Environmental Microbiology,1985, 50:115-119.
[55] JOHNSEN H, ODDEN E, JOHNSEN B A, et al. Metabolism of T-2 toxin by blood cell carboxylesterases[J]. Biochemical Pharmacology,1988, 37:3193-3197.
[56] JOHNSEN H, ODDEN E, LIE O. Metabolism of T-2 toxin by rat liver carboxylesterase[J]. Biochemical Pharmacology, 1986, 35:1469-1473.
[57] HE Chenghua, FAN Yanhong, LIU Guofang, et al. Isolation and identification of a strain ofAspergillus tubingensiswith deoxynivalenol biotransformation capability[J]. International Journal of Molecular Sciences,2008, 9:2366-2375.
[58] WU Xianai, MURPHY P, CUNNICK J, et al. Synthesis and characterization of deoxynivalenol glucuronide:its comparative immunotoxicity with deoxynivalenol[J]. Food and Chemical Toxicology, 2007, 45:1846-1855.
[59] SEWALD N, von GLEISSENTHALL J L, SCHUSTER M, et al.Structure elucidation of a plant metabolite of 4-desoxynivalenol[J]. Tetrahedron Asymmetry, 1992, 3(7):953-960.
[60] BERTHILLER F,ASTA C, SCHUHMACHER R, et al. Masked mycotoxins:determination of a deoxynivalenol glucoside in artificially and naturally contaminated wheat by liquid chromatography-tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2005,53:3421-3425.
[61] POPPENBERGER B, BERTHILLER F, LUCYSHYN D, et al. Detoxification of theFusariummycotoxin deoxynivalenol by a UDP-glucosyltransferase fromArabidopsis thaliana[J]. Journal of Biological Chemistry, 2003, 278:47905-47914.
[62] KABAK B, DOBSON A D W, VAR I. Strategies to prevent mycotoxin contamination of food and animal feed:a review[J]. Critical Reviews in Food Science and Nutrition, 2006, 46:593-619.
[63] ALTALHI A D. Plasmid-mediated mycotoxin zearalenone inPseudomonas putidaZEA-1[J]. American Journal of Biochemistry and Biotechnology, 2007, 3(1):150-158.
[64] ALTALHI A D, EL-DEEB B. Localization of zearalenone detoxification gene(s) in pZEA-1 plasmid ofPseudomonas putidaZEA-1 and expressed inEscherichia coli[J]. Journal of Hazardous Materials, 2009,161:1166-1172.
[65] TAKAHASHI-ANDO N, OHSATO S, SHIBATA T, et al. Metabolism of zearalenone by genetically modified organisms expressing the detoxification gene fromClonostachys rosea[J]. Applied and Environmental Microbiology, 2004, 70(6):3239-3245.
Research Progress in Transformation and Degradation of Trichothecenes
ZOU Zhong-yi,HE Zhi-fei,LI Hong-jun*,ZOU Cheng-han,HAN Peng-fei,YANG Jia-yi
(College of Food Science, Southwest University, Chongqing 400716, China)
TS201.6
A
1002-6630(2010)19-0443-06
2010-01-08
國家“973”計劃項目(2009CB118806)
鄒忠義(1982—),男,博士研究生,研究方向為現代食品加工理論與技術。E-mail:zzy911zzy911@163.com
*通信作者:李洪軍(1961—),男,教授,博士,研究方向為肉類科學與酶工程。E-mail:hongjunli1961@yahoo.com.cn

