乳酸菌蛋白代謝研究進展
白鳳翎,張柏林,趙宏飛
(1.渤海大學生物與食品科學學院,遼寧 錦州 121000;2.北京林業大學生物科學與技術學院,北京 100083)
乳酸菌蛋白代謝研究進展
白鳳翎1,張柏林2,趙宏飛2
(1.渤海大學生物與食品科學學院,遼寧 錦州 121000;2.北京林業大學生物科學與技術學院,北京 100083)
由于乳酸菌缺乏各種生物合成途徑,不能合成生長必需的一些氨基酸、維生素等物質,營養要求也十分苛刻。乳酸菌擁有胞外蛋白酶,水解乳中酪蛋白形成寡肽和氨基酸,通過寡肽轉運系統Opp、二肽和三肽轉運系統DtpP和DtpT將水解產物運輸進入細胞,胞內的各種肽酶裂解形成游離氨基酸供細胞合成代謝,滿足乳酸菌的生長需要。乳酸菌蛋白代謝研究對提高乳酸菌的生長水平、建立高密度培養體系以及促進奶酪等乳制品發酵過程中風味物質及其風味前體物質的形成研究具有重要意義。
乳酸菌;蛋白質;代謝
乳酸菌是一類革蘭氏陽性球狀、球桿狀和桿狀細菌,能夠在厭氧或兼性厭氧條件下發酵己糖產生乳酸,形成與人類生活密切相關的發酵產品。由于乳酸菌屬于分類地位差異性很大的細菌類群,對乳酸菌生理代謝進行研究開展比較緩慢。深入了解乳酸菌這一特殊類群細菌的生物學特征,對提高乳酸菌代謝水平、開發乳酸菌發酵產品具有非常重要的理論和實際應用價值。
自然環境中乳酸菌能夠很好地利用棲息地中的物質生長,與乳中乳酸菌能夠很好地適應利用乳糖作為碳源和能源一樣,乳酸菌也很好地應用酪蛋白作為氮源。乳酸菌不能同化無機氮源,因此,它們必須降解蛋白質和多肽來滿足細胞合成代謝對氨基酸的需要。1974年Mckay等[1]首先證明了乳酸菌必須依靠自身蛋白水解系統降解乳中酪蛋白才能滿足其生長的需要,他們研究發現,乳酸乳球菌蛋白酶基因質粒的治愈菌株不能在乳中進行高密度生長,如果在乳中添加水解酪蛋白,則質粒治愈菌株就會同正常菌株一樣生長。
乳中乳酸菌已經進化具有降解大分子酪蛋白為小分子片段的高效系統,能夠滿足在乳中生長對氨基酸的需要。該蛋白水解系統包括三組主要成分:第一組為將大分子酪蛋白水解成多肽的胞外蛋白酶;第二組是將多肽轉運進入細胞的多個轉運體系中的一個系統;第三組包含將轉運進入細胞多肽進一步水解形成自由氨基酸的多種肽酶(圖1),這些氨基酸最終進行代謝或合成蛋白質。本文對乳酸菌蛋白代謝的研究進展進行綜述,對深入了解掌握乳酸菌的蛋白代謝機制,提高乳酸菌的生長水平和建立高密度培養體系具有借鑒作用。同時,乳酸菌蛋白代謝研究也可為奶酪等乳制品發酵過程中風味物質及其風味前體物質的形成方面提供理論基礎。
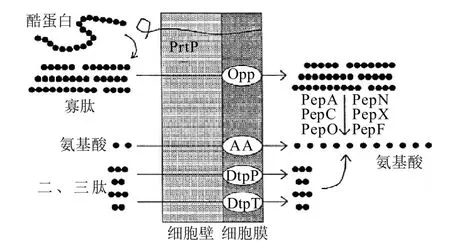
圖1 乳球菌的酪蛋白水解系統[1]Fig.1 Proteolytic system in Lactococci
1 蛋白酶系統
雖然人們認為乳酸菌可能具有各種各樣的蛋白水解系統,但是被廣泛研究的且大多數乳酸菌都擁有的是乳酸乳球菌的蛋白水解系統。對于乳酸乳球菌和其他乳中生長的乳酸菌而言,酪蛋白是氨基酸態氮的主要來源,然而乳中非蛋白氮和自由氨基酸是有限的(<300mg/L),隨著乳酸菌生長很快就被消耗掉。乳酸乳球菌屬于復合氨基酸自養型微生物,需要盡可能多的氨基酸,因此酪蛋白水解對其生長是十分必要的。乳酸乳球菌擁有一個大的、沒有活性的蛋白酶原表達的與細胞膜結合的絲氨酸蛋白酶(PrtP)(>200kD)。如果對蛋白質跨過細胞膜有直接作用的前導序列被除去的話,則剩余蛋白就被錨定在細胞壁上,然而,該蛋白酶原只有被成熟蛋白(PrtM)加工后才具有活性。PrtM可能是將PrtP自動降解成小片段,導致酶對蛋白區的水解,形成成熟的分子質量為180~190kD 的PrtP。
不同的乳酸乳球菌(Lactococcus lactis)菌株中擁有相類似的蛋白酶,然而它們的氨基酸序列具有小的差異。乳酸乳球菌中特殊的酪蛋白底物和PrtP水解產物不盡相同。例如,PⅢ型A群蛋白酶水解αs1-酪蛋白、β-酪蛋白和κ-酪蛋白,而PⅠ型E群蛋白酶具有較強的水解β-酪蛋白活性,對αs1-酪蛋白和κ-酪蛋白水解能力較弱。進一步而言,乳酸乳球菌中PrtP和PrtM系統的功能性差異較小。乳酸菌在乳中迅速生長二者都是必需的,當細胞在低含量肽培養基中生長時,基因PrtP和PrtM被誘導表達,而在肽豐富的培養基中則被抑制[2]。
來自于PrtP對β-酪蛋白的水解作用有超過100多種酪蛋白水解產物,這些產物大多數是4到10個氨基酸殘基大片段的大分子寡肽(4~30 氨基酸),沒有形成游離氨基酸、二肽和三肽[2]。由PrtP形成首要的也是最豐富的寡肽是由β-酪蛋白的C端產生的,似乎最初的水解作用引起酪蛋白打開,導致其他的裂解片段暴露出來[3]。
2 氨基酸和多肽轉運系統
雖然有學者認為在多肽被轉運前胞外蛋白酶一定參與降解多肽的過程,但到現在為止,由PrtP形成的多肽水解體系還沒有發現,至少也沒發現多肽酶。相反,乳酸乳球菌和其他乳酸菌擁有各種各樣的氨基酸和多肽轉運系統,能夠轉運大小、極性和結構不同的底物。這些轉運系統有些是具有高特異性的,而有些的特異性相對較差,同時在轉運過程中也消耗能量。
如前所述,乳中氨基酸的濃度太低不能支持乳酸菌的生長需要。乳酸乳球菌至少有10種氨基酸轉運子,大多數轉運子具有結構相似性,其底物具有特異性。如果培養基中含有足夠的游離氨基酸,這些轉運系統能夠使足夠的氨基酸進入細胞內,支持細胞生長。然而,這暗示了轉運子的首要功能是從細胞質中分泌或流出過多的氨基酸來維持適當的細胞內氨基酸池的比例[4]。如果多肽是氨基酸的必需、首要氮源的話,那么一些由細胞內多肽產生的氨基酸可能積累比同化吸收快些,這些游離氨基酸能夠通過氨基酸轉運子以相反或流出的方向擴散到細胞外降低它們的濃度差。如果氨基酸的流出是伴隨偶合離子的話(如質子擴散),則獲得質子動力(proton motive force,PMF)的增加值。氨基酸的擴散提供能量甚至有可能驅動多肽的吸收[4]。
與氨基酸轉運子具有鮮明對比的是多肽轉運系統,它們能夠很好地滿足乳酸菌在乳中生長的需要。已經確證有三組多肽轉運系統,包括轉運二肽和三肽的兩組DtpP和DtpT和轉運寡肽的寡肽轉運系統Opp。DtpT是一個含有463個氨基酸組成的依賴PMF轉運大單體,與水溶性多肽具有親和力。已經被獲得去掉dtpT基因的突變菌株不能表達DtpT和轉運一些多肽。在化學限定培養基上dtpT基因缺陷菌株生長很差。然而,這些突變菌株在乳中的生長不受影響,表明DtpT 在乳中不是必需的。乳酸菌的另一個轉運二肽和三肽的DtpP轉運系統是一種ATP依賴性轉運系統,對水溶性多肽具有高度親和性,對乳球菌在乳中生長也不是必需的[5]。
乳酸菌中第3種也是最重要的是寡肽轉運系統Opp。由于二肽和三肽都不是由酪蛋白釋放的,因此對乳酸菌在乳中生長DtpP和DtpT都不是必需的,乳酸乳球菌依賴寡肽和Opp來滿足所有氨基酸的需要。實驗證明不能表達編碼Opp系統的基因突變菌株不能轉運多肽,也不能在乳中生長[6-7]。盡管最初還不知道寡肽是由Opp轉運的,乳酸乳球菌乳酸亞種中Opp系統的很多結構和遺傳學特征已很好地被研究清楚[8]。Opp復合體屬于轉運系統中的ABC(ATP結合盒)家族,它含有5個亞基:包括兩個轉運膜蛋白OppB和OppC,兩個ATP結合蛋白OppD和OppF和1個膜連接底物結合蛋白OppA。編碼Opp的5個基因形成oppDFBCA的操縱子,一個編碼肽酶PepO的基因緊接著也定位OppA 的下端,和Opp操縱子有共同轉錄區[7]。
雖然Opp系統可以轉運多種多樣的寡肽,在PrtP從β-酪蛋白釋放出100多種多肽中,只有10~14種多肽作為Opp的底物。所有這些寡肽含有4~11個氨基酸殘基[3],進一步分析它們含有高水平的纈氨酸、脯氨酸和谷氨酸,中等水平的丙氨酸、亮氨酸、異亮氨酸、賴氨酸和絲氨酸。十分重要的是這些寡肽提供除了組氨酸以外的所有必需氨基酸供乳球菌在乳中生長需要。
3 肽 酶
蛋白質代謝的第三步即最后一步是Opp積聚的多肽水解成片段。來自乳酸乳桿菌和乳酸乳球菌20多種不同的肽酶的生化和遺傳學特征已經研究清楚(表1)。內肽酶(裂解中間多肽鍵)和外肽酶(裂解末端肽鍵)廣泛分布,后者中氨基肽酶已經報道,然而C端肽酶還沒有發現。一般情況下,需要內肽酶、氨基肽酶、二肽酶和三肽酶的共同協調作用才能完全利用由Opp系統轉運進入細胞積聚的多肽。盡管有相當多的討論,基于遺傳學和生理學的見證(信號肽的缺乏和錨定序列以及免疫標定實驗等)更容易接受的是這些肽酶是細胞內酶。乳酸菌肽酶的底物大小、特性和其他一些特征已經引起人們的濃厚興趣,這不僅是因為肽酶生理學的重要性,而且在奶酪制造和成熟等方面肽酶發揮著非常重要的作用。
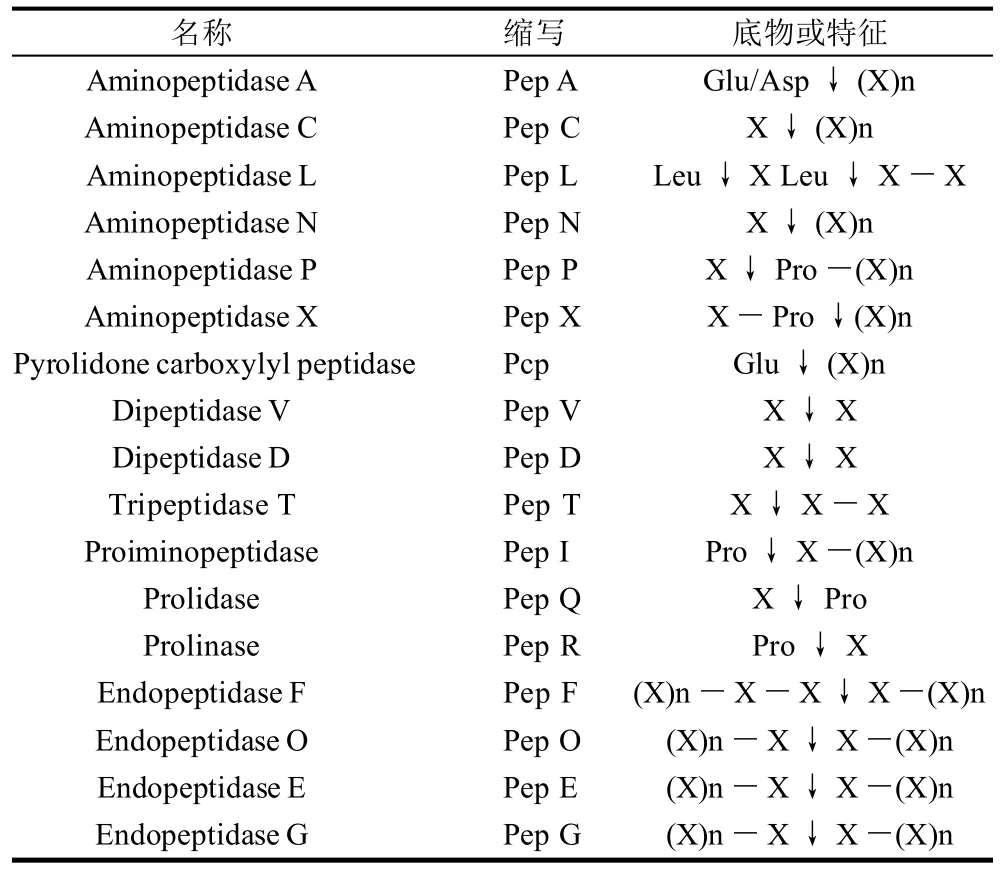
表1 乳酸菌的肽酶Table 1 Previously reported LAB-derived peptidases and their characteristics
3.1 內肽酶
幾種內肽酶包括乳酸乳球菌中PepF、PepO[9]和瑞士乳桿菌中的PepE、PepG、PepO[10]已經被報道。大多數內肽酶是含有典型鋅結合序列的金屬酶,可以對各種大小的多肽進行水解。更有趣的是一些內肽酶如PepF在pH7.5~9.0范圍內具有最佳活性,在奶酪成熟的pH值范圍(<6.0)活性很低。因此,這些肽酶在細胞生理學和奶酪成熟中的作用很小。此外,乳中多肽酶突變菌株不受影響[9,11]。
3.2 二肽酶和三肽酶
來自培養基中積累或細胞內寡肽水解的二肽和三肽被二肽酶和三肽酶進一步水解成游離氨基酸。幾種二、三肽酶已經被純化,基因已被克隆[11]。盡管這些酶有各種各樣自身的生物化學和物理學特性,但它們都是基于底物的特性而發揮作用。一些二肽酶和三肽酶具有非常重要的功能。幾種二肽酶屬于脯氨酰氨基酸二肽酶或氨酰基脯氨酸二肽酶,水解N端或C端具有脯氨酸的肽。例如,乳酸乳球菌中的PepQ和瑞士乳桿菌中的PepR分別裂解X ↓ Pro和Pro ↓ X 的二肽[12-13]。另一些水解含脯氨酸二肽和三肽的肽酶也被報道[14]。乳酸乳桿菌中三肽酶水解三肽PepT具有特征性[15]。
3.3 氨基肽酶
氨基肽酶廣泛存在于乳酸菌中,它是水解N端肽鍵釋放N端氨基酸的酶[16]。以酶的特征對氨基肽酶進行分類,一般的或特異性較差的氨基肽酶PepN和PepC水解2~12個氨基酸的寡肽,一般很少有水解含脯氨酸二肽的活性,這些酶很好地存在于乳酸乳桿菌和乳酸乳球菌中。
因為β-酪蛋白富含脯氨酸,很多PrtP寡肽產物含有脯氨酸。如前所述,含脯氨酸多肽通常對一般的肽酶是特異性較差的底物,相反特異性較強的如PepA、PepX、PepP、PepR和PepI等能夠水解這些含脯氨酸多肽。像其他肽酶一樣,氨基肽酶因底物的大小和特性不同而多種多樣。例如,乳酸乳球菌中PepP的底物是具有X-Pro-Pro-(X)n序列4~10個氨基酸的寡肽[17]。相反,乳酸乳球菌中PepX水解相似的寡肽之外,還能水解二肽和一些不含脯氨酸的多肽[18]。一般的和特異性強的氨基肽酶對奶酪生產都特別重要,因為許多多肽不進行降解的話就具有苦味。
4 結 語
由于乳酸菌缺乏必要的生物代謝途徑,不能合成生長所必需的氨基酸和維生素等生長因子,乳酸菌必須從培養基中獲得這些生物活性物質才能滿足其快速生長需要。乳酸菌依靠胞外蛋白酶水解乳中酪蛋白形成寡肽和氨基酸,這些水解產物通過寡肽轉運系統Opp、二肽和三肽轉運系統DtpP和DtpT運輸進入細胞,最后由細胞內的各種肽酶裂解形成游離氨基酸供細胞合成代謝。由此可以表明乳酸菌在自然生長環境中已經形成了一整套完善的蛋白代謝系統,這是生物與環境相互作用的結果。
近年來對乳酸菌蛋白代謝機制的進一步研究主要集中在分子生物學調控方面[19-20],通過深入研究可從基因水平掌握乳酸菌的蛋白代謝機制。從而利用代謝調控手段提高乳酸菌的生長數量和代謝水平,推動乳酸菌研究的迅速發展,獲得高水平的發酵產品。
[1] MCKAY L L, BALDWIN K A. Simultaneous loss of proteinase and lactose-utilizing enzyme activities in Streptococcus lactis and reversal by transduction[J]. Appl Microbiol, 1974, 28(3): 342-346.
[2] JUILLARD V, LAAN H, KUNJI E R S, et al. The extracellular P-type proteinase of Lactococcus lactis hydrolyzes-casein into more than one hundred different olipeptides[J]. J Bacteriol, 1995, 177(12): 3472-3478.
[3] KUNJI E R S, FANG G, JERONIMUS-STRATINGH C M, et al. Reconstruction of the proteolytic pathway for useβ-casein by Lactococcus lactis[J]. Mol Microbiol, 1998, 27(6): 1107-1118.
[4] KUNJI E R S, MIERAU I, HAGTING A, et al. The proteolytic systems of lactic acid bacteria[J]. Antonievan Leeuwenhoek, 1996, 70(2): 187-221.
[5] FOUCAUD C, KUNJI E R S, HAGTING A, et al. Specificity of peptide transport systems in Lactococcus lactis: evidence for a third system which transports hydrophobic di-and tripeptides[J]. J Bacteriol, 1995,177(80): 4652-4657.
[6] KUNJI E R S, HAGTING A, de VRIED C J, et al. Transport of βcasein-derived peptides by the oligopeptide transport system is a crucial step in the proteolytic pathway of Lactococcus lactis[J]. J Biol Chem,1995, 270(4): 1569-1574.
[7] TYNKKYNEN S, BUIST G, KUNJI E, et al. Genetic and biochemical characterization of the oligopeptide transport system of Lactococcus lactis[J]. J Bacteriol, 1993, 175(12): 7523-7532.
[8] DETMERS F J M, KUNJI E R S, LANFERMEIJER F C, et al.Kinetics and specificity of peptide uptake by the oligopeptide transport system of Lactococcus lactis[J]. Biochemistry, 1998, 37(47): 16671-16679.
[9] MONNET V, NARDI M, CHOPIN A, et al. Biochemical and genetic characterization of PepF, an oligopeptidase from Lactococcus lactis[J]. J Biol Chem,1994, 269(51): 32070-32076.
[10] CHRISTENSEN J E, DUDLEY E G, PEDERSON J A, et al. Peptidases and amino acid catabolism in lactic acid bacteria[J]. Antonievan Leeuwenhoek, 1999, 76(1): 217-246.
[11] MIERAU I, TAN P S T, HAANDRIKMAN A J, et al. Cloning and sequencing of the gene for a lactococcal endopeptidase, an enzyme with sequence similarity to mammalian enkephalinase[J]. J Bacteriol, 1993,175(7): 2087-2096.
[12] BOOTHE M, JENNINGS P V, FHAOLAIN I N, et al. Prolidase activity of Lactococcus lactis subsp. cremoris AM2:partialpurification and characterization[J]. J Dairy Res, 1990, 57(2): 245-254.
[13] VARMANEN P, STEELE J L, PALVA A. Characterization of a prolinase gene and its product, and an adjacent ABC transporter gene from Lactobacillus helveticus[J]. Microbiology, 1996, 142(4): 809-816.
[14] BAANKRIES R, EXTERKATE F A.Characterisation of a peptidase from Lactococcus lactis subsp.cremoris HP that hydrolyzes di-and tripeptides containing proline or hydrophobic residues as the amino terminal amino acid[J]. System Appl Microbiol, 1991, 14(2): 317-323.
[15] SAVIJOKI K, PALVA A. Purification and molecular characterization of a tripeptidase (PepT) from Lactobacillus helveticus[J]. Appl Environ Microbiol, 2000, 66(2):794-800.
[16] MIERAU I, KUNJI E R S, VENEMA G, et al. Casein and peptide degradation in lactic acid bacteria[J]. Biotechnol Genet Eng Rev, 1997,14(4): 279-301.
[17] MARS I, MONNETT V. An amino peptidase P from Lactococcus lactis with original pecificity[J]. Biochim Biophys Acta, 1995, 1243(3): 209-215.
[18] MAYO B, KOK J, VENEMA K, et al. Molecular cloning and sequence analysis of the X-propyl dipeptidyl aminopeptidase gene from Lactococcus lactis subsp. cremoris[J]. Appl Environ Microbiol, 1991, 57(1): 38-44.
[19] MAGNANI D, BARRE O, GERBER S D, et al. Characterization of the CopR regulon of Lactococcus lactis IL1403[J]. J Bacteriol, 2008, 190(2): 536-545.
[20] LARSEN R, van HIJUM S, MARTINUSSEN J, et al. Transcriptome analysis of the Lactococcus lactis ArgR and AhrC regulons[J]. Appl Environ Microbiol, 2008, 74(15): 4768-4771.
Progress in Protein Metabolism of Lactic Acid Bacteria
BAI Feng-ling1,ZHANG Bo-lin2,ZHAO Hong-fei2
(1. College of Biotechnology and Food Science, Bohai University, Jinzhou 121000, China;2. College of Biological Science and Biotechnology, Beijing Forestry University, Beijing 100083, China)
Due to the lack of various biosynthetic pathways, lactic acid bacteria (LAB) are nutritionally fastidious and unable to synthesize some essential amino acids and vitamins. LAB possess extracellular proteinase and this enzyme hydrolyzes dairy casein into oligopeptides and amino acids, which can be transported into cells by the oligopeptide transport system (Opp) and the di-tripeptide transport systems (DtpT and DtpP), followed by the hydrolysis of intracellular oligopeptides by endogenous peptidases into free amino acids supporting the synthesis and metabolism of LAB cells during their growth. Hence, studies of protein metabolism in lactic acid bacteria have great significance for improving LAB growth, establishing high-density culture systems and promoting the formation of flavor compounds and their precursors during the fermentation of cheese and other dairy products.
lactic acid bacteria;protein;metabolism
Q936
A
1002-6630(2010)19-0381-04
2010-06-28
國家“863”計劃項目(2006AA10Z344;2008AA10Z335);遼寧省教育廳重點實驗室項目(2008S005)
白鳳翎(1964—),男,教授,博士,研究方向為食品微生物學與食品生物技術。E-mail:baifling@yahoo.com.cn

