冰結構蛋白對濕面筋蛋白凍藏穩定性的影響
李玲玲,賈春利,黃衛寧,*,金亮秀,RAYAS-DUARTE Patricia
(1.江南大學食品學院,食品科學與技術國家重點實驗室,江蘇 無錫 214122;2.美國俄克拉荷馬州立大學農產品與食品研究中心,美國 俄克拉荷馬州 斯蒂爾沃特 74078-6055)
冰結構蛋白對濕面筋蛋白凍藏穩定性的影響
李玲玲1,賈春利1,黃衛寧1,*,金亮秀1,RAYAS-DUARTE Patricia2
(1.江南大學食品學院,食品科學與技術國家重點實驗室,江蘇 無錫 214122;2.美國俄克拉荷馬州立大學農產品與食品研究中心,美國 俄克拉荷馬州 斯蒂爾沃特 74078-6055)
研究冬小麥冰結構蛋白(ISP)對濕面筋蛋白凍藏穩定性的影響。采用差示掃描量熱儀、動態流變儀、掃描電子顯微鏡分別研究空白濕面筋蛋白(未添加ISP)和添加ISP的濕面筋蛋白凍藏不同時間后可凍結水含量、流變學特性及超微結構的變化。結果表明:1)隨著凍藏時間延長,濕面筋蛋白可凍結水含量逐漸增大;凍藏時間相同時,添加ISP濕面筋蛋白的融化焓小于空白濕面筋蛋白。2)濕面筋蛋白的彈性模量、黏性模量和蠕變均隨凍藏時間的延長而降低;凍藏時間相同時,含ISP濕面筋蛋白的蠕變明顯小于空白濕面筋蛋白的相應參數。3)濕面筋蛋白網絡經過凍藏后,不規則的孔洞更大,引入ISP后,冰晶形成的不規則孔洞相對于空白濕面筋蛋白更加細小和均勻。說明ISP能夠通過減少濕面筋蛋白體系中的可凍結水含量,抑制冰晶形成和重結晶,從而減小凍藏過程中濕面筋蛋白網絡遭受的破壞。
冰結構蛋白;濕面筋蛋白;可凍結水;動態流變學特性;微觀結構
Abstract:To understand the effect of ice-structuring protein (ISP) from winter wheat on the stability of frozen hydrated gluten,the freezable water content, rheological properties and microstructure of hydrated gluten with and without added ISP frozen for 1, 2, 4, 7 weeks and 9 weeks were determined by differential scanning calorimetry (DSC), rheometer and scanning electron microscopy (SEM), respectively. The results showed that:1) the amount of freezable water in hydrated gluten increased with increasing frozen time, while the addition of ISP could prevent the increase in freezable water content that; 2) both theG' andG' of hydrated gluten decreased with increasing frozen storage time, while hydrated gluten containing ISP always had higherG'andG' than its blank counterpart at the same frozen storage time points; and 3) less damage of gluten network caused by ice growth and recrystallization was observed for hydrated gluten containing ISP compared with control one at the same frozen storage time points. These results indicate that ISP can prevent hydrated gluten network from ice crystal damage.
Key words:ice-structuring protein;hydrated gluten;freezable water;dynamic rheological properties;microstructure中圖分類號:Q816 文獻標識碼:A 文章編號:1002-6630(2010)19-0025-04
小麥面筋蛋白是一種黃白色有彈性和延伸性的物質,主要由麥醇溶蛋白和麥谷蛋白組成,面筋蛋白吸水后,蛋白分子逐漸水化,分子間相互作用形成三維網狀結構[1-5],賦予面團持水性、面團黏結性與黏彈性等流變學性質[6-7]。冷凍是已被廣泛應用的一種食品保存方法,但在冷凍貯藏過程中,因溫度波動而引起的重結晶現象可引起濕面筋網絡結構物化性質的改變,尤其可凍結水形成冰晶后體積增加,表現出異常的膨脹特性,使得蛋白質的三維網絡結構受到擠壓而破壞。關于濕面筋蛋白凍融穩定性方面的研究是冷凍面團及其制品體系基礎研究的重要部分,具有實踐指導意義[8]。
2006年,我國衛生部公布冰結構蛋白(ice-structur-ing protein,ISP)即抗凍蛋白是可用于冷凍食品中的新型食品添加劑[9],可以被多種生物如魚類,植物及昆蟲所合成,以保證它們在低溫下可以生存[10]。ISP有3種主要功能:熱滯活性、修飾冰晶及抑制重結晶[11-12]。周美玲[13]及潘振興[14]在國內率先對ISP在冷凍面團體系中的應用研究進行了報道。關于ISP在冷凍面團及其食品體系中的研究正在成為烘焙與發酵技術領域的熱點課題之一。
本實驗采用差示掃描量熱儀研究凍藏時間對濕面筋蛋白中可凍結水含量的影響;用動態流變儀研究冷凍濕面筋蛋白的黏彈性模量隨凍藏時間的變化;采用掃描電子顯微鏡觀察不同凍藏時間下冷凍濕面筋蛋白網絡結構的變化,進而分析濕面筋蛋白中冰-水相平衡的變化及冰結構蛋白影響濕面筋蛋白凍藏穩定性的作用機制,為冷凍面制品的研究提供參考。
1 材料與方法
1.1 材料
冰結構蛋白(ISP) 加拿大弗蘭伯勒生物冰技術有限公司;面筋蛋白 山東瑞祥淀粉有限公司。
1.2 儀器與設備
Pyris 1差示量熱掃描儀 英國Perkin-Elmer公司;SX-40掃描電子顯微鏡 日本明石公司;冷凍干燥機美國Abconco公司;AR1000動態流變儀 英國TA公司。
1.3 方法
1.3.1 樣品制備
稱取一定量的小麥面筋蛋白粉與蒸餾水,按質量比1:1的比例混合均勻,將制得的濕面筋蛋白用保鮮膜包裹,放在常溫下穩定1h,然后切成圓片,用保鮮膜包裹放在-18℃冰箱中。
1.3.2 可凍結水含量測定
用銦和錫校準差示掃描量熱儀。用剃刀從冷凍濕面筋蛋白圓片中心部位取10~15mg,密封在小鋁盒中,放入DSC,空氣作參比。在-15℃和5℃各保持5min,從-15℃升溫到5℃,升溫速度為1℃/min。記錄可凍結水的焓變(ΔH)。
1.3.3 動態流變學實驗
測定條件:直徑20mm、偏角1°椎板,溫度25℃,頻率范圍0.01~100rad/s,應變量10%,測定貯能模量G′及損耗模量G′隨頻率(0.01~100rad/s)的變化。
1.3.4 冷凍濕面筋蛋白微觀結構觀察
取冷凍濕面筋蛋白樣品在30℃解凍2h后進行冷凍干燥。樣品先用2.5%戊二醛固定,0.1mol/L磷酸緩沖液漂洗,再用1%四氧化二鋨固定,0.1mol/L磷酸緩沖液沖洗,用30%、50%、70%、90%、100%乙醇梯度洗脫。用醋酸異戊酯置換出乙醇后,采用臨界點干燥法進行干燥,經離子濺射噴金后,置于掃描電子顯微鏡下觀察樣品結構。加速電壓為5kV。
2 結果與分析
2.1 可凍結水含量研究
面筋蛋白質中水分子主要以結合水、可凍結結合水和自由水3種狀態存在[15]。所謂的可凍結水主要由自由水和可凍結結合水組成;所謂的非凍結水主要由結合水和另一部分松散的結合水組成。凍藏過程中,冰晶是破壞面筋蛋白質網絡結構的主要因素之一,而可凍結水含量決定了面團在凍藏過程中冰晶的形成量,可凍結水越少,面筋的網絡結構保持的越完整。可凍結水(冰)的含量可以通過計算DSC曲線峰值下的面積所測得的熔化焓值ΔH來反映[16-17]。圖1即為本實驗測定的典型冷凍濕面筋蛋白的DSC曲線。
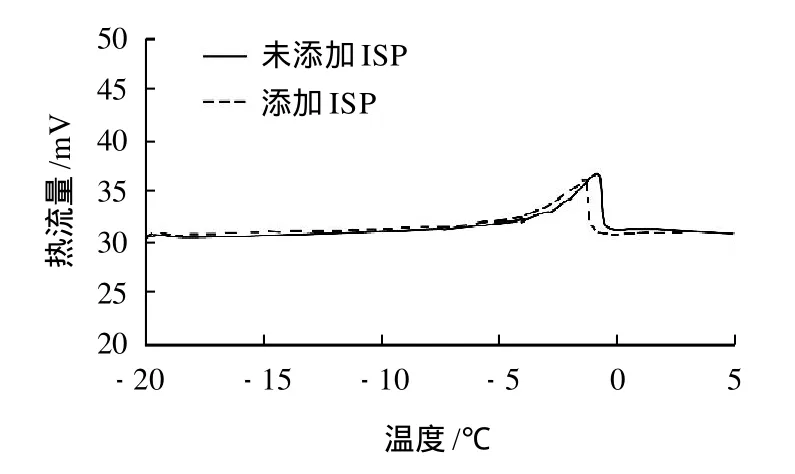
圖1 典型冷凍濕面筋蛋白的DSC曲線Fig.1 Typical DSC spectra of frozen gluten with and without added ISP
由圖1可以看出,冷凍面團的冰晶融化溫度范圍大致介于-7~2℃之間,這與宋國勝[18]得到的結果基本一致。

圖2 濕面筋蛋白中的冰的融化焓Fig.2 Change in ice melting enthalpy in hydrated gluten with and without added ISP during frozen storage
用DSC測定冷凍濕面筋蛋白中可凍結水(冰)的含量。濕面筋蛋白中冰的融化焓隨凍藏時間的變化如圖2所示。隨凍藏時間的延長,濕面筋蛋白樣品融化焓值均呈增大趨勢,即表明冷凍濕面筋蛋白中可凍結水量增加。空白樣品在凍藏時間為1周時,冰的融化焓為88.5J/g,比Kontogiorgos等[19]得出的值要小些,這可能是因為面筋蛋白的來源以及面筋和水的比例不一致造成的。凍藏2周后,融化焓值為96J/g,增加了8.4%,而當凍藏時間達到9周時,融化焓達到112.5J/g,與第1周相比,焓值增加了27.1%。開始時水分的遷移和可凍結水的增加,可能是因為在較低溫度下濕面筋蛋白的網絡結構遭到破壞;當凍藏時間為9周時,可凍結水焓值又有所增加,這可能是因為在長時間凍藏過程中,冰晶的重結晶效應導致濕面筋網絡結構破壞程度增加,使得水分從網絡結構中離析出來,可凍結水量增加[20]。
加入冰結構蛋白后,凍藏1周冰的融化焓為83.4J/g,比空白樣品降低了4.9%,而凍藏9周融化焓達到103.3J/g,比空白樣品降低了8.9%,總的看來,加入ISP后,隨著凍藏時間的增加,冰的融化焓仍是增加的,但是在凍藏時間相同時,含ISP的面筋蛋白冰融化焓值要明顯小于空白樣品,這是因為冰結構蛋白在范德華力、疏水相互作用和氫鍵作用下吸附到面筋蛋白體系中冰核表面,抑制冰核生長即抑制重結晶,減小了冰晶對濕面筋蛋白網絡結構的破壞,從而減少了從網絡結構中離析出的水分。
2.2 流變學特性變化
運用動態流變儀對樣品進行頻率掃描,研究其彈性模量和黏性模量的變化,即對樣品施加相同的應力,研究振蕩頻率對彈性模量和黏性模量的影響。此方法可以在不破壞樣品結構的情況下,直接獲得與樣品的彈性和黏性行為相關的信息。

圖3 凍藏濕面筋蛋白彈性模量和黏性模量隨頻率的變化Fig.3 Changes inG' andG''of hydrated gluten frozen for different weeks with frequency
凍藏時間不同時,濕面筋蛋白彈性模量和黏性模量與頻率之間的關系如圖3所示。在頻率為 0.1~100rad/s的范圍內進行掃描時,濕面筋蛋白的彈性模量和黏性模量均是逐漸增加的,并且后者較前者增加更顯著。其中G′始終大于G′′,因此面筋-水體系仍為黏彈性體系,這與先前報道的一致[21-22]。彈性模量和黏性模量均隨凍藏時間的延長而減小,而前者的減小幅度較大。這些變化可能是由于在低溫條件下,蛋白質構象發生改變或形成的冰晶對面筋網絡結構的破壞而引起的。考慮到小麥面筋中的麥谷蛋白主要提供彈性,而麥膠蛋白主要為面筋提供黏性[21,23],隨著凍藏時間的延長,G′變化較大,這也說明,在凍藏過程中,形成的冰晶可以更大程度上引起麥谷蛋白的斷裂,進而使得彈性模量變化較為顯著。
蠕變是指把一定大小的應力施加于黏彈性體時,物體形變(應變)隨時間延長而逐漸增加的現象。25℃時,空白面筋蛋白及添加ISP的濕面筋蛋白在不同凍藏時間時的蠕變特性見圖4。
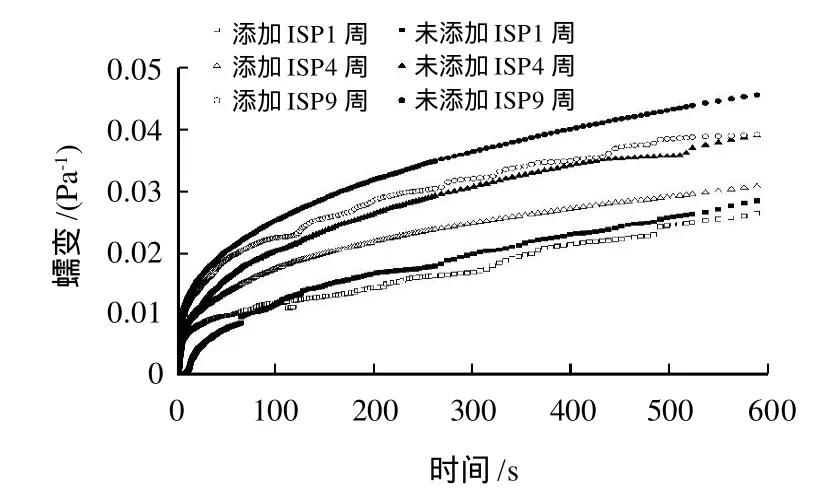
圖4 ISP對凍藏濕面筋蛋白蠕變的影響Fig.4 Effect of added ISP on creep curves of hydrated gluten frozen for different weeks
蠕變曲線分為3個主要的階段:1)瞬時彈性形變:在施加應力的-瞬間體系所發生的瞬時形變,在此階段,如果應力除去,體系的形變會立即恢復;2)延遲彈性形變:緊接著體系的彈性形變開始緩慢增加;3)平衡形變:此時體系的彈性和黏性達到平衡,形變速率恒定。蠕變實驗中,凍藏4周后面筋蛋白的形變明顯增加,這表明面筋網絡結構被破壞。當加入ISP時,面筋體系的形變量明顯減小,表明加入ISP有效的保護了賦予面筋彈性的組分,即麥谷蛋白。Singh等[24]提出麥谷蛋白大聚體之間的纏繞產生的阻力抵抗變形和減慢滑移速率,纏繞點的數目決定于蛋白大聚體的長度和相對分子質量大小。因凍藏過程中形成的大冰晶可以破壞面筋蛋白之間的纏繞點,進而使得面筋蛋白的抗變形能力變差,引入ISP后,因其可以吸附到冰晶表面,有效抑制冰晶的生長和重結晶,減少對面筋蛋白結構的破壞,可以提高其抗變形能力。
2.3 微觀結構研究
圖5分別是空白濕面筋蛋白和添加ISP的濕面筋蛋白凍藏1、4、9周后的掃描電鏡顯微照片,圖5A說明空白樣品凍藏1周,便有粒徑小的不規則空洞出現,說明此時已經有冰晶形成,隨著凍藏時間的延長,面筋網絡結構中的空洞逐漸變大,可以看到游離的淀粉顆粒存在。由圖5C可以看出空白樣品凍藏9周后,面筋網絡結構中的空洞較大,說明重結晶形成的大冰晶對網絡結構破壞程度較深。
圖5a為凍藏1周后含質量分數0.5% ISP的濕面筋蛋白,與空白濕蛋白面筋蛋白(圖5A)相比,網絡結構中雖然也有空洞出現,但空洞粒徑更小且均勻。凍藏4周后,即使加入ISP,面筋網絡結構中的空洞不可避免的變大,面筋網絡結構遭到破壞,但是遭受破壞的程度明顯小于未加ISP的(圖5b)。當凍藏時間延長到9周時,添加ISP在一定程度上降低了濕面筋網絡結構遭受破壞(圖5c)。這些結果說明引入ISP可以顯著抑制凍藏對濕面筋蛋白網絡結構的破壞。
冰晶形成以及重結晶效應所產生的大冰晶對面筋網絡產生機械損傷是面筋網絡在凍藏過程中受到破壞的最主要原因之一。因ISP可以抑制冰晶形成和重結晶,使得冷凍濕面筋蛋白網絡內部和外部的可凍結水能夠形成相對較小且均勻的冰晶,降低對濕面筋蛋白網絡結構的破壞程度,從而提高冷凍面制品的品質。

圖5 凍藏濕面筋蛋白SEM圖(×600)Fig.5 SEM photographs of hydrated gluten with and without added ISP after different weeks of frozen storage (×600)
3 結 論
本實驗研究了冰結構蛋白(ISP)對小麥濕面筋蛋白可凍結水含量、流變學性質和微觀結構的影響,得到以下主要結論:隨凍藏時間的延長,冰晶破壞了面筋網絡結構,可凍結水含量增加,ISP可減少冷凍濕面筋蛋白中可凍結水的含量,維持凍藏過程中面筋蛋白網絡結構的完整性;從流變學實驗中可以看出,小麥濕面筋蛋白的G′和G′′隨凍藏時間的延長而降低,在蠕變實驗中,小麥濕面筋蛋白的形變隨凍藏時間的延長而增加,添加ISP后可以顯著減小其形變;SEM實驗表明,空白樣品凍藏1周,便有粒徑小的不規則空洞出現,隨著凍藏時間的延長,面筋網絡結構中的空洞逐漸變大。添加ISP后可以抑制凍藏過程對濕面筋蛋白網絡結構的破壞。
綜上所述,冰結構蛋白對于提高濕面筋蛋白凍藏穩定性有很好的效果,本實驗為ISP作為一種新型的添加劑,在冷凍面團及冷凍面制品中的應用提供了基礎研究信息。
[1] DON C, LICHTENDONK W J, PLIJTER J J, et al. The effect of mixing on glutenin particle properties:aggregation factors that affect gluten function in dough[J]. Journal of Cereal Science, 2005, 41:69-83.
[2] DON C, LICHTENDONK W J, PLIJTER J J, et al. Understanding the link between GMP and dough:from glutenin particles in flour towards developed dough[J]. Journal of Cereal Science, 2003, 38:157-165.
[3] WEEGELS P L, HAMER R J. Functional properties of wheat glutenin[J]. Journal of Cereal Science, 1996, 23(1):1-18.
[4] OUTHAN M, MACRITCHIE F. Molecular weight distribution of wheat proteins[J]. Cereal Chemistry, 1999, 76:827-836.
[5] DON C, LICHTENDONK W, PLIJTER J J, et al. Glutenin macropolymer:a gel formed by glutenin particles[J]. Journal of Cereal Science, 2003, 37:1-7.
[6] TSIAMI A A, BOT A. Rheology of mixture of glutenin subfractions[J].Journal of Cereal Science, 1997, 26:l-9.
[7] LI W L, DOBRASZCZYK B J. Stress relaxation behavior of dough,gluten protein and gluten fractions[J]. Cereal Chemistry, 2003, 80:333-338.
[8] 黃衛寧, 鄒奇波, 賈春利. 一種提高發酵型冷凍面團中蛋白質抗凍性的方法:中國, 200610037644.3[P]. 2009-03-11.
[9] 黃衛寧. 冰結構蛋白:GB2760新成員[N]. 中國食品報, 2006-08-22.
[10] CREVEL R W R, FEDYK J K, SPURGEON M J. Antifreeze proteins:characteristics, occurrence and human exposure[J]. Food and Chemical Toxicology, 2002, 40:899-903.
[11] ATICI O, NALBANTOGLU B. Antifreeze proteins in higher plants[J].Phytochemistry, 2003, 64:1187-1196.
[12] GRIFFITH M, EWART K V. Antifreeze proteins and their potential use in frozen foods[J]. Biotechnology Advances, 1995, 13:375-402.
[13] 周美玲, 鄒奇波, 黃衛寧, 等. 冰結構蛋白影響冷凍面團及面包體系發酵烘焙與熱力學特性的研究[J]. 食品科學, 2008, 29(11):125-129.
[14] 潘振興, 鄒奇波, 黃衛寧, 等. 冰結構蛋白對長期凍藏冷凍面團抗凍發酵特性與超微結構的影響[J]. 食品科學, 2008, 29(8):39-42.
[15] AKON H, TOSHIR L. DSC investigation of the states of water in poly(vinyl2 alcohol) membranes[J]. Polymer, 1985, 26(8):1207-1211.
[16] LAAKSONEN T J, ROOS Y H. Thermal, dynamic-mechanical, and dielectric analysis of phase and state transitions of frozen wheat doughs[J]. Journal of Cereal Science, 2000, 32:281-292.
[17] PABLO D, ALBERTO E, MARIA C A. Effect of freezing and frozen storage on the gelatinization and retrogradation of amylopectin in dough baked in a differential scanning calorimeter[J]. Food Research International,2003, 36:357-363.
[18] 宋國勝, 胡松青, 李琳, 等. 冷凍環境對濕面筋蛋白中可凍結水的影響[J]. 華南理工大學學報:自然科學版, 2009, 37(4):120-124.
[19] KONTOGIORGOS V, GOFF H D. Effect of aging and ice structuring proteins on the morphology of frozen hydrated gluten networks[J].Biomacromolecules, 2007, 8:1293-1299.
[20] AUTIO K, SINDA E. Frozen doughs:rheological changes and yeast viability[J]. Cereal Chemistry, 1992, 69:409- 413.
[21] KHATKAR B S, BELL A E, SCHOFIELD J D. The dynamic rheological properties of gluten and gluten sub-fractions from wheats of good and poor bread making quality[J]. Journal of Cereal Science, 1995, 22:29-44.
[22] HAYTA M, SCHOFIELD D. Dynamic rheological behavior of wheat glutens during heating[J]. Journal of the Science of Food and Agriculture,2005, 85:1992-1998.
[23] KOKINI J L, COCERO A M, MADEKA H, et al. The development of state diagrams for cereal proteins[J]. Trends in Food Science and Technology, 1994, 5:281-288.
[24] SINGH H, MACRITCHE F. Application of polymer science to protein of gluten[J]. Journal of Cereal Science, 200l, 33:23l-243.
Effect of Ice-structuring Protein on the Stability of Frozen Hydrated Gluten
LI Ling-ling1,JIA Chun-li1,HUANG Wei-ning1,*,KIM Yangsoo1,RAYAS-DUARTE Patricia2
(1. State Key Laboratory of Food Science and Technology, College of Food Science and Technology, Jiangnan University, Wuxi 214122, China;2. Food and Agricultural Products Research Center, Oklahoma State University, Stillwater OK 74078-6055, USA)
2009-12-15
國家自然科學基金項目(31071595);美國農業部國際交流與合作項目[A-(86269)];加拿大農業部國際交流與合作項目(CCSIC-Food-00107);國家現代農業(燕麥)產業技術體系建設專項目(nycytz-14)
李玲玲(1983—),女,碩士研究生,研究方向為谷物與烘焙科學、功能配料與食品添加劑。E-mail:lilingling1216@163.com
*通信作者:黃衛寧(1963—),男,教授,博士,研究方向為烘焙與發酵技術、谷物食品化學。E-mail:wnhuang@jiangnan.edu.cn

