染料木黃酮生物活性及抗病機理的研究進展
曲妍妍,張永忠,2,*
(1.東北農業大學理學院應用化學系,黑龍江哈爾濱150030; 2.教育部大豆生物學重點實驗室,黑龍江哈爾濱150030)
染料木黃酮生物活性及抗病機理的研究進展
曲妍妍1,張永忠1,2,*
(1.東北農業大學理學院應用化學系,黑龍江哈爾濱150030; 2.教育部大豆生物學重點實驗室,黑龍江哈爾濱150030)
染料木黃酮是苷元形式的大豆異黃酮,具有多種生物學活性。動物實驗、臨床研究及流行病學調查表明,染料木黃酮對白血病、病毒感染、腫瘤等具有防治作用,并具有防輻射及預防骨質疏松的功能。它的抑制細胞免疫和體液免疫以及調節細胞凋亡等作用也日益受到重視。本文簡述了染料木黃酮的生物活性及抗白血病、抗病毒感染、抗腫瘤、抗輻射及預防骨質疏松的機理。
染料木黃酮,白血病,病毒感染,抗腫瘤,抗輻射,骨質疏松
大豆異黃酮是大豆生長過程中形成的一類次生代謝產物。大豆中天然存在的異黃酮共有12種,可以分為3類,即黃豆苷類(Daidzin groups)、染料木苷類(Genistingroups)、黃豆黃素苷類 (Glycitin groups),每類以游離型(苷元)、葡萄糖苷型、乙酰基葡萄糖苷型、丙二酰基葡萄糖苷型等4種形式存在[1]。目前國內在大豆異黃酮研究中所用名詞術語比較混亂,不夠規范和嚴肅。表現為一個英文名詞(如genistein)被譯成多個中文名詞,而有時又將兩個英文名詞譯成同一個中文名詞。本論文關于大豆異黃酮的名詞術語依據于文獻[2],如將genistein譯成染料木黃酮[2]。這是因為genistein是大豆異黃酮苷元,從化學結構上看是黃酮類化合物,化學名稱為5,7,4'-三羥基異黃酮。因最初發現存在于染料木屬(Genista)植物中,所以最初譯成染料木因(科學出版社1961年出版的《英漢化學化工詞匯》)或染料木素。金雀花屬(Cytisus scoparius)植物中也發現了genistein,所以有人將genistein譯成了金雀異黃素。科學出版社2000年出版的《英漢化學化工詞匯》(第4版)以全國科學技術名詞審定委員會已公布的化學化工標準名詞為依據,將genistein校譯成染料木黃酮。各種大豆中異黃酮總含量約為1200~4216μg/g,以異黃酮葡萄糖苷和丙二酰基異黃酮葡萄糖苷為主要形式,共占異黃酮總量的95%~98%,而游離型異黃酮(苷元)的含量很低。染料木黃酮是一種主要存在于豆科植物中生物合成的抗微生物毒素的前體,是大豆異黃酮復合物中最簡單的一種,但染料木黃酮是12種大豆異黃酮中的一種主要活性因子,是大豆異黃酮產品中最有效的功能成分,具有多種生理功能。它是一種有效的抗氧化劑,一種有效的蛋白酪氨酸激活酶抑制劑,一種植物雌激素。國外在研究大豆異黃酮的生理活性時,應用的原料不是大豆異黃酮粉(染料木黃酮含量極少的一種混合物),而是采用具有明確化學結構的染料木黃酮。染料木黃酮在動物細胞中具有廣泛藥理學功效,它的多種生物活性已在過去10年中被3600余篇文獻所報道,大多數的研究都集中在染料木黃酮作為一種酪氨酸蛋白激酶(TPK)抑制劑的藥理學活性上,包括化學防癌、預防白血病的活性,以及抗輻射和抗病毒感染的活性。通過流行病學和動物模型研究發現,膳食中攝入的染料木黃酮具有許多對人體健康有益作用的生物活性成分,可以預防甚至治療許多疾病,包括乳腺癌、前列腺癌、白血病和病毒感染等[3]。本文對有關染料木黃酮的生物活性進行綜述,并簡述染料木黃酮治療各種疾病的作用機制。
1 染料木黃酮的化學結構、抗氧化活性及其代謝產物
任何物質的宏觀性質主要是由其內在的結構決定的。同樣,染料木黃酮和黃豆苷元之所以被稱為植物雌激素,是因為其結構與哺乳動物內源雌激素——雌二醇結構相似,具有活性基團——二酚羥基,其中7,4'兩個羥基間的距離幾乎等于17β-雌二醇上3,17位羥基間的距離。正是由于這種特殊的結構,能夠與雌激素靶細胞結合而呈現出一定的雌激素功能。染料木黃酮和17β-雌二醇化學結構如下:
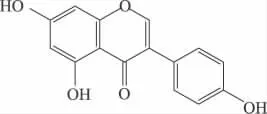
圖1 染料木黃酮(genistein)
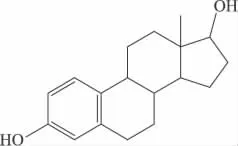
圖2 17 β-雌二醇(Estradiol)
Lamartiniere C A報道,與17 β-雌二醇相比,異黃酮類化合物的雙環結構及每個芳環上至少有一個羥基,這對于發揮活性是必不可少的,尤其是4'-OH直接與受體結合,結構特異性高,決定著與雌激素受體親和力的大小[4]。Song TT等人以大鼠子宮增重法(uterine weight method)對雌性B6D2F老鼠進行實驗,發現已烯雌酚、黃豆黃素、染料木黃酮和黃豆苷元的相對雌激素作用強度為105、3、1和0.26。17β-雌二醇,乙烯雌酚,染料木黃酮、黃豆苷元和大豆黃素對子宮雌激素受體的相對結合強度為100%、95%、0.49%、0.027%和0.028%[5]。由此可以發現在植物雌激素中,羥基的位置與個數決定了其活性的高低。Adams NR也指出植物雌激素必須具有能夠與此激素受體相結合的結構,而雙羥基結構正是與雌激素受體結合的主要部位,對于其發揮雌激素作用是非常重要的[6]。
不同結構的異黃酮抗氧化能力也是有差異的[7-8]。Corinna E.R等人對染料木黃酮、黃豆苷元、雞豆黃素和芒柄花黃素及其代謝產物體外抗氧化研究發現,染料木黃酮的抗氧化能力最強,而芒柄花黃素最低。并總結分析得出,染料木黃酮的活性之所以比黃豆黃素和櫻黃素(prunetin)高是由于它的A環上有5,7-兩個羥基,黃豆苷元少一個5位羥基,櫻黃素的7位是甲氧基。染料木黃酮和大豆黃素(daidzein)代謝產物在A環或B環有雙羥基結構,且抗氧化能力均比原物質高,因此可以確定這種特殊結構可以增強物質的抗氧化能力。通過比較大豆黃素和6-OH大豆黃素,染料木黃酮和雞豆黃素,芒柄花黃素和黃豆苷元,櫻黃素和染料木黃酮的抗氧化能力,發現前者的能力均高于后者,因此可以確定是由于它們分別由一個相應碳原子上的羥基被甲氧基取代所造成的。由于雞豆黃素比芒柄花黃素多一個5-OH,所以雞豆黃素比芒柄花黃素的抗氧化能力略高[9]。
大豆異黃酮多以其各種葡萄糖苷的形式存在,這些葡萄糖苷只有在體內經水解作用形成苷元的形式,才具有較強的生理作用。Toru Izumi等[10]研究表明:在人體中,大豆異黃酮苷元的吸收速度與吸收量都比其糖苷形式大得多。大豆異黃酮的苷元包括染料木黃酮(genistein)、黃豆苷元(daidzein)和黃豆黃素(glycitein,主要存在于大豆胚芽中),其中染料木黃酮的活性最高。在未加工的植物體中,異黃酮主要以糖苷形式存在,被人和動物攝入體內后,在腸道細菌、微生物的β-2-葡萄糖苷酶或β-2-半乳糖苷酶的作用下,轉化為具有生物活性的苷元,即轉變成游離形式。這些分解產物一部分進入腸壁組織,另一部分尚未分解的異黃酮苷隨糞便一起排出。被吸收的異黃酮通過血管被運送到肝臟中,并且在肝臟中迅速合成,合成的主要是葡萄糖醛酸。在腸道不含上述細菌的動物體內,其血液和膽汁中均不存在大豆異黃酮。因此,如果使用抗生素,則會使身體中的異黃酮含量缺乏。例如:染料木黃酮的代謝半衰期是8.4 h,因此,每天食用2~3次,能使異黃酮的血液濃度維持穩定。
膳食大豆異黃酮的主要來源是大豆產品。1g大豆粉含近800μg大豆黃素和超過500μg的染料木黃酮(主要是糖苷類);1g大豆蛋白含近150μg的大豆黃素和250μg的染料木黃酮。精制的大豆產品,如枸櫞酸鉍和醬油所含染料木黃酮的水平比豆腐的含量低,豆腐是亞洲膳食中大豆異黃酮的主要來源。大豆異黃酮的攝入水平可以通過尿液排泄物來測定,那些常吃富含大豆食品的成年人,他們的尿酚含量比那些很少吃大豆產品的多近100倍[11]。
2 染料木黃酮的抗白血病活性[12]
Raynal等研究發現,染料木黃酮能夠抑制人類和鼠類白血病細胞株生長。他們采用的是克隆原分析法,這是一種最主要的評估體外抗腫瘤制劑活性的方法。染料木黃酮降低白血病細胞株的集落生成能力在評估其抗腫瘤活性方面是非常重要的。
該研究還發現,染料木黃酮誘導了骨髓和淋巴白血病細胞株對時間和劑量依從性效應。在1~20μmol·L-1時不生成白血病細胞集落,這個濃度在富含大豆的飲食所提供的染料木黃酮血漿濃度范圍內。有趣的是,低濃度(2μmol·L-1)染料木黃酮處理24h后也能引起集落生成率降低10%。已有報道說染料木黃酮對腫瘤細胞來說是細胞毒性制劑而對正常細胞則不是。另外,染料木黃酮對病人沒有遺傳毒性。
他們還發現染料木黃酮對腫瘤抑制基因的復活作用,該基因被白血病細胞株中的啟動子超甲基化作用所抑制。染料木黃酮(1~20μmol·L-1)誘導了沉寂的腫瘤抑制基因(人細胞中p57KIP2和鼠細胞中p15CDKN2B)的再表達。在經染料木黃酮處理后,這些基因的可變cDNA的擴增可能是由異黃酮在不同靶物質上的多效性作用引起的。染料木黃酮作用于食管鱗狀細胞癌細胞,使幾個腫瘤抑制基因重新表達,這些基因之前均被變體DNA甲基化所抑制。染料木黃酮對腫瘤抑制基因的復活和脫甲基作用說明了這些制劑的部分抗白血病活性與它后生的作用有關。它對靶物質的作用,就像抑制酪氨酸激酶的活性,可能也對其抗白血病功效有貢獻。例如,酪氨酸激酶抑制劑有抗腫瘤活性并被臨床驗證。
3 染料木黃酮抑制沙粒病毒感染[13]
沙粒病毒屬有包膜病毒家族,能夠引起人類出血熱綜合癥。染料木黃酮是一種酪氨酸激酶抑制劑,能夠抑制一些病毒,例如猿猴病毒40(SV40)的侵染[14-16]。在細胞被病毒感染前用染料木黃酮處理1h后,觀察到PICV(伯欽特沙粒病毒)核酸及其糖蛋白表達量相對于未處理細胞是減少的,這也許會對病毒感染起到抑制作用或者減少病毒的復制。染料木黃酮處理細胞不能改變Vero細胞的TfR(鐵傳遞蛋白受體)的水平。噬菌斑測定分析顯示,用染料木黃酮處理過的PICV感染的Vero細胞中的病毒濃度比未處理的或用DMSO處理的降低90%。辛德比斯病毒的濃度并不受染料木黃酮處理的影響[17]。此外,用臺盼藍染色法未觀察到用100μmol·L-1染料木黃酮處理的Vero細胞具有毒性。
接下來研究了在Vero細胞受感染后注入染料木黃酮是否有抑制感染的作用。觀察到當細胞剛開始受到藥物處理與感染后接受藥物處理比較,病毒濃度就下降了66.5%,當細胞受感染前用染料木黃酮處理30min后病毒濃度下降了56.9%,當細胞受感染前用染料木黃酮處理8h后病毒濃度下降了33.6%,當感染48h后在培養基中加入染料木黃酮時,病毒產率下降了73%。這些數據表明在被病毒感染后用染料木黃酮處理細胞可以抑制病毒的侵入。總而言之,不管是之前或之后用染料木黃酮處理細胞均可以減少PICV病毒感染的發生。
為了進一步證明染料木黃酮的處理對PICV感染的細胞的影響,研究了染料木黃酮對兩種轉錄因子的影響,其中一個牽涉到PICV的感染過程,另一個作用于整體的酪氨酸使其磷酸化。分析受感染的Vero細胞全細胞提取物,染料木黃酮處理過的受感染細胞和未處理過的受感染細胞相比,磷酸酪氨酸的總體水平也減少了。有趣的是,磷酸化的細胞外信號調節激酶(p42和p44MAPK)沒有被染料木黃酮處理所抑制;相反還出現了增長的現象。
為了證明染料木黃酮是否抑制了LASV(Old World沙粒病毒)的侵入,利用了復制缺陷型LASVMLV逆轉錄病毒的假模標本系統。標記基因在假模標本轉導的Vero細胞中的表達受到染料木黃酮劑量不同的抑制。然而,LASV-MLV的轉導卻不因0.1% DMSO(染料木黃酮的載體)的處理而受到影響,這說明抑制作用是由藥物引起的而不是載體。總之,以上結果顯示LASV的侵入需要酪氨酸激酶活性。
PICV侵染培養的細胞誘導ATF-2磷酸化作用對染料木黃酮是敏感的。PICV在CREB(cAMP效應元件連接)過程中的侵染結果為轉錄因子CREB在DNA上與cAMP反應元件結合。這一蛋白存在于由PICV侵染誘導的細胞信號網絡中[18]。染料木黃酮處理后絲氨酸磷酸化作用的減弱可能與上游活性物質減少或染料木黃酮介導的上游信號媒介物質的酪氨酸磷酸化作用受到抑制有關。ERK(細胞外信號調節激酶)1處理和ERK2磷酸化用是隨著染料木黃酮的處理而增強的,而侵染是其它染料木黃酮介導的激活ERK路徑效應的結果。然而,ERK磷酸化作用的增強證明了由染料木黃酮介導的激酶抑制作用有相當大的特異性。
4 染料木黃酮的抗腫瘤作用[19-20]
對癌細胞周期進展的控制是控制腫瘤生長的有效策略,就像對人類癌細胞的分子分析揭示了細胞周期調節器在多數正常的惡性腫瘤中是非常容易發生突變的。體外研究結果顯示了用染料木黃酮處理雄激素敏感的(LNCaP)細胞可以讓其在細胞周期的G1期停止,這說明染料木黃酮可能抑制細胞周期循環。在染料木黃酮處理后的LNCaP細胞中未找到任何顯著的編程性細胞死亡誘導作用。染料木黃酮處理后細胞周期調節蛋白表達量的減少預示著這些細胞失控的細胞周期被破壞。染料木黃酮誘導的G1期停止是通過p21/CIP1表達的上調介導的,已報道染料木黃酮能使鼠的成纖維細胞、黑色素瘤細胞[21]、前列腺癌(LNCaP)細胞[22]在細胞周期的G0-G1停止。
用染料木黃酮處理雄激素不敏感(DuPro)細胞導致G2-M期細胞周期停止,并且在染料木黃酮濃度為25μmol·L-1時凋亡細胞數量顯著增加。染料木黃酮能夠誘導乳腺細胞、胃細胞、人類黑素瘤細胞[23]、PC3前列腺癌細胞和肺癌細胞在細胞周期的G2-M期停止。染料木黃酮處理雄性激素不敏感的PC3細胞使其在G2-M期停止并改變了兩種細胞周期調節蛋白的表達,即細胞周期調節蛋白B1表達量的顯著減少伴隨著p21WAF1表達量的增加。細胞周期調節蛋白B1/CDK1復合物對細胞有絲分裂是必需的,所以,B1表達量的減少能夠導致G2-M期的停止。
染料木黃酮能夠上調某些基因mRNA的表達,例如,乳腺癌中的BRCA1基因,食管鱗狀上皮細胞癌中的p16INK4a、RARb和MGMT28。劑量式染料木黃酮處理能夠增加前列腺癌細胞株中腫瘤抑制基因p16和p21的mRNA和蛋白質的表達。在分析p16和p21啟動子的CpG島甲基化狀態后,研究了這一通過后生途徑的誘導機制。DNA甲基化分析發現兩種細胞株中未經過任何染料木黃酮處理時,p21啟動子也出現了缺失。然而,p16在染料木黃酮處理后,在DuPro細胞中完全甲基化。p21WAF1啟動子在多數人類癌細胞中均未被甲基化[24]。在人類肺癌細胞、結腸癌細胞和用deacitabine處理后的急性髓細胞樣白血病細胞株中均發現了未甲基化的 p21 WAF1啟動子誘導的p21WAF1的表達[25-26]。此外,Shin22報道了p21基因在胃癌細胞中未被甲基化,這證實了甲基化不是其鈍化的機制。已發現p16基因啟動子在LNCaP細胞中未被甲基化而在DuPro細胞中完全甲基化。p21(LNCaP和 DuPro)和 p16 (LNCaP)CpG島甲基化的缺失說明甲基化不是這些細胞株中染料木黃酮誘導表達的機制。芯片分析染色質重塑途徑為前列腺癌中染料木黃酮的作用機制。劑量式染料木黃酮處理LNCaP、DuPro和RWPE細胞導致其轉錄起始位點組蛋白 H3、H4和H3dimethK4乙酰化的增加。在任何細胞株中均未發現p16和p21啟動子組蛋白修飾的抑制。誘導p16和p21基因表達的是活性染色質修飾的強化而不是抑制組蛋白修飾的缺失。
為了進一步證明芯片數據的結果,用熒光定量PCR檢測了HAT、p300、CREBBP、PCAF和HAT1的表達。結果證明了染料木黃酮對所有的HAT的表達有上調作用,這樣也許能促進催化轉錄激活作用的組蛋白的乙酰化。據此觀點,組蛋白超乙酰化和超乙酰化在致癌作用中似乎都是重要的,組蛋白超乙酰化能夠誘導基因表達也許是高纖維飲食具有抗癌作用的機理。核小體組蛋白乙酰化的穩定狀態已經由HAT和HDAC競爭的動態平衡建立了。大體來說,組蛋白賴氨酸殘基的超乙酰化能促進轉錄激活作用,而脫乙酰基作用則使轉錄沉沒[27-28]。近期的研究發現,許多轉錄激活因子有HAT活性,這支持了組蛋白乙酰化與轉錄激活作用有關這一觀點。
舉例來說,染料木黃酮能夠抑制人類前列腺癌細胞運動性。Endoglin是一種重要的前列腺癌細胞運動性抑制基因,在前列腺癌發病時其表達是缺失的。因此確定endoglin的缺失是否對染料木黃酮的功效有影響是很重要的,Clarissa S.Craft首次發現了染料木黃酮通過激活endoglin伴隨信號途徑補償了endoglin缺陷。實際上,endoglin激活了Smad1轉錄子的活性。這依次表現出需要ALK2,即激酶感受態ALK2。同時也發現endoglin抑制前列腺癌細胞活力通過一種機制,其包含類型 I TGFβ超家族受體ALK2和Smad1[29]。因此,目前鑒定ALK2-Smad1依賴性激活作用是正確的,該活性屬于Smad1轉錄子活性,是通過染料木黃酮補償的缺陷型endoglin結合的機制。除此之外,染料木黃酮在某些途徑上的作用具有一定的特異性。特別是,染料木黃酮降低的是前列腺癌細胞的侵入而不是細胞的生存能力[30]。雖然人為改變endoglin表達能夠影響細胞活力,但卻不能影響其繁殖能力。最后,目前的研究表明,細胞繁殖能力受到密切關注,與其它相關條件相比,繁殖能力在實驗條件下不會變化。概括來說,染料木黃酮能夠誘導低endoglin前列腺癌細胞變異成低活力的高endoglin表型。這是由于染料木黃酮介導的Smad1激活作用,該作用依靠了具有激酶活性的ALK2。因為endoglin在前列腺癌發病過程中是缺失的,貢獻給它的遷移表型,當前的研究支持一種觀點,即擁有低endoglin前列腺癌細胞表達的個體可能從染料木黃酮治療上獲得更大的益處。這些發現有助于解釋正在進行中的第二階段的染料木黃酮在前列腺癌和其它癌癥中的分子功效的研究。
5 染料木黃酮抗輻射損傷的作用
實驗結果表明,染料木黃酮對UV所致損傷有防護作用。Moore[31]等研究了染料木黃酮對急性UVB照射所致人造皮膚損傷的防護作用。在照射前1h,分別給予人造皮膚10、20、50mmol·L-3染料木黃酮處理,然后分別給予20MJ·cm-2或60MJ·cm-2的照射,免疫組織化學分析法檢測照射后6h和12h皮膚內增殖細胞核抗原和嘧啶二聚體的含量。結果顯示,與空白對照組相比較,無論是給予20MJ·cm-2還是60MJ·cm-2劑量的照射,染料木黃酮處理組的嘧啶二聚體含量比對照組都明顯降低,并且隨著濃度的增加,嘧啶二聚體的含量降低越多;而增殖細胞核抗原的數量則隨著染料木黃酮濃度的增加而增加,在空白對照組只觀察到極少的增殖細胞核抗原。提示染料木黃酮可以減輕輻射所致的DNA損傷,促進受損細胞的增殖修復。
8-羥基脫氧鳥嘌呤(8-OH-dG)是鳥嘌呤的氧化產物,可導致DNA難以修復的GC和TA易位,是輻射誘導癌變和突變的重要基礎。研究表明,UVB照射可使裸鼠皮膚和內臟的 H2O2、脂質過氧化物(MDA)和8-OH-dG的水平較未照射組升高了2~3倍,給予100mmol·L-1的染料木黃酮溶液(乙醇與丙烯乙二醇混合的體積分數為1∶1)涂抹,可降低H2O2和8-OH-dG的含量約50%,降低MDA的含量30%~50%[32]。Kruk等[33]的實驗也觀察到培養液中加入0.5mmol·L-1的染料木黃酮可有效地抑制羥自由基所致的脫氧核糖的降解,與對照組相比,可減少20%~60%的脫氧核糖降解。環氧化酶-2 (cyclooxygenase,Cox-2)是炎癥過程中前列腺素(PG)合成的限速酶,是“快速反應基因”的表達產物,在細胞受到刺激后大量表達。近年來大量研究表明,Cox-2的表達與腫瘤的發生發展密切相關,一些抑制Cox-2表達的藥物可以預防腫瘤的發生。染料木黃酮可以下調受照細胞Cox-2的mRNA異常表達,體外培養角質生成細胞的Cox-2的表達量在受照后較對照組升高3.3倍,加入染料木黃酮共培養后,其表達明顯降低,僅為對照組的2.4倍。Wei等[34]的研究表明,染料木黃酮可以有效地阻止人體和裸鼠皮膚因UV損傷而誘發的光損傷和分子變異,對UV照射小鼠引起的皮膚癌和皮膚老化有直接的抑制作用,尤其在慢性實驗中(每周2次,每次0.3kJ·m-2),局部應用染料木黃酮涂抹可以降低光致腫瘤的發生率近90%。
染料木黃酮還可以明顯抑制UV照射誘發的皮膚炎癥反應。小鼠涂抹20mmol·L-1的染料木黃酮,可降低其受照射后的皮膚炎癥反應強度和減弱輻射引起的遲發型超敏反應(CHS)抑制,小鼠受照射后48h,染料木黃酮組的背脊中央皮褶厚度增加0.071~0.126mm,而對照組則平均增加了0.91mm;對照組CHS反應降低64%,染料木黃酮組僅降低了13%。染料木黃酮對UV和其他因素協同誘導的損傷也具有防護作用。臨床上常用補骨脂素加UVA(PUVA)治療白癜風等皮膚病,長期使用則會增加患鱗狀細胞癌及惡性黑色素瘤的風險。Shyong[35]觀察發現,染料木黃酮可顯著降低PUVA誘發的小鼠炎癥反應,減少皮膚紅斑面積和潰瘍的形成;組織學檢查顯示,局部涂抹染料木黃酮可使照后72h增殖細胞核抗原的數量由空白對照組的29%回升到40.7%,基本達到正常組的水平,同時還可完全抑制PUVA引起的細胞內多ADP聚合酶(PARP)降解產物及半胱天冬酶(caspase-3)活性的升高。
6 染料木黃酮對骨質疏松的預防作用
雌激素是女性的重要生殖激素,絕經期或絕經期后婦女體內雌激素水平降低,對成骨細胞的刺激減弱,使骨形成和骨吸收的平衡失調,骨吸收大于骨平衡,骨質逐漸丟失,骨密度減小,這是老年婦女易發生骨質疏松的重要病因。婦女絕經后適當補充雌激素,可預防骨質疏松的發生。大豆異黃酮是一類典型的植物雌激素,主要存在于大豆及其制品中。有報道證實亞洲骨質疏松相關骨病的發病率低于大多數西方人群,許多學者認為這與亞洲人群攝入豆制品多于西方有關[36-37]。
關于GEN對于成骨細胞的作用機制目前有多種解釋,其中比較公認的說法是類雌激素作用。因為GEN的結構與雌激素非常相似,可以與成骨細胞上雌激素受體結合而發揮功效,雌激素是影響骨代謝的重要物質,對成骨細胞增殖、編碼骨基質蛋白、激素受體、轉錄因子基因的表達基細胞因子等有直接作用。
ALP是成骨細胞主要功能活性酶,富含于胞漿中,在分化早期,ALP的活性反映了成骨細胞的成骨活性,ALP可水解有機磷酸釋放出無機磷,相對增加局部無機磷濃度,用于羥磷灰石的形成,促進礦化過程,是骨形成的特異性酶。成骨細胞加藥培養72h后測定其胞漿內的ALP活性,與對照組比較,各劑量組GEN都可增高成骨細胞的ALP活性,結果具有統計學意義(P<0.05)。同時隨著GEN濃度的升高,ALP的數值也越高,具有一定的相關趨勢(P<0.05)。說明10-8mol·L-1至10-5mol·L-1濃度的GEN可促進成骨細胞分化,并與GEN劑量相關。
[1]井樂剛,張永忠.微生物發酵制備大豆異黃酮的研究進展[J].微生物學通報,2003,30(2):86-88.
[2]張永忠,孫艷梅.大豆異黃酮研究中的名詞術語[J].中國糧油學報,2004(4):46-52.
[3]Armin Littermann,Jujia Geppert,et al.Short term effect of high soy supplementation on sex hermones,bone markers and lipid parameters in young females adults[J].Eur J Nutr,2004,43:100-108.
[4]Lamartiniere C A,Moore J,Holland M,et al.Neonatal Genistein Chemoprevents Mammary Cancer[J].Proc Soc Exp Biol Med,1995,208(1):120-123.
[5]Song TT,Hendrich S,Murphy PA.Estrogenic Activity of Glycitein,a Soy Isoflavone[J].J Agric Food Chem,1999,47,1607-1610.
[6]Adams NR.Detection of the Effedts of Phytoestrogens on Sheep and Cattle[J].J Anim Sci,1995,73:1509-1515.
[7]陳學穎,張永忠.紅三葉草異黃酮及其代謝研究進展[J].中草藥,2007,38(11):1741-1744.
[8]張永忠,陳學穎,孫艷梅.四種異黃酮抗氧化活性的比較研究[J].食品科學,2008,29(2):383-386.
[9]Corinna ER,Sabine EK.Antioxidant Activity of Isoflavones and their Major Metabolites Using Different in Vitro Assays[J].J Agric Food Chem,2006,54:2926-2931.
[10]Schreiber M D,Liu J H,Subbiah M T,et al.Dietary inclusion of whole soy foods result s in significant reductions in clinical risk factors for osteoporosis and ardiovascular disease in normal postmenopausal women[J].Menopause,2001(8): 384-392.
[11]H P L EE,L Gourl EY,S W Duefy,et al.Dietary effect son breast cancer risk in Singapore[J].Lancet,1991,337:1197-1200.
[12]Noёl J-M Raynal,Louise Momparler.Antileukemic Activity of Genistein,a Major Isoflavone Present in Soy Products[J].J Nat Prod,2008,71:3-7.
[13]Eric M Vela,Gavin C,Bowick.Genistein treatment of cells inhibits arenavirus infection[J].Antiviral Research,2008,77: 153-156.
[14]Akiyama T,Ishida J,Nakagawa S,et al.Genistein,a specific inhibitor of tyrosinespecific protein kinases[J].J Biol Chem,1987,262:5592-5595.
[15]Damm E,Pelkmans L,Kartenbeck J,et al.Clathrin-and caveolin-1-independent endocytosis:entry of simain virus 40 into cells devoid of caveolae[J].J Cell Biol,2005,168:477-488.
[16] PelkmansL,PuntenerD,HeleniusA.Localactin polymerization and dynamin recruitment in SV40-induced internalization of caveolae[J].Science,2002,296:535-539.
[17]Lecot S,Belouzard S,Dubuisson J,et al.Bovine viral diarrhea virus entry is dependenton clathrin-mediated endocytosis[J].J Virol,2005,79:10826-10829.
[18]Bowick G,Fennewald S,Elsom B,et al.Differential signaling networks induced by mild and lethal hemorrhagic fever virus infections[J].J Virol,2006,80:10248-10252.
[19]Shahana Majid,Nobuyuki Kikuno.Genistein Induces the p21WAF1/CIP1 and p16INK4a Tumor Suppressor Genes in Prostate Cancer Cells by Epigenetic Mechanisms Involving Active Chromatin Modification[J].Cancer Res,2008,68:(8):2736-2744.
[20]Clarissa S.Craft,Li Xu,Diana Romero.Genistein Induces Phenotypic Reversion of Endoglin Deficiency in Human Prostate Cancer Cells[J].Molecular Pharmacology,2008,73:235-242.
[21]Kuzumaki T,Kobayashi T,Ishikawa K.Genistein induces p21(Cip1/WAF1)expression and blocks the G1 to S phase transition in mouse fibroblast and melanoma cells[J].Biochem Biophys Res Commun,1998,251:291-295.
[22]Shen JC,Klein RD,Wei Q,et al.Low dose gensitein induces cyclin dependent kinase inhibitors and G1 cell cycle arrest in human prostate cancer cells[J].Mol Carcinog,2000,29:92-102.
[23]Casagrande F,Darbon JM.p21CIP1 is dispensable for the G2arrest caused by genistein in human melanoma cells[J].Exp Cell Res,2000,258:101-108.
[24]Ying J,Srivastava G,Gao Z,et al.Promoter hypermethylation of the cyclin-dependentkinase inhibitor(CDKI)gene p21WAF1/CIP1/SDI1 is rare in various lymphomas and carcinomas[J].Blood,2004,103:743-746.
[25]Zhu WG,Srinivasan K,Dai Z,et al.Methylation of adjacent CpG sites affects Sp1/Sp3 binding and activity in the p21(Cip) promoter[J].Mol Cell Biol,2003,23:4056-4065.
[26]Schmelz K,Wagner M,Dorken B,Tamm I.5-aza-2-deoxycitidine induces p21(WAF)expression by demethylation of p73 leading to p53-independent apoptosis in myeloid leukemia[J].Int J Cancer,2005,114:683-695.
[27]Grozinger CM,Schreiber SL.Deacetylase enzymes:biological functions and the use of small molecule inhibitors[J].Chem Biol,2002,9:3-16.
[28] KristeleitR,StimsonL,WorkmanP,etal.Histone modification enzymes:novel targets for cancer drugs[J].Expert Opin Emerg Drugs,2004,9(1):135-154.
[29]Craft CS,Romero D,Vary CPH,et al.Endoglin inhibits prostate cancer motility via activation of the ALK2-Smad1 pathway[J].Oncogene,2007,26:7240-7250.
[30]Huang X,Chen S,Xu L,et al.Genistein inhibits p38MAP kinaseactivation,MMP-2 and cell in vasion in human prostate epithelial cells[J].Cancer Res,2005,65:3470-3478.
[31]Moore JO,Wang Y,Stebbins WG,et al.Photoprotective effect of isoflavone genistein on ultraviolet B induced pyrimidine dimer formation and PCNA expression in human reconstituted skin and its implications in dermatology and prevention of cutaneous carcinogenesis[J].Carcinogenesis,2006,27(6):367.
[32]Wei H,Zhang X,Wang Y,et al.Inhibition of UV lightinduced oxidative events in the skin and internal organs of hairless mice by isoflavone Genistein[J].Cancer Lett,2002,185(1):21.
[33]Kruk I,Aboul-Enein HY,Michalska T,et al.Scavenging of reactive oxygen species by the plant phenols genistein and oleuropein[J].The JournalofBiologicaland Chemical Luminescence,2005,20(2):81.
[34]Wei HC,Saladi R,Lu YH,et al.Isoflavone genistein: photoprotection and clinical implications in dermatology[J].Nutr,2003,133(11):3811.
[35]Shyong EQ,Lu Y,Lazinsky A,et al.Effects of the isoflavone 4,5,7-trihydroxy-isoflavone(Genistein)on peoralen plus ultraviolet A radiateon(PUVA)-induced photodramage[J]. Carcinogenesis,2002,23(2):317.
[36]Ikeda Y,Iki M,Morita A,et al.Intake of fermented soybeans natto is associated with reduced bone loss in postmenopausal women Japanese population-based osteoporosis study(JPOS)[J].J Nutr,2006,136:1323-1328.
[37]常紅,黃國偉.染料木黃酮對成骨細胞I型膠原表達及轉化生長因子 β1的影響[J].營養學報,2008,30(2): 194-198.
Research progress on biological activity and prevention disease mechanism of genistein
QU Yan-yan1,ZHANG Yong-zhong1,2,*
(1.College of Science,Northeast Agricultural University,Haerbin 150030,China; 2.Key Laboratory of Soy biological of Ministry of Education,Haerbin,150030,China)
Genistein is an isoflavone in the aglucone form.It has varieties of biological activity.The animal experiments,clinical researches and epidemiological investigations indicated that genistein has the effect for prevention and treatment of leukemia,viral infection,tumor,radiation protection and bone rarefaction precaution. Genistein is able to inhibit cellular and humoral immunity and regulate cell apoptosis.The biological activity of genistein and the mechanism of leukemia,viral infection,tumor and radiation prevention were reported.
genistein;leukemia;viral infection;tumor prevention;radiation protection;bone rarefaction
TS201.2
A
1002-0306(2010)08-0364-06
2009-03-12 *通訊聯系人
曲妍妍(1984-),女,碩士研究生,研究方向:食品化學。
國家863課題(2008AA10Z331)。

