花生短肽脫鹽工藝研究
張宇昊 馬 良 謝 祥 王 強
(西南大學食品學院1,重慶 400715)
(中國農業科院農產品加工研究所2,北京 100094)
花生短肽脫鹽工藝研究
張宇昊1馬 良1謝 祥1王 強2
(西南大學食品學院1,重慶 400715)
(中國農業科院農產品加工研究所2,北京 100094)
對花生短肽脫鹽方法進行了系統研究,比較了陰陽離子交換樹脂法、大孔樹脂法和陰陽離子混合床法的脫鹽效果,結果顯示,陰陽離子混合床脫鹽法效果最優。在此基礎上,對花生短肽陰陽離子混合床脫鹽工藝進行優化,確定了花生短肽脫鹽較優參數組合為:水解液過柱速度為 5~10倍柱體積/h、水解液初始pH值 4.5、陰陽離子樹脂比例為 3:2,在此條件下花生短肽脫鹽率和回收率均大于 80%。成分測定結果表明,脫鹽后花生肽純度達到 90.25%。
花生短肽 脫鹽 混合床
花生是我國六大油料作物之一,產量高居世界首位。目前,中國對花生的利用主要是食用油脂的提取,對花生蛋白的利用較少。采用生物酶法在溫和條件下對蛋白進行水解,生成的多肽具有很高營養價值。現代營養研究表明[1-4]:分子量小于1 000 Da的短肽極易被人體吸收利用,而且具有較強的功能活性。因此以花生蛋白為原料開發高附加值的花生短肽產品可大大促進我國花生蛋白深加工產業的發展。
短肽的制備通常采用蛋白質酶解法[5],花生蛋白酶解過程中,為了使蛋白酶處于最適 pH范圍內,盡量維持其水解速度,必須不斷加入一些堿或酸來調節水解體系的 pH值,因此最后得到的蛋白水解物中含有一定量的鹽分,這部分鹽分可能會影響到產品的純度和適用范圍并對其功能活性帶來負面影響[6],進而限制其在食品領域的應用,因此需要對花生短肽進行脫鹽處理。
傳統的脫鹽方法包括離子交換樹脂脫鹽法和大孔樹脂法[7-10]。離子交換樹脂脫法要分別通過陰陽離子交換樹脂,使得脫鹽過程較為繁瑣,且肽回收率較低。這是因為在水解液經過陽離子樹脂時,溶液體系表現為酸性,使得大量肽分子在溶液中帶正電荷,從而造成肽的損失較大,經過陰離子樹脂時亦然。大孔樹脂法則要經過吸附和洗脫過程,不僅操作繁瑣,肽得率較低,而且洗脫時要使用有機溶劑,使得該法不易實現產業化。
針對傳統脫鹽方法短肽得率較低等方面的問題,對短肽脫鹽技術進行改良,以期獲得高脫鹽率、高短肽得率的脫鹽方法,為花生短肽的產業化提供理論依據。
1 材料與方法
1.1 主要原料和試劑
冷榨花生蛋白粉:青島長壽集團;Alcalase:Novo公司;N120p:Kerry公司;001×7型陽離子交換樹脂,D301-G型陰離子交換樹脂、DA201-C大孔樹脂、江陰蘇青水處理公司;福林 -酚試劑:Sigma公司。
1.2 主要設備
HD-21-88自動核酸蛋白分離層析儀:上海奇特分析儀器有限公司;CS501-SP超級數顯恒溫器:重慶四達試驗儀器有限公司;UV—1201紫外分光光度計:北京瑞利分析儀器公司;微型旋渦混合儀:上海滬西分析儀器廠。
1.3 分析方法
1.3.1 花生蛋白的制備
冷榨花生蛋白粉→堿溶 (料水比 1∶10,25℃,25 min,pH 8.5)→離心 (800×g,5 min)→上層清液→酸沉 (pH 4.5)→離心 (4 200×g,15 min)→冷凍干燥[7]。
1.3.2 花生短肽的制備
將花生蛋白溶于水中,攪拌溶解,用 Alcalase與N120p雙酶分步水解,酶解過程中不斷用 1 mol/L NaOH維持酶解所需 pH不變;酶解完畢后將水解液加熱至 90℃,保溫 20 min進行滅酶處理;4 200 g離心 15 min;冷凍干燥備用。
1.3.3 陰陽離子交換樹脂脫鹽
陰陽離子交換樹脂于水中浸泡處理 24 h后裝柱,然后分別用 7.5%HCl和 10%NaOH對其進行處理,轉化為 H+型陽離子交換樹脂和OH-型陰離子交換樹脂,再用水清洗至微酸性或微堿性待用。
將所得花生蛋白水解液,以 10倍柱體積 /h的流速通過 H+型陽離子交換樹脂來脫除陽離子,待流出液 pH=4.0時停止加樣,之后將此流出液以同樣流速通過OH-型陰離子交換樹脂來脫除陰離子,至流出液呈弱酸性加樣[11]。1.3.4 大孔樹脂法脫鹽1.3.4.1 靜態吸附試驗
于 100 mL具塞錐形瓶中加入 5.0 g樹脂,一定質量濃度 (20 mg/mL)的水解液 40 mL,用塞子塞好,振蕩均勻,將該錐形瓶放入 4℃水域恒溫振蕩器中振蕩 (160 r/min)24 h,至吸附平衡,按下式計算吸附量[8]:
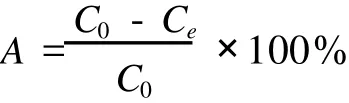
式中:A為吸附率;C0為起始質量濃度/mg/mL;Ce為平衡質量濃度 /mg/mL。1.3.4.2 靜態解吸試驗
將吸附上水解液的樹脂從吸附體系中通過過濾分離出來,然后選擇一定濃度的乙醇作為洗脫劑,對吸附了活性肽的樹脂進行洗脫,按下式計算洗脫率:

式中:D為解吸率;VD為洗脫液體積/mL;C1為解吸液質量濃度/mg/mL;V為脫鹽料液的體積 /mL。
1.3.5 混合床脫鹽
將花生水解液通過混合床進行脫鹽,基本條件為陰離子∶陽離子 =3∶2,過柱速度:5倍柱體積 /h,水解液 pH值 4.5,改變其中一個條件,固定其他條件以分別考察各因素對水解液脫鹽效果及蛋白回收率的影響。各因素水平梯度分別為陰離子 ∶陽離子1∶2、2∶3、1∶1、3∶2、2∶1;過柱速度:2倍、5倍、10倍、15倍柱體積 /h;水解液 pH值:3.5、4.5、5.5、6.5、7.5。

式中:M1為脫鹽后鹽分含量/mg;M0為脫鹽前鹽分含量 /mg。
1.3.8 花生短肽成分測定
蛋白質測定:GB/T 5009.5—2003;脂肪測定:GB/T 5009.6—2003;灰分測定:GB/T 5009.4—2003;總糖測定:苯酚 -硫酸法[14]。

式中:N1為脫鹽后短肽含量/mg;N0為脫鹽前短肽含量 /mg。
1.3.7 脫鹽率測定
鹽分含量采用灰分法 G B/T 5009.4—2003測定。
1.3.6 短肽得率測定
短肽含量采用 Lowry法[12-13]測定。
2 結果與討論
2.1 花生短肽脫鹽方法的選擇
將三種花生短肽脫鹽方法進行對比,結果如圖 1所示。
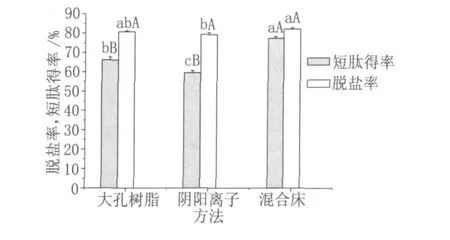
圖 1 脫鹽方法的比較
花生肽經混合床處理后,其脫鹽率為 (82.19±0.75)%,與經大孔樹脂處理的樣品相比沒有差異(P>0.05),但脫鹽效果在 P<0.05水平下顯著好于陰陽離子分別處理的樣品;從短肽回收率的結果來看,采用混合床法脫鹽后樣品短肽得率達到(77.39±0.96)%,顯著高于大孔樹脂法和陰陽離子樹脂法處理后的樣品 (P<0.05)。
采用陰陽離子樹脂法脫鹽時,水解液經過陽離子樹脂時,整個溶液體系表現為酸性,使得大量肽分子在溶液中帶正電荷并被吸附于樹脂上,經過陰離子樹脂時亦然;另外一些肽分子還會吸附于樹脂的孔徑之上,因此采用陰陽離子樹脂分別脫鹽時會造成短肽損失較大。一些文獻報道通過增加過柱速度可降低短肽的損失,但試驗結果證明,采用 10倍柱體積 /h的流速并沒有達到滿意的短肽回收率,反而造成其脫鹽率顯著低于混合床脫鹽法 (P<0.05)。
大孔樹脂是 20世紀 60年代發展起來的一類非離子型高分子吸附劑,是基于化合物的疏水集團與非極性吸附劑之間的范德華力和靜電引力,其結合力的大小與各種生物分子的結構以及吸附樹脂的性質密切關系,對水溶性化合物的分離具有較好的效果[15-16]。利用大孔樹脂脫鹽主要是利用短肽中的疏水性殘基可以從水相中通過疏水作用吸附到樹脂的疏水表面和網絡空穴內部,由此將短肽與鹽分離,再通過有機溶劑洗脫來重新得到短肽。試驗結果表明,大孔樹脂脫鹽效果令人滿意,但是短肽得率仍然偏低,另外操作過程中需采用有機溶劑洗脫,造成了這一技術的推廣前景不樂觀。
混合床技術主要用于水處理,用于短肽脫鹽尚未見報道。試驗結果證明,采用混合床對花生肽脫鹽無論是脫鹽率還是短肽得率均較高,這是因為水解液在脫鹽過程中 pH比較穩定,大大減少了脫鹽過程中肽的損失;另外陰陽離子之間的相互作用會使樹脂對短肽的吸附程度降低,可見混合床脫鹽在短肽得率方面同前兩種方法相比有明顯優勢,因此選用混合床對花生短肽進行脫鹽。
2.2 混合床脫鹽參數的選擇
2.2.1 過柱速度的確定
過柱速度對蛋白質回收率及脫鹽率都有影響,過柱速度過快會造成樣品與樹脂接觸時間短,從而脫鹽率降低;過柱速度過慢會造成樣品與樹脂接觸時間過長,從而短肽回收率降低。花生蛋白水解液以不同的過柱速度通過樹脂,收集流出液,測定蛋白質回收率和脫鹽率。試驗結果如圖 2所示,當過柱速度為 10倍柱體積 /h時,蛋白回收率為 85.99%,與流速為 15倍柱體積 /h時沒有差異 (P>0.05);脫鹽率為 81.62%,與流速為 5倍柱體積 /h時沒有差異(P>0.05)。因此綜合考慮,在實際生產中,水解液過柱速度可選擇 5~10倍柱體積 /h。
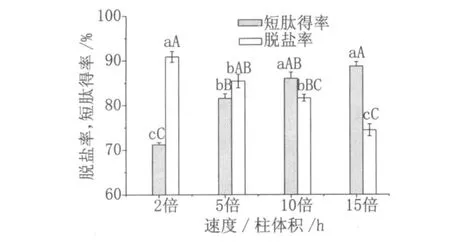
圖 2 過柱速度的選擇
2.2.2 酶解液 pH值的確定
酶解液的 pH值會影響體系離子化程度,當其離子化程度較低時,短肽損失少,反之,損失較大。由圖 3可知,水解液 pH對短肽脫鹽率影響不大,但是對短肽得率影響較大,當 pH值為 4.5時短肽得率最高,可達 82.89%,而在其他 pH下進行混合床脫鹽,短肽得率均小于 80%,因此選擇 pH 4.5為較優 pH。
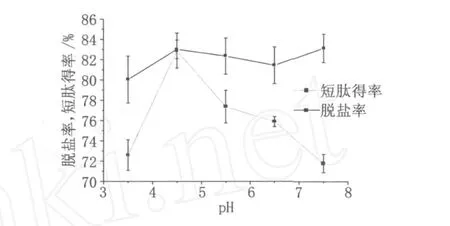
圖 3 水解液 pH值的選擇
2.2.3 陰陽離子交換樹脂比例的確定
離子交換樹脂的比例對脫鹽和短肽得率都會產生影響,比例不適當會造成水解液中的鹽分無法完全脫除;還會使體系 pH發生較明顯變化進而造成短肽得率降低。由圖 4可知,陰離子樹脂∶陽離子樹脂為 3∶2和 2∶1時,脫鹽率分別達到 85.17%和82.85%,顯著高于其他水平 (P<0.05),陰陽離子樹脂比例為 3∶2時的短肽得率為 83.2%,顯著高于陰離子樹脂∶陽離子樹脂為 2∶1時的短肽脫鹽率 (P<0.05)。因此選擇陰陽離子樹脂比例為 3∶2為較優樹脂比例。
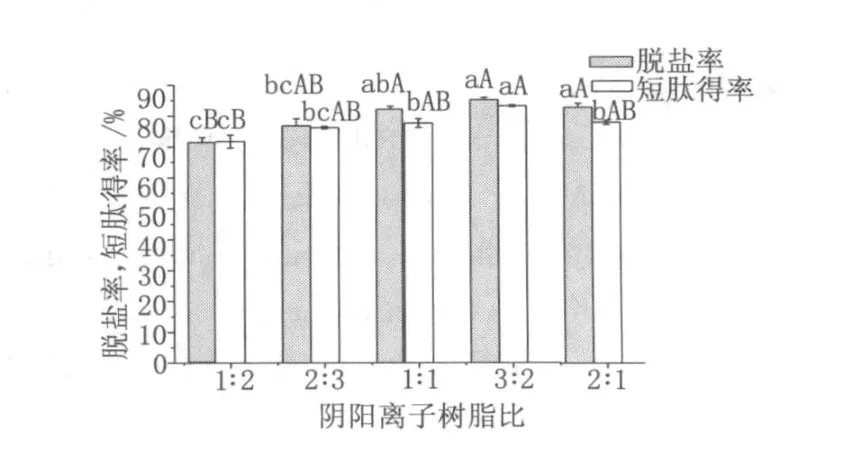
圖 4 樹脂比例的選擇
2.3 花生短肽成分測定
脫鹽后的花生短肽經測定組分見表 1,大豆肽行業標準規定,一級大豆肽的純度需達到 80%以上 (干基),經脫鹽后,花生肽純度達 90%,高于一級肽的標準。
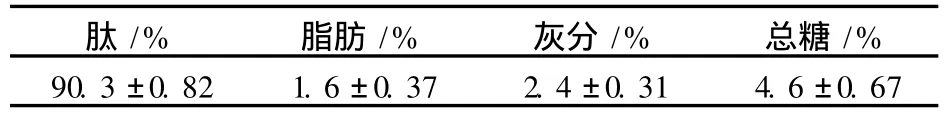
表 1 花生短肽的組成 (干基)
3 結論
3.1 建立了陰陽離子交換樹脂混合床脫鹽法,最適操作條件為:水解液過柱速度為 5~10倍柱體積 /h、水解液 pH值 4.5、陰陽離子樹脂比例為 3∶2,花生短肽脫鹽率和蛋白回收率均大于 80%。
3.2 脫鹽后花生肽純度達到 90.3%。
[1]Grimble.G.K,Silk.D.B.A.Intravenous protein hydrolysates-Time to turn the clock back[J].ClinicalNutrition,1990,9(1):39-45
[2]盛國華.大豆多肽的功能及應用 [J].食品工業科技,1993,6:21-26
[3]頓新鵬,陳正望.酶法水解米渣蛋白制備大米小分子肽[J].食品科學,2004,25(6):113-116
[4]張曉駟,馮靜波.功能性蛋白短肽的蛋白酶法生產研究[J].動物科學與動物醫學,2004,21(3):48-51
[5]張宇昊,王強.功能性短肽的研究進展 [J].中國油脂,2007,32:69-73
[6]Ras E T,Pomantoc J J,Tumulak E P,et al.ETRAS thermal desalination system[J].Desalination,2000,132:353-356
[7]田波,遲玉杰.蛋清蛋白質水解物的精制 [J].食品科學,2003,24(1):90-92
[8]宮霞,趙駿.大孔吸附樹脂對酪蛋白酶解液的脫鹽作用研究[J].食品科學,2006,27(11):301-303
[9]周存山,馬海樂,余莜潔,等.麥胚蛋白降血壓肽的大孔樹脂脫鹽研究[J].食品科學,2006,27(3):142-146
[10]趙新淮.大豆蛋白水解物的精制研究[J].東北農業大學學報,1997,28(1):94-97
[11]云霞,張彧,朱蓓薇,等.酶解玉米黃粉制備多肽的工藝研究[J].食品工業科技,2002,23(11):69-71
[12]汪家政,范明.蛋白質技術手冊[M].科學出版社,2002
[13]Owueu-Apenten R.K.Food Protein Analysis[M].New York:MarcelDekker,Inc,2002
[14]DubisM.Colorimetric method for deter mination of sugar and related substances[J].Anal Chem.1956,28:349-352
[15]蘇拔賢.生物化學制備技術 [M].北京:科學出版社,1998:78
[16]趙永芳.生物化學技術原理及其應用 [M].武漢:武漢大學出版社,1994:44.
Desalinization Process of PeanutOligopeptide
Zhang Yuhao1Ma Liang1Xie Xiang1Wang Qiang2
(Food College of SouthwestUniversity1,Chongqing 400715)
(Institute of Processing forAgricultural Products,Chinese Academy ofAgricultural Sciences2,Beijing 100094)
The different desalting methods of peanut oligopeptide,including cation-anion exchange resins,macroporous resin andmixed bed,were studied.Themixed bedwasproved to be the bestone.On the basis,the de2 salting process of peanut oligopeptide by cation-anion exchange resinsmixed bed was opti mized to improve product purity.Results:The obtained opti mum conditions are hydrolyte flow rate 5~10 BV/h,initial pH value of hydrolyte 4.5 and ratio of anion/cation exchange resins 3∶2.The desalting rate and oligopeptide recovery rate are all above 80%,better effect than the traditional desaltingmethod.The purity of the desalting peanutoligopeptides is90.25%.
peanut oligopeptides,desalinization,mixed bed
TS214.2
A
1003-0174(2010)02-0117-04
科技部“十一五”科技支撐計劃項目 (2006BAK02A07-2)
2009-03-02
張宇昊,男,1978年出生,副教授,博士,農副產品加工
王強,男,1965年出生,研究員,功能食品加工和全程質量控制

