靶向STAT3基因的RNAi慢病毒載體的構建及在胰腺癌細胞中的表達
楊光 裘正軍 劉君 畢維民 明晗昕 黃陳
靶向STAT3基因的RNAi慢病毒載體的構建及在胰腺癌細胞中的表達
楊光 裘正軍 劉君 畢維民 明晗昕 黃陳
RNA干擾(RNA interference, RNAi)是指生物體內由雙鏈RNA介導同源序列mRNA的特異性降解,從而導致基因沉默的現象[1]。通過合適的載體將RNA干擾片段轉入目的細胞,可以有效地抑制功能基因的表達。信號轉導及轉錄活化因子3(signal transducers and activators of transcription3, STAT3)是一個重要的信號轉導和轉錄激活因子,目前已將其定義為癌基因[2]。本實驗構建針對STAT3序列的慢病毒載體,轉染胰腺癌細胞株SW1990,建立STAT3基因穩定沉默的SW1990細胞系。
一、材料與方法
1.小干擾RNA(siRNA)的設計及合成:根據網站(https://rnaidesigner·invitrogen·com/sirna/)提供的軟件設計合成3個靶向STAT3基因(NM_139276)的特異性siRNA,起始位置分別為466位點、 1638位點和1061位點。siRNA-1序列:5′-TAATGTTCTCTATCAGCACAATTTCAAGAGAATTGT-GCTGATAGAGAACATTTTTTTTC-3′,5′-TCGAGAAAAAAAATGTTCTCTATCAGCACAATTCTCTTGAAATTGTGCTGATAGAG-AACATTA-3′;siRNA-2序列:5′-TAACATCTGCCTAGATCGGCTATTCAAGAGATAGCCGATCTAGGCAGATGTTTTTTTTC-3′;5′-TCGAGAAAAAAaaCATCTGCCTAGATCGGCTATCTCTTGA-ATAGCCGATCTAGGCAGATGTTA-3′;siRNA-3序列:5′-TAA-CTTCAGACCCGTCAACAAATTCAAGAGATTTGTTGACGGGTC-TGAAGTTTTTTTTC-3′,5′-TCGAGAAAAAAAACTTCAGAC-CCGTCAACAAATCTCTTGAATTTGTTGACGGGTCTGAAGTTA-3′。引物由吉凱基因技術有限公司合成。
2.慢病毒包裝及病毒滴度測定:應用Hpa I和Xho I酶切法將STAT3寡核苷酸片段插入pGCL-GFP質粒構建過表達STAT3的質粒,轉化感受態大腸桿菌,挑選氨芐青霉素抗性菌落并擴增培養。提取質粒DNA,PCR擴增法鑒定陽性克隆并測序。將siRNA連接到病毒載體(吉凱公司),使用lipofectamine 2000(invitrogen公司)將腺病毒和過表達STAT3的質粒共轉染293T細胞,分別收集感染后48 h的293T細胞和培養上清液。裂解細胞沉淀,Western blotting檢查STAT3蛋白表達;培養上清離心、0.45 μm濾器過濾。將該病毒粗提液收集到濾杯中并加蓋,插入含濾過液的收集管,離心獲得病毒濃縮液,置-70℃保存。采用逐孔稀釋法測定病毒滴度。
3.慢病毒感染SW1990細胞及細胞STAT3mRNA、蛋白檢測:收集對數生長期SW1990細胞,接種于12孔板培養,待細胞融合達30%~40%時,加入適量的STAT3-siRNA病毒感染3 d,觀察慢病毒的報告基因GFP,感染效率>50%者繼續培養。同時設為感染組及陰性對照表達(STAT3-Con)組收集感染的SW1990細胞。提取細胞總RNA,采用實時 PCR方法檢測STAT3 mRNA表達。STAT3上、下游引物序列為5′-CCAAGGAGGAGGCATTCG-3′,5′-ACATCGGCAGGTCAATGG-3′,產物147 bp;內參β-actin上、下游引物序列為5′-TCGTGCGTGACATTAAGGAGSTAT-3′, 5′-AAGGTAGTTTCGTGGATGCC-3′,產物214 bp。以空病毒載體感染的SW1990為對照細胞。mRNA病毒量以2-ΔΔCt表示。ΔCt= Ct值目的基因-Ct值β-actin,-ΔΔCt= ΔCt對照組- ΔCt實驗組。實驗重復3次。同時收集細胞,制備勻漿,常規Western blotting檢測STAT3蛋白表達。以GADPH蛋白作為內參照,用圖像分析軟件進行光密度積分值分析。
4.感染細胞增殖檢測:無血清培養細胞18~20 h使細胞同步化。繼續培養24、48、72、96 h,分別用ATT法檢測細胞增殖。用A570值繪制生長曲線。
5.感染細胞周期測定:上流式細胞儀檢測。計算細胞增殖指數(proliferation index,PI),PI=(S+G2)/(G1+S+G2)。
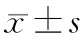
二、結果
1.負載siRNA的慢病毒載體的鑒定:靶向 STAT3的慢病毒載體轉染293T細胞的效率約60%~70%,3個siRNA均有顯著敲減STAT3表達作用,以siRNA-2效果最為明顯(圖1)。病毒的滴度為1×109TU/ml。
2.慢病毒感染SW1990細胞后STAT3mRNA和蛋白表達的變化:慢病毒感染SW1990細胞24 h后,發現有熒光蛋白表達,且表達量隨時間遞增,到72 h達到最大,感染效率大于90%,此后保持在高表達狀態,沒有明顯下降。 感染含siRNA-2慢病毒的SW1990細胞STAT3 mRNA表達明顯被抑制,抑制率達80.6%(t=5.085,P=0.007);STAT3蛋白的表達亦明顯被抑制,抑制率達78.2%(t=14.278,P=0.000,圖2)。

1: 293T細胞組,2:STAT3過表達質粒+病毒載體組,3:STAT3過表達質粒+陰性對照病毒載體組,4:STAT3過表達質粒+含siRNA-1病毒載體組,5:STAT3過表達質粒+含siRNA-2病毒載體組,6:STAT3過表達質粒+含siRNA-3病毒載體組
圖1感染負載不同siRNA慢病毒載體的293細胞的STAT3蛋白表達

圖2親本SW1990 和感染陰性對照慢病毒及含siRNA慢病毒的SW1990細胞的STAT3蛋白表達
3.細胞增殖的變化:培養48、72、96 h后,STAT3-siRNA組細胞增殖能力較STAT3-Con組或SW1990組明顯下降(P<0.05,圖3)。

圖3 各組SW1990細胞的增殖
4.細胞周期的變化:SSTAT3-siRNA組PI值明顯低于SW1990組或STAT3-Con組(t=4.894,P=0.008;t=6.592,P=0.003,表1,圖4)。

圖4 各組SW1990細胞周期

組別G1期G2期S期G2+S期(PI)SW199035.8±5.949.3±2.814.5±3.263.7±5.7STAT3-Con43.3±2.151.9±3.44.8±1.356.7±2.1STAT3-siRNA52.4±1.043.3±1.14.3±2.147.6±1.2ab
注:與SW1990組比較,aP<0.05;與STAT3-Con組比較,bP<0.05
討論JAKs/STATs途徑將細胞因子的信號從細胞表面傳到細胞核的目的基因,調控相關基因的表達。STAT3在多種腫瘤組織中異常表達和激活,并與腫瘤的增殖、分化、細胞凋亡、血管生成、浸潤轉移和免疫逃避密切相關[3]。因此,有效抑制STAT3表達可能是治療高表達STAT3腫瘤的關鍵所在。
目前,RNAi作為一種研究手段被用于特異性抑制相關基因的表達,可成為腫瘤基因治療的新途徑[4-5]。RNAi常用的病毒載體有腺病毒和逆轉錄病毒載體。慢病毒是逆轉錄病毒的一種,目前已經廣泛應用于基因表達調控、基因治療等領域。利用慢病毒載體構建的siRNA表達載體,與化學合成的siRNA和瞬時表達載體構建的shRNA相比,一方面可以代替瞬時表達載體使用,另一方面,慢病毒載體經過包裝系統包裝后,可用于感染傳統轉染試劑難以轉染的細胞如原代細胞、懸浮細胞等,并且在感染后整合到宿主細胞的基因組,而達到長時間的穩定表達[6]。慢病毒載體轉移基因片段具有容量較大、目的基因表達時間長、不易誘發宿主免疫反應等優點,因此成為攜帶siRNA的理想載體[7-8]。
Gao等[9]將STAT3特異性siRNA轉染到人喉癌Hep2細胞,能下調細胞中STAT3蛋白的表達,抑制細胞的生長,促進
細胞凋亡的現象。Xiong等[10]通過STAT3特異性siRNA體外轉染結腸癌細胞,能抑制細胞的生長,誘導細胞的凋亡。本研究構建了靶向STAT3的特異性siRNA序列,通過慢病毒載體感染SW1990細胞,能顯著抑制細胞STAT3 mRNA及蛋白表達,阻止細胞進入S期,明顯減慢細胞增殖,提示本實驗成功構建了STAT3siRNA重組慢病毒質粒,為進一步了解STAT3基因的生物學特性并從分子水平探討胰腺癌的發生發展機制,提供了有效的工具,具有重要的實驗價值。
[1] Hannon GJ.RNA interference.Nature,2002,418:244-251.
[2] Inghirami G,Chiarle R,Simmons WJ,et al.New and old functions of STAT3:a pivotal target for individualized treatment of cancer.Cell Cycle,2005,4:1131-1133.
[3] Haura EB,Turkson J,Jove R.Mechanisms of disease: Insights into the emerging role of signal transducers and activators of transcription in cancer.Nat Clin Pract Oncol,2005,2:315-324.
[4] Kamath RS,Fraser AG,Dong Y,et al.Systematic functional analysis of the Caenorhabditis elegans genome using RNAi.Nature,2003,421:231-237.
[5] Takei Y,Kadomatsu K,Yuzawa Y,et al.A small interfering RNA targeting vascular endothelial growth factor as cancer therapeutics.Cancer Res,2004,64:3365-3370.
[6] Liau SS,Ashley SW,Whang EE.Lentivirus-mediated RNA interference of HMGA1 promotes chemosensitivity to gemcitabine in pancreatic adenocarcinoma.J Gastrointest Surg,2006,10:1254-1262.
[7] Scherr M,Eder M.Gene transfer into hematopoietic stem cells using lentiviral vectors.Curr Gene Ther,2002,2:45-55.
[8] Nishitsuji H,Ikeda T,Miyoshi H,et al.Expression of small hairpin RNA by lentivirus-based vector confers efficient and stable gene-suppression of HIV-1 on human cells including primary non-dividing cells.Microbes Infect,2004,6:76-85.
[9] Gao LF,Xu DQ,Wen LJ,et al.Inhibition of STAT3 expression by siRNA suppresses growth and induces apoptosis in laryngeal cancer cells.Acta Pharmacol Sin,2005,26:377-383.
[10] Xiong H,Zhang ZG,Tian XQ,et al.Inhibition of JAK1, 2/STAT3 signaling induces apoptosis,cell cycle arrest,and reduces tumor cell invasion in colorectal cancer cells.Neoplasia,2008,10:287-297.
2009-08-04)
(本文編輯:呂芳萍)
10.3760/cma.j.issn.1674-1935.2010.05.022
上海市教育委員會科研資助項目(06BE067)
271000 山東,泰安市中心醫院普外科(楊光、劉君、畢維民、明晗昕);上海交通大學附屬第一人民醫院普外科(裘正軍、黃陳)
裘正軍,Email:qiuwryb@online.sh.cn

