不同廠家復(fù)方丹參片抑菌作用強(qiáng)弱的比較
王海華
(廣西南寧食品藥品檢驗(yàn)所,廣西南寧530001)
復(fù)方丹參片收載在《中國藥典》2005年版一部[1],含丹參、三七、冰片3種中藥成分,具有活血化瘀,理氣止痛的功效。處方中丹參和冰片兩味中藥材,均對某些細(xì)菌的生長繁殖有一定抑制作用[2-6]。為保證臨床用藥的安全性,目前各國藥典對口服制劑的微生物污染狀況有明確的質(zhì)控指標(biāo)[1,7-10]。在藥品監(jiān)督檢驗(yàn)工作中,經(jīng)常遇到該品種不同生產(chǎn)廠家提供的微生物限度檢查資料所采用的方法差異很大,本實(shí)驗(yàn)通過回收率實(shí)驗(yàn)對16個廠家生產(chǎn)的復(fù)方丹參片的抑菌作用強(qiáng)弱進(jìn)行了比較,為該品種的微生物限度檢驗(yàn)方法的建立提供參考和依據(jù)。
1 儀器與試藥
1.1 儀器 SPS202F電子天平[奧豪斯國際貿(mào)易(上海)有限公司];TDL-40B臺式離心機(jī)(上海安亭科學(xué)儀器廠);LRH-250-G型光照培養(yǎng)箱(廣東省醫(yī)療器械廠);LRH-250-A型生化培養(yǎng)箱(廣東省醫(yī)療器械廠);HR-8753GM微波爐(青島海爾微波制品有限公司);Ⅱ級生物安全柜(上海振梓創(chuàng)空氣凈化設(shè)備有限公司)等。
1.2 實(shí)驗(yàn)菌種 枯草芽孢桿菌(Bacillus subtilis)[CMCC(B)63501]、金黃色葡萄球菌(Staphlococcus aureus)[CMCC(B)26003]、大腸埃希菌(Escherichia coli)[CMCC(B)44102]、白色念珠菌(Candida albicans)[CMCC(F)98001]、黑曲霉(Aspergillus niger)[CMCC(F)98003],由中國醫(yī)學(xué)微生物菌種保藏管理中心提供。
1.3 培養(yǎng)基及稀釋劑 營養(yǎng)瓊脂培養(yǎng)基,玫瑰紅鈉瓊脂培養(yǎng)基,營養(yǎng)肉湯培養(yǎng)基,膽鹽乳糖培養(yǎng)基(BL),改良馬丁培養(yǎng)基,MUG培養(yǎng)基,曙紅亞甲藍(lán)瓊脂培養(yǎng)基,膽鹽乳糖發(fā)酵培養(yǎng)基,pH7.0無菌氯化鈉-蛋白胨緩沖液,0.9%無菌氯化鈉溶液。
1.4 樣品 復(fù)方丹參片,16個廠家生產(chǎn)(編號分別為 A、B、C、D、E、F、G、H、I、J、K、L、M、N、O、P),從市場購買。
2 方法[1]
2.1 菌液的制備 取經(jīng)35℃培養(yǎng)18~24 h的金黃色葡萄球菌、大腸埃希菌、枯草芽孢桿菌的營養(yǎng)肉湯培養(yǎng)物用0.9%無菌氯化鈉溶液制備成每1 mL含菌數(shù)為50~100 cfu的菌懸液,備用;取經(jīng)25℃培養(yǎng)24~48 h的白色念珠菌液體培養(yǎng)物用0.9%無菌氯化鈉溶液制備成每1 mL含菌數(shù)為50~100 cfu的菌懸液,備用;取經(jīng)25℃培養(yǎng)1周的黑曲霉斜面培養(yǎng)物,加10 mL 0.9%無菌氯化鈉溶液洗下霉菌孢子,吸取菌液用0.9%無菌氯化鈉溶液制備成每1 mL含菌數(shù)為50~100 cfu的菌懸液,備用。
2.2 供試液制備 取樣品10 g,加pH7.0無菌氯化鈉—蛋白胨緩沖液稀釋至100 mL,制備成溶解均勻的1∶10的供試液。
2.3 采用方法
2.3.1 常規(guī)法 取1∶10的供試液1 mL注皿。
2.3.2 培養(yǎng)基稀釋法 取1∶10的供試液1mL注入2個平皿(0.5 mL/皿)或5個平皿(0.2 mL/皿)。
2.3.3 低速離心法加培養(yǎng)基稀釋法 取1∶10供試液10 mL至無菌離心管中,500 r/min離心5 min,取上清液1 mL分別注入2個平皿(0.5 mL/皿)或5個平皿(0.2 mL/皿)。
2.3.4 低速離心法加薄膜過濾法 取1∶10供試液10 mL至無菌離心管中,500 r/min離心5 min,取上清液1 mL 薄膜過濾,沖洗 100、200、300、400、500 mL。
3 回收率測定
3.1 試驗(yàn)組 按2.3項(xiàng)下方法操作后,分別加入試驗(yàn)菌50~100 cfu注入同一平皿中,立即傾注瓊脂培養(yǎng)基,待凝固后,置規(guī)定溫度,細(xì)菌培養(yǎng)24~48 h,白色念珠菌和黑曲霉培養(yǎng)48~72 h,測定其菌數(shù)(薄膜過濾法取上述供試液過濾、沖洗,在最后一次沖洗液中加入試驗(yàn)菌50~100 cfu,過濾,按薄膜過濾法測定其菌數(shù))。
3.2 菌液組 取試驗(yàn)菌50~100 cfu注入平皿中,立即傾注瓊脂培養(yǎng)基,其余操作同3.1項(xiàng)。
3.3 供試品對照組 按2.3項(xiàng)下方法操作后,立即傾注瓊脂培養(yǎng)基,其余操作同3.1項(xiàng)。
3.4 稀釋劑對照組 取pH7.0無菌氯化鈉-白胨緩沖液1mL和試驗(yàn)菌50~100 cfu,分別注入同一平皿中。考察稀釋劑對試驗(yàn)有無干擾。該對照組各試驗(yàn)菌的回收菌應(yīng)不低于70%。
試驗(yàn)組的加菌回收率(%)=(試驗(yàn)組平均菌落數(shù)-供試品對照組平均菌落數(shù))/(菌液組的平均菌落數(shù))×100%。
稀釋劑對照組的加菌回收率(%)=(稀釋劑對照組的平均菌落數(shù))/(菌液組的平均菌落數(shù))×100%。
4 結(jié)果
4.1 預(yù)試驗(yàn)結(jié)果 按照藥典規(guī)定的5種試驗(yàn)菌,采用常規(guī)法測定16個廠家生產(chǎn)的復(fù)方丹參片的回收率,以確定敏感菌株。預(yù)試驗(yàn)結(jié)果見表1。
表1所見,16個廠家生產(chǎn)的復(fù)方丹參片,金黃色葡萄球菌采用常規(guī)法回收率幾乎全部為0,表明復(fù)方丹參片對細(xì)菌抑制作用明顯,確定細(xì)菌數(shù)測定選用金黃色葡萄球菌作為敏感菌株進(jìn)行預(yù)試驗(yàn)。黑曲霉的回收率均大于70%,而白色念珠菌有6個廠家的回收率小于70%,故確定霉菌、酵母菌數(shù)測定選用白色念珠菌作為敏感菌株進(jìn)行預(yù)試驗(yàn)。
4.2 細(xì)菌數(shù)測定方法的確定 根據(jù)預(yù)試驗(yàn)結(jié)果,選用金黃色葡萄球菌作為敏感菌株進(jìn)行試驗(yàn),以確定細(xì)菌數(shù)測定方法。按2.3項(xiàng)下操作,結(jié)果見表2。
由表2結(jié)果得出:要達(dá)到藥典規(guī)定回收率大于70%的要求,不同廠家生產(chǎn)的復(fù)方丹參片需采用不同的方法:
編號E、F、G、O,需采用培養(yǎng)基稀釋法(0.2 mL/皿);編號K,需采用低速離心加培養(yǎng)基稀釋法0.5 mL/皿;編號 D、H、L、M、N,需采用低速離心加培養(yǎng)基稀釋法0.2 mL/皿;編號C、J,需采用低速離心加薄膜過濾法100 mL、編號B需200 mL、編號 P需300 mL;編號I,需采用薄膜過濾法(1∶100供試液1 mL過濾)100 mL、編號A需200 mL。
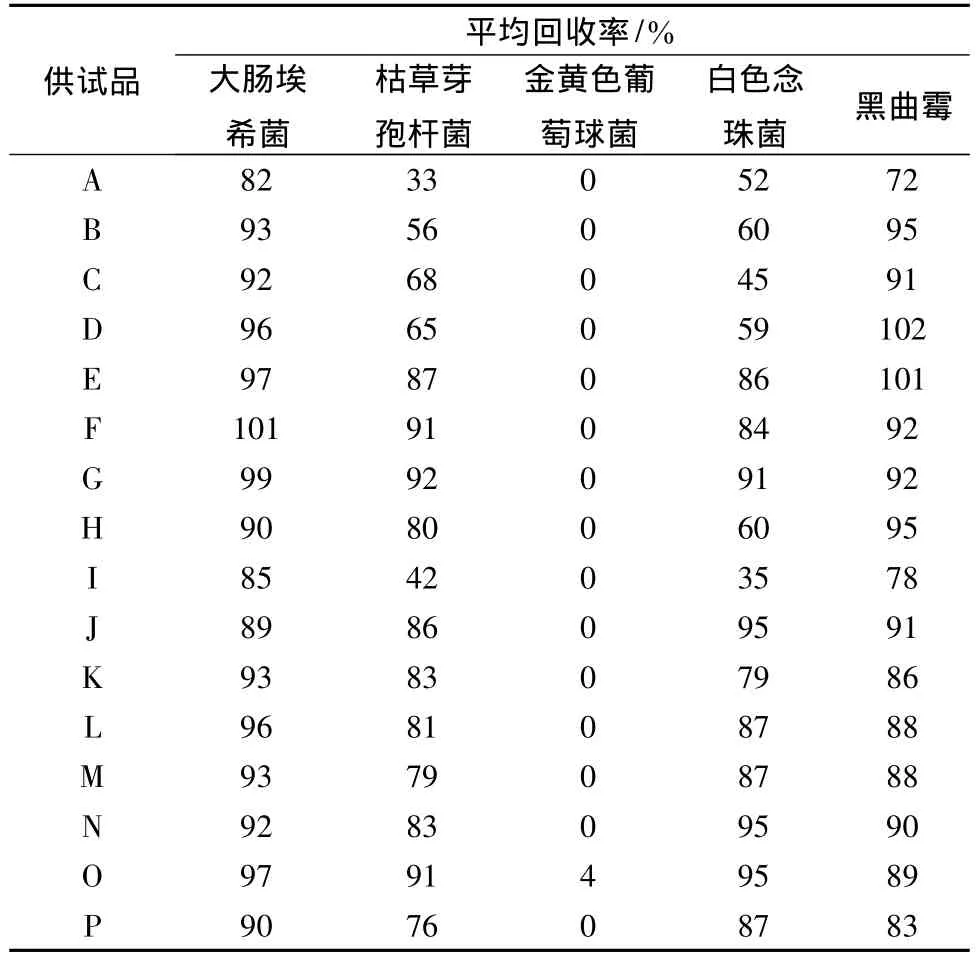
表1 十六個廠家復(fù)方丹參片常規(guī)法預(yù)試驗(yàn)結(jié)果(n=3)
pH7.0無菌氯化鈉—蛋白胨緩沖液作為稀釋劑的稀釋劑對照組回收率超過70%,表明稀釋劑pH7.0無菌氯化鈉—蛋白胨緩沖液無抑菌作用,對實(shí)驗(yàn)無干擾。
4.3 霉菌和酵母菌數(shù)測定方法的確定 根據(jù)預(yù)試驗(yàn)結(jié)果,選用白色念珠菌作為敏感菌株進(jìn)行試驗(yàn),以確定霉菌和酵母菌數(shù)測定方法。按2.3項(xiàng)下操作,結(jié)果見表3。
編號 E、F、G、J、K、L、M、N、O、P 共 10 個廠家生產(chǎn)的復(fù)方丹參片,白色念珠菌采用常規(guī)法回收率大于70%;編號B、D、H采用培養(yǎng)基稀釋法0.5 mL/皿,編號 A、C、I需0.2 mL/皿其回收率也均大于70%。
4.4 細(xì)菌、霉菌及酵母菌計數(shù)方法驗(yàn)證 根據(jù)預(yù)試驗(yàn)及細(xì)菌,霉菌、酵母菌方法確定結(jié)果,取16個廠家生產(chǎn)的復(fù)方丹參片樣品,按藥典規(guī)定進(jìn)行5種試驗(yàn)菌的加菌回收率試驗(yàn)驗(yàn)證。
細(xì)菌計數(shù):
編號為E、F、G、O廠家的復(fù)方丹參片采用培養(yǎng)基稀釋法(0.2 mL/皿);編號為 D、H、L、M、N 采用低速離心加培養(yǎng)基稀釋法(0.2 mL/皿);編號為K采用低速離心加培養(yǎng)基稀釋法(0.5 mL/皿);編號為C、J、B、P采用低速離心加薄膜過濾法(分別為100 mL、200 mL、300 mL);編號為 A、I采用薄膜過濾法(1∶100供試液1 mL過濾,分別沖洗200 mL、100 mL)。
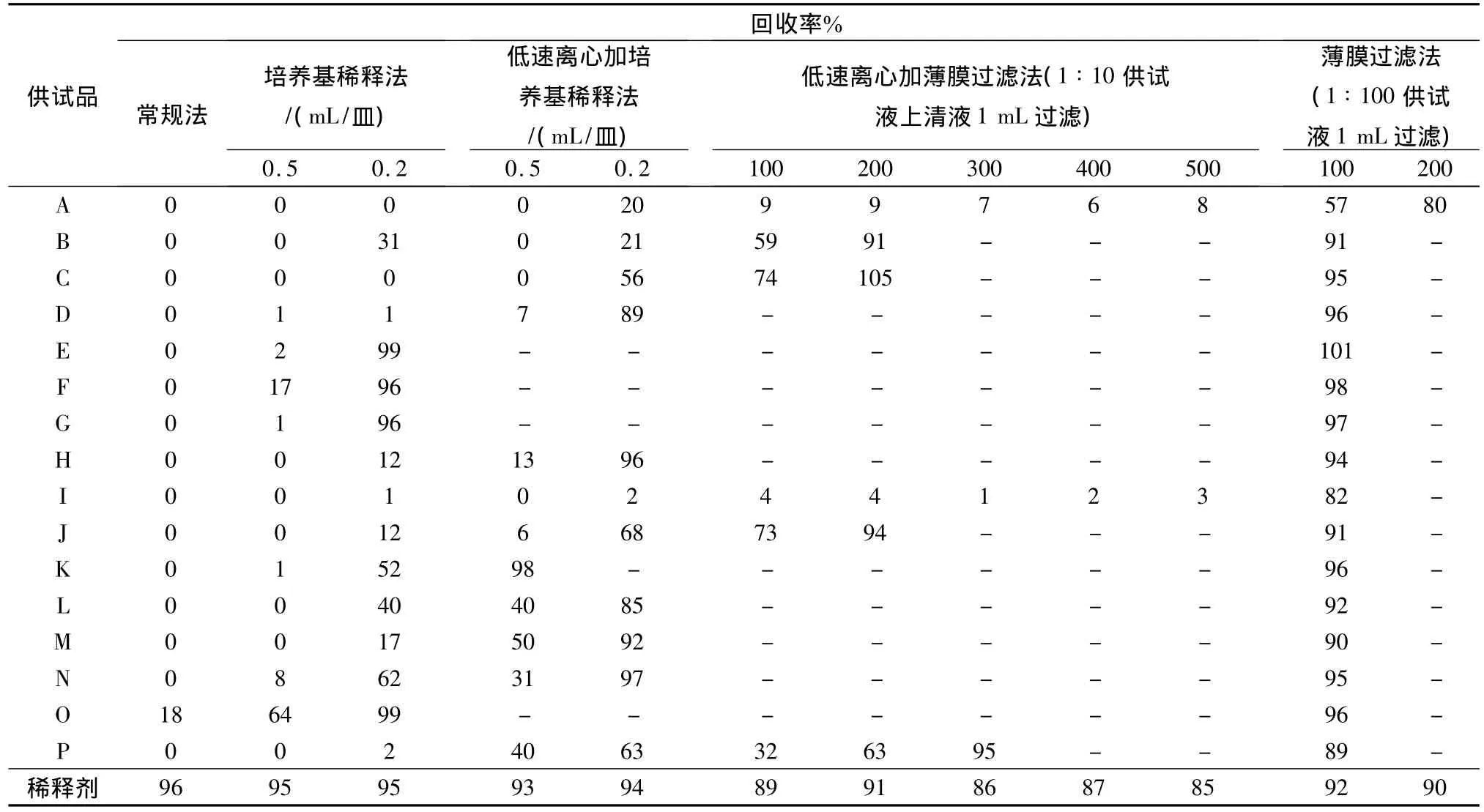
表2 敏感菌株(金黃色葡萄球菌)回收率試驗(yàn)結(jié)果(n=3)
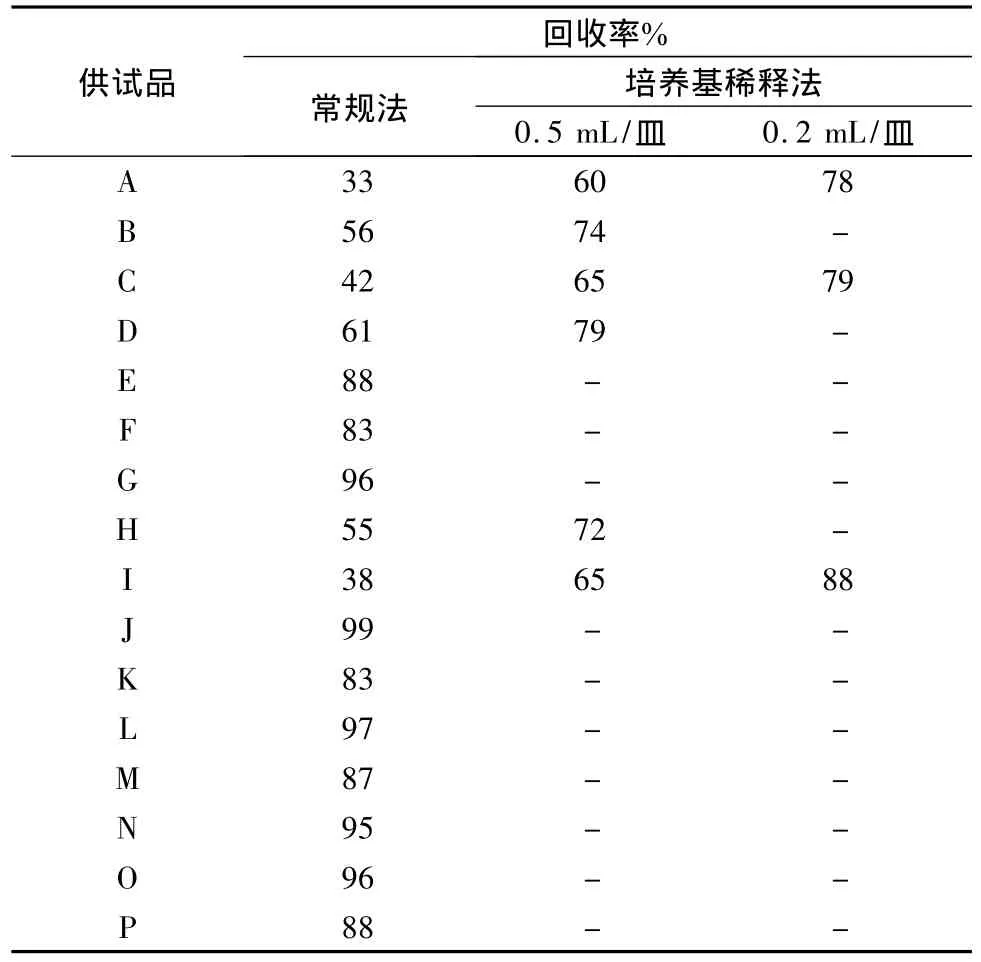
表3 敏感菌株(白色念珠菌)試驗(yàn)結(jié)果(n=3)
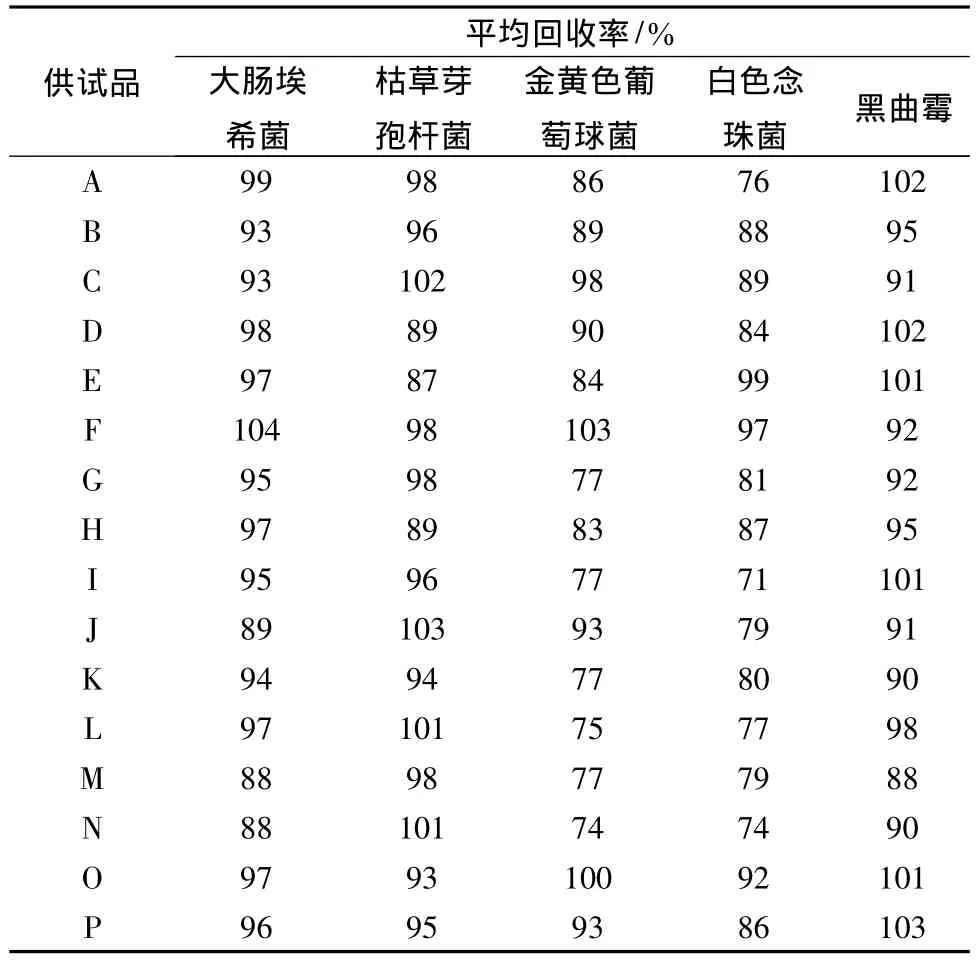
表4 16個廠家復(fù)方丹參片驗(yàn)證方法試驗(yàn)結(jié)果(n=3)
霉菌及酵母菌計數(shù):
編號為 E、F、G、J、K、L、M、N、O、P 按常規(guī)法;編號為A、C、I按培養(yǎng)基稀釋法(0.2 mL/皿);編號為B、D、H按培養(yǎng)基稀釋法(0.5 mL/皿)進(jìn)行加菌回收率試驗(yàn)。結(jié)果見表4。
16個廠家生產(chǎn)的復(fù)方丹參片的方法驗(yàn)證試驗(yàn)結(jié)果表明,由于其抑菌作用強(qiáng)弱不同,需要分別采用不同的方法進(jìn)行細(xì)菌數(shù)測定、霉菌及酵母菌數(shù)測定,5種規(guī)定試驗(yàn)菌的回收率均大于70%,符合《中國藥典》的規(guī)定,方法可行。
4.5 控制菌檢查方法的驗(yàn)證試驗(yàn)結(jié)果 按藥典方法,分別取16個廠家樣品的1∶10供試液10 mL和1 mL含10~100 cfu的大腸埃希菌加入100 mL BL增菌液(常規(guī)法)進(jìn)行控制菌大腸埃希菌驗(yàn)證試驗(yàn);1∶10供試液1 mL和1 mL含10~100 cfu的大腸埃希菌加入10 mL膽鹽乳糖發(fā)酵培養(yǎng)管中(常規(guī)法)進(jìn)行控制菌大腸菌群驗(yàn)證試驗(yàn),同時做相應(yīng)的陰性對照菌驗(yàn)證試驗(yàn)。結(jié)果為樣品試驗(yàn)組都檢出大腸埃希菌、陰性菌對照組都未檢出金黃色葡萄球菌,表明16個廠家的樣品控制菌檢查方法驗(yàn)證試驗(yàn)成立,實(shí)驗(yàn)中同時取1∶10供試液10 mL或1 mL按常規(guī)法進(jìn)行控制菌檢查,均未檢出大腸埃希菌和大腸菌群。
5 討論
5.1 在實(shí)驗(yàn)過程中,采用常規(guī)法檢查時,16個廠家生產(chǎn)的復(fù)方丹參片供試品對照組均無菌生長,當(dāng)采用培養(yǎng)基稀釋法和薄膜過濾法檢查時,一些本身染菌的樣品在供試品對照組中檢出染菌數(shù)。可見,在試驗(yàn)條件下不能有效地排除其抑菌作用,就無法檢查出樣品真實(shí)的污染菌數(shù),根據(jù)2005版《中國藥典》相關(guān)規(guī)定,細(xì)菌、霉菌和酵母菌計數(shù)方法驗(yàn)證的回收率應(yīng)不低于 70%[1]附錄71。從表1 ~3 可見,不同廠家生產(chǎn)的復(fù)方丹參片對細(xì)菌和霉菌的抑菌作用強(qiáng)弱不同,需要采用不同的方法去消除其抑菌作用,才能有效檢出該藥品污染存活的細(xì)菌數(shù)量。
5.2 從表2結(jié)果看出,16個廠家生產(chǎn)的復(fù)方丹參片,有4個廠家采用培養(yǎng)基稀釋法,6個廠家采用低速離心加培養(yǎng)基稀釋法,4個廠家采用低速離心加薄膜過濾法,另2個廠家采用薄膜過濾法(1∶100的供試液),金黃色葡萄球菌的回收率才能大于70%。復(fù)方丹參片收載在《中國藥典》2005版一部,處方有丹參、三七、冰片3種中藥,其中丹參、冰片有抑菌作用,其處方、工藝已確定。從實(shí)驗(yàn)結(jié)果得出,不同廠家生產(chǎn)的復(fù)方丹參片其抑菌強(qiáng)弱不同,尤其是對金黃色葡萄球菌抑菌作用差異顯著,估計主要原因是藥材產(chǎn)地、采收時間不同,丹參的質(zhì)量也不同。
5.3 編號為A、I廠家生產(chǎn)的復(fù)方丹參片由于抑細(xì)菌作用太強(qiáng),上述方法均不能排除其抑菌作用。《中國藥典》規(guī)定[11],若沒有適宜的方法消除供試品中的抑菌作用,在不影響檢驗(yàn)結(jié)果判斷的前提下,應(yīng)采用能使微生物生長的更高稀釋級的供試液進(jìn)行方法驗(yàn)證試驗(yàn)。若驗(yàn)證試驗(yàn)符合要求,應(yīng)以該稀釋級供試液作為最低稀釋級的供試液進(jìn)行供試品檢驗(yàn)。考慮到復(fù)方丹參片含有原生藥,標(biāo)準(zhǔn)規(guī)定細(xì)菌數(shù)為10 000個/g,在不影響檢驗(yàn)結(jié)果判斷的前提下,將樣品制備成1∶100的供試液,取1 mL進(jìn)行薄膜過濾。
5.4 由于復(fù)方丹參片具有較強(qiáng)的抗菌活性,通過預(yù)試驗(yàn)結(jié)果,選擇金黃色葡萄球菌為細(xì)菌代表,白色念珠菌為真菌代表進(jìn)行細(xì)菌、霉菌方法確定試驗(yàn),既節(jié)省了大量人力、物力,又能快速建立有效的微生物限度檢查方法。通常,當(dāng)藥品生產(chǎn)條件發(fā)生改變(如更換產(chǎn)地、更換輔料和改變生產(chǎn)工藝等)或原檢驗(yàn)條件發(fā)生改變時,對微生物限度檢查方法應(yīng)進(jìn)行再驗(yàn)證。由于進(jìn)行再驗(yàn)證時,藥品中的活性成分未發(fā)生改變,故其抗菌譜也未改變,因此我認(rèn)為再驗(yàn)證工作僅需針對藥典規(guī)定的全部驗(yàn)證菌株中的最敏感菌株即可,而不必對全部菌株進(jìn)行再驗(yàn)證。采用這種方法,即可保證檢驗(yàn)方法的有效性,又節(jié)省了大量人力、物力,使得驗(yàn)證工作成為日常檢驗(yàn)的一部分成為可能。建議藥典逐漸收載各抗菌藥物的最敏感驗(yàn)證菌株作為質(zhì)控菌株,方便日常工作。
[1]中國藥典[S].一部.2005:527-528.
[2]周 靜,李惠芬,王洪志,等.丹參水溶性成分與脂溶性成分抑菌作用的考察[J].時珍國醫(yī)國藥,2008,19(9):2130.
[3]鄧 婧,許曉燕,袁昌青,等.丹參水煎液對幾種口腔常駐菌的體外抑菌實(shí)驗(yàn)[J].實(shí)用口腔醫(yī)學(xué)雜志,2006,22(4):553.
[4]孫吉蘭,常云亭,宋海英,等.丹參的體外抑菌作用研究[J].時珍國醫(yī)國藥,2003,14(12):725.
[5]朱嘉蓉,羅厚蔚.丹參酮ⅡA的抑菌活性研究[J].中國藥科大學(xué)學(xué)報,2004,35(4):368.
[6]張玉蘭,洪建文,羅翰宇.復(fù)方丹參片微生物限度檢查方法的建立[J].中藥材,2005,28(8):728.
[7]British Pharmacopoeia Commission.British Pharmacopoeia:Apendix XVI B A[S].London:The Stationery Office,2002:315.
[8]Pheur Commission.Europe Pharmacopoeia 5.2[S].Strasbourg:Pheur Commission,2005:2613.
[9]The United States Pharmacopeial Convention.U.S Pharmacopeia/National Formulary 28[S].Washington:U.S Pharmacopeia Origination Press,2005:2752.
[10]Japanese Pharmacopoeia Commission.The Japanese Pharmacopoeia[S].14th.Tokyo:Hirogawa Bookshop,2000:60.
[11]中國藥典[S].一部.2010:附錄81.

