15-KETE對慢性缺氧大鼠肺動脈平滑肌細胞鉀離子通道的作用
張一飛,郭守利,劉 曄,朱大嶺
(1.哈爾濱醫科大學第二臨床醫學院藥學部,哈爾濱 150086;2.哈爾濱醫科大學第二臨床醫學院實驗動物中心,哈爾濱 150086;3.哈爾濱醫科大學藥學院,哈爾濱 150086)
肺血管收縮反應增強和結構重建是低氧性肺動脈高壓(hypoxic pulmonary hypertension,HPH)的重要特征,其主要表現形式是肺血管收縮和中膜平滑肌細胞的增殖和遷移,但其機制尚未明確。近來關于花生四烯酸(arachidonic acid,AA)及其一系列代謝產物在肺動脈收縮節律的調節作用越來越受到人們的關注。15-酮基二十碳四烯酸(15-KETE)是AA的15-脂質氧化酶(15-LO)一種代謝終產物,同時也是AA的15-LO另一種代謝產物15-HETE脫氫氧化產物[1,2]。有研究表明缺氧可上調肺動脈平滑肌細胞15-LO的表達[3],因此缺氧時AA的代謝產物有其相應的細胞分布及相應的作用位點。
電壓門控鉀通道(KV)作為肺動脈平滑肌細胞的氧感受器,在缺氧性肺動脈高壓發病中的重要性越來越受到重視。有研究報道15-HETE通過抑制Kv通道引起肺動脈收縮[3],15-KETE對大鼠肺動脈環的收縮作用比15-HETE更強烈[4],其收縮作用依賴于Kv通道、細胞外液鈣離子和L-型鈣離子通道[5],外源性15-KETE能濃度依賴性地抑制常氧大鼠PASMCs IK[6]V。本實驗觀察了15-KETE對缺氧大鼠PASMCs IKV的影響,并與其對常氧大鼠PASMCs IKV的作用加以比較,為進一步闡明15-KETE收縮肺動脈離子通道機制提供依據。
1 材料和方法
1.1 材料
1.1.1 實驗動物:12只健康雄性SD大鼠,體重200±20g,由哈爾濱醫科大學實驗動物學部提供[SCXK(黑)2006-033]。
1.1.2 藥品與試劑:膠原酶I型,彈性酶,BSA,TEA,Na2ATP,Na2GTP,HEPES和BAPTA(Sigma,美國);DTT(Roche,美國),15-KETE(Biomol,美國),其余試劑均為國產分析純產品。
1.1.3 主要儀器:體視解剖顯微鏡(SMZ-168,Motic),膜片鉗儀,Axopatch 200B,USA;數-模轉換器,DigiData 1322A,USA;Olympus IX-70倒置顯微鏡,Japan;三維液壓推進儀,Narishige Co LTD,Japan;微電極拉制儀,Narishige Co LTD,Japan。
1.1.4 液體配制:(1)生理鹽溶液(physiological salt solution,PSS):成分(mmol/L):NaCl 130、KCl 5、MgCl21.2、CaCl21.5、HEPES 10和glucose 10;分離細胞用無鈣PSS液,CaCl2由等摩爾的MgCl2取代,用NaOH調pH7.4。(2)灌流液:同PSS液,記錄Kv時含1mmol/L TEA灌流液,灌流速度為1mL/min。(3)電極內液(Pipette solution,mmol/L):KCl 125,Na2ATP 5,Na2GTP 0.5,MgCl24,CaCl22,HEPES 10,BAPTA 10),5mol/L KOH調至pH 7.2,GTP提供信號轉導通路的底物,ATP一方面提供能量代謝所需底物,一方面抑制IKATP。
1.2 方法
1.2.1 動物模型的制作:參見文獻[7],將12只健康雄性SD大鼠,隨機分為兩組(n=6),一組置于正常的培養箱中,其吸入氧(FiO2)濃度為21%,作為正常組;一組置于缺氧的培養箱中,其吸入氧濃度為10%,連續飼養9d,培養箱內大鼠呼出的CO2、水蒸氣分別用氧化鈣和無水氯化鈣吸收,排出的氨氣由硼酸吸收,大鼠自由采食和飲水。
1.2.2 大鼠肺動脈壓力和右心室肥厚的檢測:飼養9d后,大鼠經1.5%戊巴比妥鈉(40mg/kg)腹腔注射麻醉后,固定于手術臺上,分離出右外頸靜脈并剪一小切口,插入聚乙烯導管經右心室至肺動脈,另一端接壓力感受器,以RM-6000型多導生理儀測定肺動脈平均壓(mPAP)。然后剖胸取出大鼠心臟,剪去心房組織,沿室間隔邊緣分離右心室(RV)和左心室+室間隔(LV+S),將殘血沖靜后,用濾紙將水吸干,自然干燥片刻后,稱量RV和LV+S,以RV/(LV+S)比值反映右心室肥厚程度。
1.2.3 大鼠單個肺動脈平滑肌細胞的急性分離[8]:SD大鼠經1.5%戊巴比妥鈉(40mg/kg)麻醉后,迅速開胸取出心和肺,放入盛有4℃的生理鹽溶液的燒杯中洗去血液,剪下肺葉移入冰浴盛有生理鹽溶液硅膠板的培養皿中,用大頭釘把肺葉固定在硅膠板上,體視顯微鏡下分離肺內小動脈(內徑300~700μm),放入含1.5mg/mL膠原酶的生理鹽溶液中孵育20min,用顯微外科剪刀細心的剝離掉肺動脈外的一薄層結蒂組織及外膜,沿長軸剪開,用濕棉球輕擦去除內皮,以上過程均通以95%O2和5%CO2,剩下的平滑肌剪成1mm×1mm的組織塊,然后用含2.0mg/mL膠原酶和0.5mg/mL彈性酶的生理鹽溶液37℃消化45min,用吸管輕輕吹打,使之分散成單個細胞。分離好的細胞懸液置于4℃冰箱保存,6h內可用于膜片鉗實驗。
1.2.4 全細胞膜片鉗實驗[9]:取幾滴細胞懸液于細胞池,靜置20~30min,使細胞充分貼壁,然后平放在倒置顯微鏡上,選取胞膜光滑,胞核清晰,胞漿均勻的細胞進行膜片鉗實驗。記錄電極用玻璃毛細管,經電極拉制儀兩步法拉制成微電極,阻抗為3~5MΩ。采用全細胞膜片鉗記錄方法,在電流鉗下記錄細胞膜電位(Em),在電壓鉗下記錄Kv電流。記錄電流時,鉗制電壓為-60mV,給予從-60mV至+50mV,階躍電壓為10mV,脈沖時間為400ms的去極化刺激12次,頻率為0.2Hz;信號采集頻率:10kHz,濾波頻率:2kHz。采樣后數據由pClamp7.0軟件自動記錄,存儲于計算機硬盤內供測量分析。細胞外給藥采用排管給藥法,即通過三維操縱器移動快速換藥裝置的排管進行,排管每管直徑為0.2mm,管口距所記錄的細胞約100μm。所有的實驗均在室溫(22℃~24℃)進行。
1.2.5 數據處理:抑制率的計算:抑制率=(用藥前的峰電流值-用藥后的峰電流值)/用藥前的峰電流值×100%。所有結果用±s表示,采用SAS軟件進行統計學分析,自身對照用配對t檢驗,組間資料的比較用非配對t檢驗,用Origin7.5軟件包作圖。
2 結果
2.1 慢性缺氧大鼠模型的建立
檢測結果表明,經過9d飼養后,缺氧組大鼠mPAP、RV、RV/(LV+S)均顯著高于對照組,顯示慢性缺氧大鼠模型復制成功(表1)。

表1 慢性缺氧大鼠的肺動脈平均壓和右心室/(左心室+室間隔)的變化(n=6)Tab.1 The change of mPAP and RV/(LV+S)of rats exposed to chronic hypoxia(n=6)
2.2 慢性缺氧對大鼠PASMCs影響
2.2.1 慢性缺氧對大鼠PASMCs Em、Cm影響:分別在電流鉗制模式、斜坡刺激模式記錄正常組和缺氧組大鼠PASMCs靜息膜電位(Em)、膜電容(Cm)的變化,結果發現慢性低氧可明顯引起PASMCs去極化,但對PASMCs的Cm并沒有顯著的影響(表2)。

表2 慢性缺氧對大鼠PASMCs Em、Cm的影響(n=6)Tab.2 Effect of chronic hypoxia on Em,Cm in rat PASMCs(n=6)
2.2.2 慢性缺氧對PASMCs IKV的影響:在電壓鉗模式下記錄正常組和缺氧組大鼠PASMCs全細胞電壓門控鉀電流(IKV)的變化,結果發現低氧明顯抑制IKV,-20mV時電流從(26±6)pA/pF降至(21±3)pA/pF,+50mV時從(136±24)pA/pF降至(98±12)pA/pF,(P<0.01,n=6),抑制率分別為(20.1±1.2)%和(28.4±2.4)%(圖1)。從全細胞電流圖及I-V曲線可以看出,低氧并沒有改變IKv的活化閾值及基本電流特征。
2.3 15-KETE、4-AP、TEA對慢性低氧大鼠PASMCs的影響
2.3.1 15-KETE、4-AP、TEA對慢性低氧大鼠PASMCs Em和Cm的影響:分別在電流鉗制模式和斜坡刺激模式下記錄大鼠PASMCs靜息膜電位(Em)和膜電容(Cm)。分別在用藥前1min,用藥時2min和用藥后3min記錄15-KETE(1×10-8mol/L、1×10-7mol/L、1×10-6mol/L)、TEA(1×10-3mol/L)對慢性低氧大鼠PASMCs Em和Cm的影響。結果發現15-KETE、4-AP、TEA對慢性低氧大鼠PASMCs Cm無影響(表3);15-KETE、4-AP均可引慢性低氧大鼠PASMCs起PASMCs去極化,TEA對慢性低氧大鼠PASMCs Em無影響(表2)。

圖1 慢性缺氧對PASMCs IKV的影響Fig.1 Effect of chronic hypoxia on KVcurrent in PASMCs
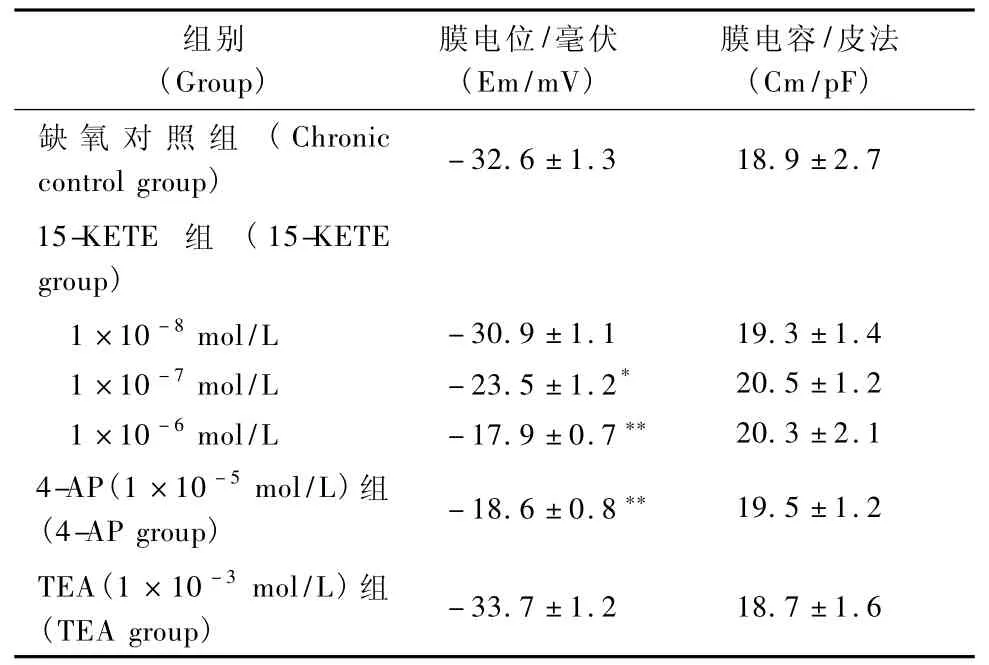
表3 15-KETE、4-AP、TEA對慢性低氧對大鼠PASMCs Em和Cm的影響(n=6)Tab.3 Effect of 15-KETE、4-AP,TEA on Em,Cm in chronic hypoxic rat PASMCs(n=6)
2.3.2 15-KETE對慢性缺氧PASMCs IKV的影響:采用排管給藥法觀察各濃度(1×10-8~1×10-6mol/L)15-KETE對IKV的影響。結果表明,15-KETE于3min內作用穩定,每間隔3min給一個藥物濃度,結果發現15-KETE對IKV的影響呈濃度依賴性抑制,隨著濃度的增加,15-KETE使其I-V曲線明顯下移(圖2)。

圖2 不同濃度的15-KETE對慢性缺氧大鼠SMCs的IKV影響Fig.2 Effect of varying concentration of 15-KETE on IKv of PASMCs
2.3.3 15-KETE對正常和慢性缺氧大鼠PASMCs的IKV抑制率的比較:在急性分離的正常和缺氧的大鼠肺動脈平滑肌上,封接破膜形成全細胞記錄方式,將膜電位鉗制在-60mV,給予-60mV至+50mV(步幅為10mV)去極化方波刺激,于封接破膜形成全細胞記錄后第1min在浴槽內采用排管給藥法觀察各濃度下(1×10-8~1×10-6mol/L)15-KETE對常氧、慢性缺氧PASMCs IKV的影響。15-KETE約于3min內作用穩定,每間隔3min給一個藥物濃度,結果發現在兩種情況下15-KETE對IKV的影響呈濃度依賴性抑制。低濃度15-KETE(1×10-8mol/L)對常氧、慢性缺氧PASMCs IKV的平均阻抑率無顯著差異。較高濃度15-KETE(1×10-7、1×10-6mol/L)對缺氧PASMCs IKV的平均阻抑率顯著高于常氧PASMCs(圖3)。
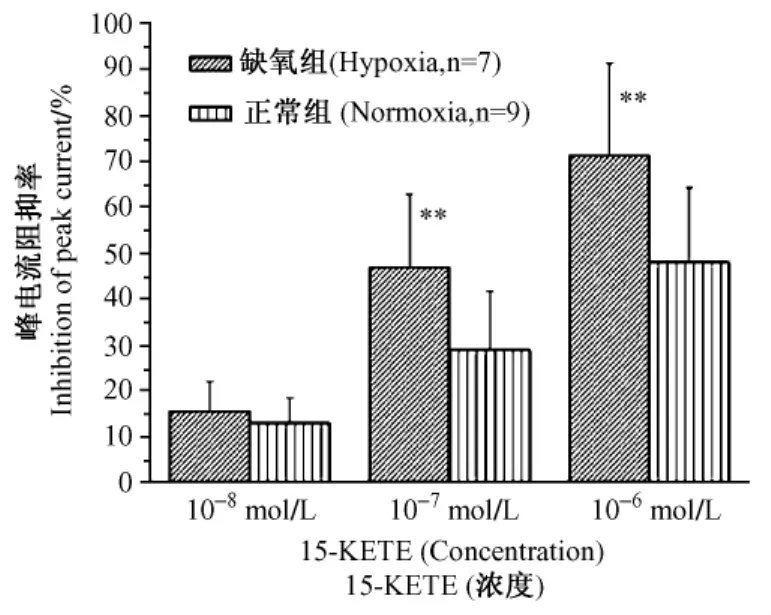
圖3 15-KETE對正常和慢性缺氧大鼠PASMCs的IKV抑制率的比較Fig.3 Comparison of IKVinhibition induced by 15-KETE on rat PASMCs from normoxia and chronic hypoxia
3 討論
已知大鼠PASMCs至少上存在3種鉀通道,分別是延遲整流鉀通道(Kv)、鈣激活的鉀通道(KCa)和ATP敏感的鉀通道(KATP),目前的研究表明,Kv在控制靜息膜電位及氧感受方面起著重要的作用[10]。
本研究表明,在常氧和低氧兩種情況下,Kv阻斷劑4-AP均可引起PASMCs去極化,即Em負值升高,且這種變化在常氧和低氧時無差異,這說明低氧并沒有改變Kv在控制Em方面的基礎作用。而特異性的KCa阻斷劑TEA無論在常氧還是低氧情況下對Em均無影響,說明KCa對調節Em不起作用,這可能是因為KCa的激活電位高于Em所致[11]。
本研究結果表明,慢性低氧大鼠PASMCs Kv通道電流密度明顯減少,但單位細胞的電容即表面積無明顯變化,提示單位細胞的Kv通道電流幅度降低是電流密度變化的主要原因。但也有報道低氧對IKv無影響[12],這可能是因為培養的細胞與新鮮急性酶分離的細胞離子通道的特性發生了變化,抑或是因為動物的種屬、體內或體外缺氧的不同,以及后者的PASMCs來源于主肺動脈所致。本研究中PASMCs來源于肺內動脈4~6級分支,而這些動脈中Kv細胞占優勢[11]。低氧抑制PASMCs IKv的機制目前尚未闡明,這可能是因為低氧引起PASMCs表型轉化、PKC上調、抑制了低氧敏感性鉀通道的表達[13],或是通過其他影響PASMCs增殖的轉錄因子,間接抑制IKv,如c-jun的過度表達不僅可以抑制PASMCs Kv活性,并可抑制Kv基因的表達[14]。
15-KETE是AA的15-脂質氧化酶(15-LO)一種代謝終產物。由于缺氧可上調肺動脈平滑肌細胞15-LO的表達[3],因此15-KETE在PASMCs有其相應的細胞分布及相應的作用位點。我們先前研究表明,15-KETE以濃度依賴性方式強烈收縮離體肺動脈環[4],并且收縮作用依賴于Kv通道、細胞外液鈣離子和L-型鈣離子通道[5]。另有研究表明,缺氧抑制PASMCs上的K+通道,主要是Kv通道[15]。因此,15-KETE可能是聯系缺氧與Kv通道之間的重要介質。
本研究發現,15-KETE在常氧和慢性低氧時均可引起Em的升高,但升高的程度并無差異,不同的是慢性低氧時,較高濃度15-KETE對IKv的抑制作用明顯強于常氧時,這說明低氧可能改變了PASMCs對一些內源性因子的敏感性。
先前的研究已經證明,在有鈣的環境中,15-KETE對常氧PASMCs IKv的抑制作用明顯增強[6]。因此,本研究中慢性低氧時15-KETE對IKv的抑制作用加強,可能與慢性低氧時PASMCs細胞內鈣水平增高有關[16]。
另外,本實驗發現慢性低氧及15-KETE對肺動脈平滑肌細胞的Cm沒有影響,說明兩者均不能改變肺動脈平滑肌細胞的大小。
[1]Bergholte JM,Soberman RJ,Hayes R,et al.Oxidation of 15-hydroxyeicosatetraenoic acid and other hydroxy fatty acids by lung prostaglandin dehydrogenase[J].Arch Biochem Biophy,1987,257:444-450.
[2]Landino LM,Marnett LJ.Mechanism of hydroperoxide reduction by mangano-prostaglandin endoperoxide synthase[J].J Biol Chem,1996,35:2637-2743.
[3]Daling Z,Medhora M,Campbell WB,et al.Chronic hypoxia activates lung 15-lipoxygenase,which catalyzes production of 15-HETE and enhances constriction in neonatal rabbit pulmonary arteries[J].Circ Res,2003,92:992-1000.
[4]郭守利,張嘉保,劉曄,等.15-HETE及其代謝產物對大鼠離體肺動脈環作用的比較[J].中國比較醫學雜志,2006,16(12):716-719.
[5]郭守利,張一飛,劉曄,等.15-酮基二十碳四烯酸對大鼠離體肺動脈環的作用[J].中國藥理學通報,2006,22(11):1339-1343.
[6]郭守利,張一飛,劉曄,等.15-KETE對大鼠肺動脈平滑肌細胞鉀離子通道的作用[J].中國實驗動物學報,2007,15(4):275-279.
[7]Baker EJ,Boerboom LE,Olinger GN,et al.Tolerance of the developing heart to ischemia:impact of hypoxemia from birth[J].Am J Physiol,1995,268:H1165-1173.
[8]Platoshyn O,Yu Y,Golovina VA,et al.Chronic hypoxia decreases KV channel expression and function in pulmonary artery myocytes[J].Am J Physiol Lung Cell Mol Physiol,2001,280:L801-L812.
[9]駱紅艷,唐明,杜以梅,等.大鼠肺動脈平滑肌細胞的分離及電壓門控性鉀電流的記錄方法[J].微循環學雜志,2005,15:9-11.
[10]Gurney AM,OsipenkoON,MacMillanD,etal.Potassium channels underlying the resting potential of pulmonary artery smooth muscle cells[J].Clin Exp Pharm acol Physiol,2002,29:330-333.
[11]Archer SL,Huang JM,Reeve HL,et al.Differential distribution of elctrophysiologically distinct myocytes in conduit and resistance arteries determines their response to nitric oxide and hypoxia[J].Circ Res,1996,78:431-442.
[12]Peng W,Hoidal JR,Karwande SV,et al.Effect of chronic hypoxia on K+channels:regulation in human pulmonary vascular smooth muscle cells[J].Am J Physiol,1997,272:C1271-1278.
[13]Platoshyn O,Yu Y,Golovina VA,et al.Chronic hypoxia decreases KV channel expression and function in pulmonary artery myocytes[J].Am J Physiol Lung Cell Mol Physiol,2001,280:L801-L812.
[14]Yu Y,Platoshyn O,Zhang J,et al.c-Jun decreases voltagegated K+channel activity in pulmonary artery smooth muscle cells[J].Circulation,2001,104:1557-1563.
[15]Takahashi T,SomaS,Muramatsu M,etal.Discrepant distribution of big endothelin(ET)-1 and ET receptors in the pulmonary artery[J].Eur Respir J,2001,18:5-14.
[16]樊再雯,張珍祥,徐永健.鉀通道對大鼠肺動脈平滑肌細胞[Ca2+]i的調節[J].中國病理生理雜志,2004,20:150-153.

