玉米EMS誘變材料的抗旱性篩選
張明義 ,王 翔 ,張彥芹 ,梁改梅 ,楊麗莉 ,周小梅 ,董春林 ,孫 潔
(1.山西省農業科學院旱地農業研究中心,山西 太原 030031;2.山西大學生命科學學院,山西 太原 030006)
我國干旱、半干旱耕地面積約占全國總耕地面積的50%,干旱已成為限制作物高產、穩產的重要因素。北方地區常發生春旱,給玉米生產帶來巨大損失[1]。水資源短缺、氣候干旱問題具有不斷加重的趨勢,對糧食生產構成了嚴重威脅。作物的抗旱性研究越來越受到人們重視[2]。
山西地處黃土高原,降水少,蒸發量大,干旱常常導致作物嚴重減產。因此,選育和應用抗旱耐逆的高產穩產作物品種就顯得尤為迫切[3-4]。通過誘變技術創造抗、耐旱作物新種質,是培育抗旱優良新品種的有效途徑。目前,化學誘變劑甲基磺酸乙酯(EMS)在農作物誘變育種中得到了較廣泛的應用,尤其在對玉米遺傳誘變新種質選擇方面的效果最好[5-8]。自2006年以來,山西省農業科學院旱地農業研究中心利用EMS化學誘變技術開展了玉米抗旱新種質的創新研究,對鄭58、昌7-2等幾個玉米骨干自交系進行了大量的EMS誘變處理和選擇,先后獲得了一批遺傳穩定、抗逆和農藝性狀優良的新種質。
本試驗對以玉米自交系鄭58為EMS誘變材料、經M5選擇的15個新種質材料進行抗旱相關指標的測定,對其抗旱性進行綜合評價,旨在為培育抗旱新品種提供新的種質。
1 材料和方法
1.1 供試材料
試驗材料為玉米自交系鄭58及其用EMS誘變選擇的M5變異材料(表1)。
1.2 幼苗水分脅迫
種子萌發參照范翠麗等[1]的方法進行。待幼苗生長到3葉1心時,用5%PEG-6000溶液進行脅迫,處理1 d后,換用10%PEG-6000溶液脅迫2 d,隨后測定各項與抗旱相關的生理生化指標。

表1 供試玉米材料
1.3 失水速率及丙二醛、可溶性糖、脯氨酸含量的測定
用葉片失水速率[9]表示保水能力的強弱。用TBA比色法測定丙二醛含量[10];用蒽酮比色法測定可溶性糖含量[10];用磺基水楊酸法測定脯氨酸含量[10]。
1.4 誘變系的隨機PCR鑒定
玉米DNA提取采用CTAB法[11]。RAPD反應在PE-480 PCR儀上進行。擴增反應溶液體積為20 μL,其中,ddH2O 13 μL,10×buffer (含 20 mmol/LMgCl2)2 μL,dNTP (2.5 mmol/L)0.5 μL,primer(10μmol/L)1μL,Taq 酶(5U/μL)0.5μL,DNA3 μL。PCR反應程序為:94℃預變性3 min;94℃變性 1 min,50℃退火 0.5 min,72℃延伸1.2 min,擴增36個循環;72℃延伸10 min,最后在4℃保存。擴增產物經1.5%瓊脂糖凝膠電泳進行檢測。
2 結果與分析
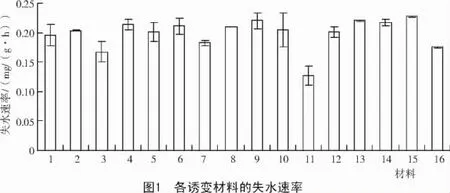
2.1 不同誘變材料失水速率的比較
PEG脅迫后16份玉米材料幼苗的失水速率如圖1所示。從圖1可以看出,測試材料失水速率的變化在0.13~0.23 mg/(g·h)之間,表明各材料在抗旱性上存在差異。11號(Y1020-2)的保水力最高(失水速率最低),其次是3號(Y1002-1)、16 號(Y1027-1)、7 號(Y1010-2),從保水方面看,這幾個材料的抗旱性較好。
2.2 不同誘變材料丙二醛含量的比較
植物在逆境條件下,往往會發生膜脂過氧化作用,其產物之一是丙二醛(MDA),其含量的高低可以代表細胞膜的膜脂過氧化程度和細胞膜的受損傷大小,可用于衡量植物在逆境條件下抗性的強弱。從圖2可以看出,16份材料中的7號(Y1010-2)MDA含量最低,為 1.36×10 μmol/g,即在此指標下的抗旱性最好;其次是3號(Y1002-1)、16 號(Y1027-1)、9 號(Y1017-1)玉米材料,也有較好的抗旱性。

2.3 不同誘變材料可溶性糖含量的比較
植物為了抵抗干旱等不良環境造成的細胞脫水,往往會主動積累一些可溶性糖和氨基酸來降低滲透勢和冰點,以適應外界環境的變化。PEG脅迫后的16個玉米材料體內的可溶性糖含量如圖3所示,7號(Y1010-2)的可溶性糖含量最高,達2.78%,其次是16號(Y1027-1)、4號(Y1003-3)、8號(Y1015-1)。各供試材料的可溶性糖含量存在差異,表明它們在干旱脅迫下對細胞滲透調節能力的大小不同,進而在抗旱性上存在差異。

2.4 不同誘變材料脯氨酸含量的比較
在干旱條件下,植物體內脯氨酸的含量會顯著增加。抗旱性強的品種往往會積累較多的脯氨酸,因此,植物體內脯氨酸含量在一定程度上可以反映植物的抗逆性,常作為抗旱育種的生理指標。由圖4可知,供試材料中,以5號(Y1004-6)的脯氨酸含量最高,為4.3 mg/100 g;含量較高的材料還有 7號(Y1010-2)、16號(Y1027-1),表明它們的抗旱性也較好。

2.5 抗旱性的綜合評價
采用抗旱性隸屬函數法[12]分析比較,綜合評價誘變材料的抗旱性,結果列于表2。從表2綜合評價可以得出,有10個誘變系的抗旱性比對照高,處于前 4 位的是 7,16,11,5 號,它們與鄭58相比,優勢很明顯,這一篩選結果同田間種植的玉米植株在干旱脅迫后所觀察到的生長狀況基本一致。

表2 不同誘變材料抗旱性綜合評價
2.6 誘變材料DNA的變異
從40個隨機引物中篩選出1個具有明顯擴增差異的引物S38,序列為ATTGTACCGT,隨機PCR 擴增結果如圖 5所示,5號(Y1004-6)、7號(Y1010-2)、13 號(Y1022-4)、16 號(Y1027-1)與1號(鄭58)的差異較為明顯,表明經EMS誘變后玉米DNA發生了質的變化。

3 討論
干旱對于作物的各種生理過程有著廣泛而深刻的影響,作物在抗旱性方面所表現出的差異都有其相應的生理生化基礎,玉米的抗旱性是多種生理生化綜合作用的結果。迄今為止,已有許多學者進行了玉米抗旱性評價指標的研究,提出了一系列評價指標體系[13-15],所得的結果表明,在干旱條件下離體葉片的抗脫水能力、丙二醛含量、外滲電導率、還原性酶活性、滲透調節能力等可作為玉米抗旱性鑒定評價的良好指標。宋鳳斌等[3,15]研究表明,玉米脯氨酸含量、丙二醛含量和可溶性糖含量等生理指標與玉米抗旱性存在較好的相關性,可作為玉米抗旱性鑒定指標。
本研究對供試15個誘變材料的抗旱性綜合評價結果與其田間水、旱地種植進行抗旱性鑒定的結果基本一致,說明抗旱性鑒定所采用的生理生化指標是有效的,可用于玉米抗旱種質材料的輔助選擇。
[1]范翠麗,陳景堂,李育峰,等.玉米苗期及萌芽期抗旱性評定方法篩選[J].玉米科學,2007,15(3):114-117.
[2]武明宇,郝楠.玉米抗旱性的研究進展 [J].現代農業科技,2008(9):124.
[3]劉永忠,李齊霞,孫萬榮,等.氣候干旱與作物干旱指標體系[J].山西農業科學,2005,33(3):50-53.
[4]張健,池寶亮,黃學芳,等.玉米萌芽期水分脅迫的抗旱性分析[J].山西農業科學,2007,35(2):34-38.
[5]焦楊,陳志斌,刁鈺嬋,等.玉米EMS誘變后代變化趨勢的研究[J].安徽農業科學,2007,35(26):8143-8144.
[6]趙永亮,宋同明.玉米化學誘變研究進展 [J].華北農學報,1996,11(4):24-28.
[7]程志鋒,楊文香,劉大群.60Coγ射線與EMS對小麥近等基因系TcLr10的復合誘變[J].華北農學報,2008,23(增刊):92-95.
[8]安偉,樊智翔,馬海林,等.EMS誘變技術及其在創造玉米新種質中的應用[J].山西農業科學,2008,36(12):37-39.
[9]孔祥生,易現峰.植物生理學實驗技術[M].北京:中國農業出版社,2008.
[10]李合生.植物生理生化實驗原理和技術[M].北京:高等教育出版社,2000.
[11]Clark MS.植物分子生物學實驗手冊[M].顧紅雅,瞿禮嘉,譯.北京:高等教育出版社,1998.
[12]孫群,胡景江.植物生理學研究技術[M].楊凌:西北農林科技大學出版社,2006.
[13]李壯,許文娟,薛兵東,等.玉米苗期抗旱性評定方法探討[J].玉米科學,2004,12(2):74-75.
[14]宋鳳斌,徐世昌.玉米抗旱性鑒定指標的研究[J].中國生態農業學報,2004,12(1):127-129.
[15]黎裕,王天宇,劉成,等.玉米抗旱品種的篩選指標研究[J].植物遺傳資源學報,2004,5(3):210-215.

