尼可剎米對丙泊酚抑制新生大鼠延髓腦片呼吸放電的拮抗作用*
宋曉榮,千智斌,姬明麗
1)新鄉醫學院病理生理學教研室新鄉 453003 2)新鄉醫學院機能學實驗室新鄉 453003
△女,1963年7月生,本科,副教授,研究方向:基本節律性呼吸發生調劑機制,E-mail:sxrong308@163.com
丙泊酚由于起效快、清除迅速和不良反應少等優點近年來被廣泛應用于臨床麻醉,但存在抑制呼吸的不良反應,表現為潮氣量減少,清醒狀態時可使呼吸頻率增加及靜脈注射常發生呼吸暫停等現象[1]。尼可剎米臨床上常用做非特異性呼吸興奮劑,可直接興奮延髓呼吸中樞,也可通過刺激頸動脈體和主動脈體化學感受器反射性興奮呼吸中樞,提高呼吸中樞對 CO2的敏感性,增加中樞吸氣驅動[2]。為明確尼可剎米對丙泊酚所引起的呼吸中樞抑制有無拮抗作用,作者采用新生大鼠延髓腦片,通過記錄腦片產生的基本節律性呼吸放電觀察尼可剎米對丙泊酚的作用。
1 材料與方法
1.1 實驗動物與試劑 SD大鼠 6只,日齡 1~3 d,體質量(4.7±0.9)g,雌雄不限,由新鄉醫學院實驗動物中心提供。尼可剎米、丙泊酚購自Sigma公司,其余試劑為國產分析純。
1.2 離體延髓腦片標本的制作 參考Suzue[3]的方法制作大鼠離體延髓-脊髓標本。大鼠用乙醚麻醉后在 C3~C4節段斷頭,在延髓-腦橋間迅速橫斷腦干,去除顱骨及腦橋以上的腦組織,剪開延髓背側顱骨,小心分離至 C1~C2段脊髓,游離出延髓-脊髓,完整保留舌下神經根。整個過程均在持續充以體積分數95%O2和5%CO2的0℃改良Kreb's液(MKS)中進行,3min內完成標本制作。迅速將標本頭端向上移至切片槽內,腹側面朝向刀刃,刀刃朝向頭端傾斜20°,在閂前 600μm至閂后 100μm間切下延髓腦片(含舌下神經根)。將腦片置于灌流槽內,以MKS(2~4 mL/m in)持續灌流,保持pH 7.35~7.45,溫度 27~29℃。用內含銀-氯化銀的吸附電極加以負壓吸附舌下神經根,將呼吸相關節律性放電活動(RRDA)經直流前置放大器放大后輸入BL-420F生物信號采集和處理系統進行記錄和分析。
1.3 分組與處理及觀測指標 6個穩定記錄到RRDA的新生大鼠延髓腦片標本先用MKS灌流腦片15min(T0),后用含40μmol/L丙泊酚的MKS灌流腦片20 min(T1),然后洗脫,待RRDA基本恢復后用含40μmol/L丙泊酚加5 mg/L尼可剎米的MKS灌流腦片20 min(T2),記錄3個給藥階段舌下神經根RRDA,分析RRDA吸氣時程(TI)、放電幅度積分(IA)和呼吸周期(RC)的變化。
1.4 統計學處理 采用SPSS 13.0進行分析。應用重復測量數據的方差分析比較 3個給藥階段 TI、IA和RC的差異,檢驗水準α=0.05。
2 結果
3個給藥階段TI、IA和RC比較結果見表1。
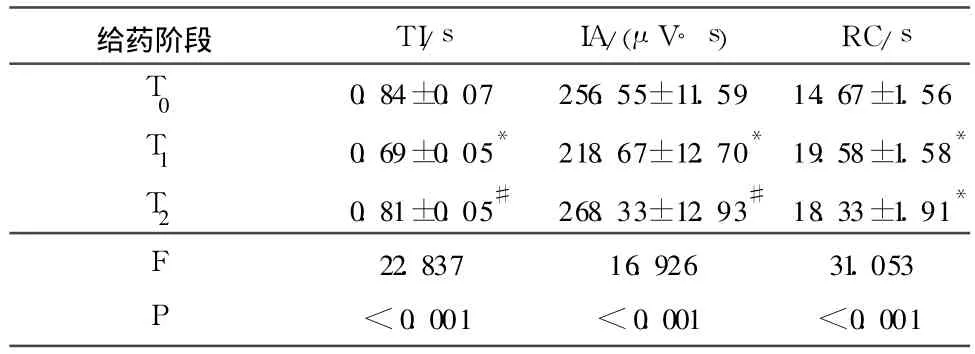
表1 3個給藥階段TI、IA和RC比較(n=6)
3 討論
該研究是在離體的延髓腦片上進行的。雖然離體腦片失去了高位中樞的調節作用,缺少了在體時的外周反饋性輸入,它的環境溫度也不同于在體動物的腦脊液溫度,并且腦片上舌下神經的放電周期明顯長于在體動物的呼吸周期,但兩者呼吸運動神經元的活動形式極為相仿[4];而且,延髓腹側不同類別呼吸神經元的空間分布和沖動發放的時序先后都與在體情況相似[5]。這些均表明離體延髓腦片對于研究呼吸節律的產生和調節機制是良好的簡化標本。作者在預實驗中使用6個延髓腦片標本,以MKS灌流70min,分別在10、20、30、40、50和60min時測量連續6個RRDA的TI、IA和RC,重復測量數據的方差分析顯示不同時間點 3個指標的差異無統計學意義,說明該實驗模型穩定可靠。
丙泊酚的麻醉作用是通過激活 γ-氨基丁酸 A (GABAA)受體而實現,激活GABAA受體對新生大鼠延髓腦片基本節律性呼吸放電有抑制作用[6]。臨床劑量的丙泊酚可增強GABAA受體的氯離子傳導,使神經元超級化,從而抑制神經元的興奮性而達到麻醉效果[7]。也有報道[8]丙泊酚可抑制神經元鈉電流。該研究結果示丙泊酚可縮短TI,降低 IA,延長RC,說明丙泊酚對呼吸放電有抑制作用,與上述文獻相符。研究[9]顯示,尼可剎米可通過 ROS促使PKC的活性增加,PKC抑制GABAA受體活性從而產生興奮作用;此外,尼可剎米可增加新生大鼠海馬神經元鈉電流[10]。該研究結果顯示尼可剎米可使IT、IA升高,恢復到正常水平,而對RC無影響,說明尼可剎米可能通過上述機制拮抗了丙泊酚對延髓腦片RRDA的抑制作用。
綜上所述,丙泊酚對新生大鼠延髓呼吸中樞有抑制作用,尼可剎米可部分拮抗該抑制作用。
[1]趙璞,張衛.舒芬太尼復合丙泊酚在無痛膀胱鏡檢查中的應用[J].鄭州大學學報:醫學版,2010,45(6):1017
[2]楊海燕,何成.尼可剎米聯合納洛酮治療肺性腦病 21例臨床療效觀察[J].中國醫療前沿,2010,5(20):33
[3]Suzue T.Respiratory rhythm generation in the in vitro brain-spinal cord preparation of the neonatal rat[J].J Physiol,1984,354:173
[4]Richter DW,Schmidt-Gareon P,Pierrefiche AM,et al. Neurotransmitters and neuromodulators controlling the hypoxic respiratory response in anaesthetized cats[J].JPhysiol,1999,514(2):567
[5]Greer JJ,Smith JC,Feldman JL.Role of excitatory am ino acids in the generation and transmission of respiratory drive in neonatal rat[J].JPhysiol,1991,437:727
[6]千智斌,姬明麗,齊瑩,等.γ-氨基丁酸A受體對新生大鼠基本節律性呼吸的調節作用[J].實用兒科臨床雜志,2008,23(6):460
[7]孫雪華,曾邦雄.丙泊酚的麻醉作用機制[J].臨床麻醉學雜志,2008,24(4):364
[8]Martella G,De Persis C,Bonsi P,et al.Inhibition of persistent sodium current fraction and voltage-gated L-type calcium current by propofol in cortical neurons:implications for its antiepilep tic activity[J].Epilepsia,2005,46 (5):624
[9]Abram ian AM,Comenencia-Ortiz E,Vith lani M,et al. Protein kinase C phosphorylation regu latesmembrane insertion of GABAA receptor subtypes thatmediate tonic inhibition[J].JBiol Chem,2010,285(53):41795
[10]千智斌,姬明麗,宋曉榮.尼可剎米對新生大鼠海馬神經元鈉通道的影響[J].鄭州大學學報:醫學版,2009, 44(6):1245

