燃料電池電極方程式的書寫
沈小祥
燃料電池電極方程式的書寫
沈小祥
(江蘇省如東高級中學江蘇如東226401)
燃料電池是一種不經過燃燒,通過化學反應將燃料的化學能直接轉化為電能的裝置。很多中學生對其電極方程式的書寫有困難,文章按照電解質的不同,介紹了水性電解質、固體氧化物電解質和熔融碳酸鹽電解質等類型的燃料電池的電極反應方程式的書寫方法。
燃料電池;電極方程式;水性電解質;固體氧化物;熔融碳酸鹽
燃料電池是一種不經過燃燒,而通過化學反應將燃料的化學能直接轉化為電能的裝置。其放電過程無污染、無噪音、高效率,是一種綠色電池。燃料電池雖然種類多樣,但其基本結構類似:電極材料一般是惰性電極,具有很強的催化能力,如鉑電極、活性炭電極等,還原劑(燃料)在電池的負極發生反應,氧化劑(通常是氧氣或空氣)在電池的正極發生反應,其組成一般可表示為:(-)燃料—電解質—O2(+)。常見的電解質有水性電解質、固體氧化物電解質和熔融碳酸鹽電解質等。以下根據燃料電池電解質的不同,介紹其電極反應方程式的書寫方法:
一、水性電解質(酸性、中性或堿性的溶液)
燃料電池電極反應方程式的書寫比較復雜,但有一定規律可循,通常按下述三個步驟可以順利寫出電極方程式:
1.寫總反應:電化學反應的最終產物與燃料燃燒的產物相同,可以根據燃料的燃燒反應寫出燃料電池的總反應。
2.寫出正極反應:燃料電池的正極為O2得電子的反應,1個O2分子得到4個電子轉變成2個O2-,但應注意O2-在電解質溶液中不能穩定存在,如果是酸性電解質,O2-要結合H+生成H2O:O2+4e-+4H+=2H2O;如果電解質溶液顯堿性或中性,則O2-與H2O結合生成OH-:O2+4e-+ 2H2O=4OH-。
3.根據電池的總反應和正極反應湊出負極反應,要求正、負極反應相加能得到總反應。該步驟的技巧是要將總反應方程式和正極反應中O2前的計量數化為相同值,然后相減。
例1.寫出氫氧燃料電池分別以稀H2SO4、NaOH和Na2SO4溶液作電解質時的電極反應。
解析:氫氧燃料電池的組成可以表示為(-)H2—電解質—O2(+),H2在負極參加反應被氧化為H+,H+在酸性或中性溶液中能穩定存在,但在堿性溶液中,H+要與電解質溶液中的OH-結合生成H2O。O2在正極參加反應,根據前面的介紹,可以寫出O2在不同電解質溶液中的電極反應。

將這些正負極反應疊加起來,得到氫氧燃料電池的總反應都是2H2+O2=2H2O。
例2.寫出甲烷燃料電池以KOH為電解質的電極反應方程式。
解析:該電池的組成可以表示為(-)CH4—KOH—O2(+),第一步寫出該電池的總反應,CH4的燃燒反應為:CH4+2O2=CO2+2H2O,但注意生成的CO2要和電解質溶液KOH發生反應:CO2+2KOH=K2CO3+H2O,將上述兩方程式疊加,得到該燃料電池的總反應:CH4+2O2+2KOH= K2CO3+3H2O。第二步寫出O2在正極的反應,根據前面的介紹,可以寫出O2在堿性溶液KOH中的電極反應:O2+ 4e-+2H2O=4OH-。將正極反應和總反應中O2的計量數化為相同值,即為2O2+8e-+4H2O=8OH-。第三步湊出負極反應為:CH4-8e-+10OH-=CO32-+7H2O,即CH4在負極被氧化成CO2,在堿性溶液中轉變成CO32-和H2O。
二、固體氧化物電解質
固體氧化物電池是一種新型的燃料電池,電解質在熔融狀態下能傳導O2-,通常是摻雜氧化釔(Y2O3)的氧化鋯(ZrO2)晶體。負極通入燃料,正極通入空氣,正極反應為O2+4e-=2O2-,其電池組成可以表示為(-)燃料—ZrO2、Y2O3—O2(+)。
例3.一種新燃料電池,一極通入空氣,另一極通入丁烷氣體;電解質是摻雜氧化釔(Y2O3)的氧化鋯(ZrO2)晶體,在熔融狀態下能傳導O2-。下列對該燃料電池說法正確的是()
A.在熔融電解質中,O2-由負極移向正極
B.電池的總反應是:2C4H10+13O2→8CO2+10H2O
C.通入空氣的一極是正極,電極反應為:O2+4e-= 2O2-
D.通入丁烷的一極是正極,電極反應為:C4H10+26e-+13O2-=4CO2+5H2O
解析:該電池的組成為(-)C4H10—ZrO2、Y2O3—O2(+)。總反應為C4H10的燃燒反應:2 C4H10+13O2=8CO2+ 10H2O,正極反應為O2+4e-=2O2-,O2-為陰離子,在原電池裝置中向負極移動,將正極反應系數調整,得到13O2+ 52e-=由總反應和正極反應,湊出負極反應為2 C4H10-52e-+26O2-=8CO2+10H2O。本題應選BC。
三、熔融碳酸鹽電解質
熔融碳酸鹽電池的電解質通常為熔融K2CO3、Na2CO3等,其負極通入CO,正極通入的是空氣和CO2的混合氣體,O2先得電子后變成O2-,繼而O2-會與CO2結合成,因而正極反應方程式為O2+4e-+2CO2=,電池組成一般表示為(-)燃料|K2CO3|O2、CO2(+)。
例4.一種新型的熔融鹽燃料電池具有高發電效率而備受重視。現用Li2CO3和Na2CO3的熔融鹽混合物做電解質,一極通入CO氣體,另一極通入空氣與CO2的混合氣體,制得燃料電池。請回答:
(1)該電池工作時的負極反應式為:_________________;
(2)熔融鹽中?的物質的量在工作時_______(填“增大”、“減少”、“不變”)。
解析:該原電池的總反應為2CO+O2=2CO2,正極反應為O2+4e-+2CO2=,由此可得負極反應為2CO-4e-+=4CO2;根據電極反應方程式可見,負極消耗的和正極生成的的量是相等的,因而熔融鹽中的物質的量在工作時保持不變。
反饋練習:
1.[水性電解質(酸性、中性或堿性的溶液)]下圖是某筆記本電腦用甲醇質子交換膜燃料電池的結構示意圖。甲醇在催化劑作用下提供質子和電子,電子經外電路、質子經內電路到達另一極與氧氣反應,電池總反應為:則c電極是_______ (填“正極”或“負極”),c電極上發生的電極反應是______。
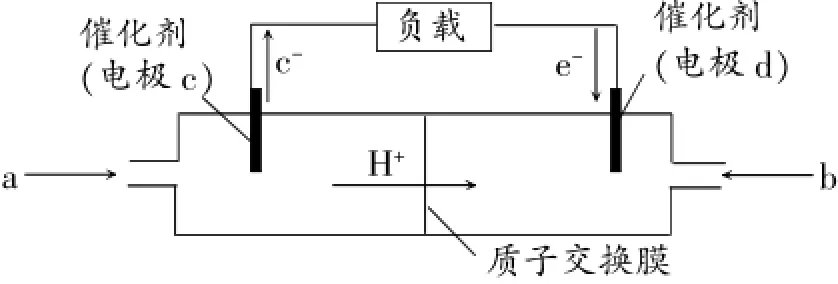
參考答案:負極;CH3OH-6e-+H2O=CO2+6H+
2.(固體氧化物電解質)固體氧化物燃料電池(SOFC)以固體氧化物作為電解質。其工作原理如下圖所示:下列關于固體燃料電池的有關說法正確的是()
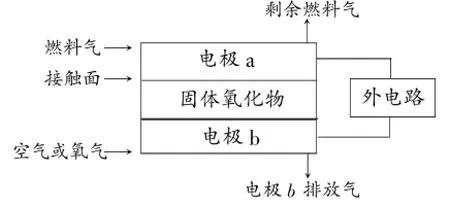
A.電極b為電池負極,電極反應式為O2+4e-=4O2-
B.固體氧化物的作用是讓電子在電池內通過
C.若H2作為燃料氣,則接觸面上發生的反應為
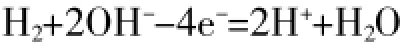
D.若C2H4作為燃料氣,則接觸面上發生的反應為C2H4+6O2--12e-=2CO2+2H2O
答案為D
3.(熔融碳酸鹽電解質)不久前,美國一個海軍航空站安裝了一臺250kW的MCFC型燃料電池,該電池可同時供應電和水蒸氣,其工作溫度為600℃~700℃,所用燃料為H2,電解質為熔解的K2CO3,已知該電池的總反應為:2H2+O2=2H2O,負極反應為:H2+-2e-=H2O+ CO2,則下列推斷中正確的是()
A.正極反應為4OH-=O2+2H2O+4e-
B.該電池的電極沒有參加反應
C.電池供應1mol水蒸氣,轉移的電子數4mol
D.O2從正極通入,發生氧化反應
答案:B
以上分別介紹了以水性、固體氧化物和熔融碳酸鹽作為電解質的燃料電池的書寫方法,概括起來說,燃料電池電極反應方程式的書寫有以下技巧:(1)結合燃料的燃燒方程式寫出總反應;(2)氧氣作為正極方程式的反應物,得電子,發生還原反應,再結合電解質(介質)寫出正極反應方程式;(3)根據總反應方程式和正極方程式可推出負極反應方程式;(4)注意燃料電池內部即電池的內電路,電流的方向(正電荷的移動方向)是負極指向正極。
1008-0546(2011)02-0077-02
G633.8
B
10.3969/j.issn.1008-0546.2011.02.037

