‘國慶1號'溫州蜜柑未發育胚珠再生完整植株的研究
蔡小東,駱 浩 (長江大學園藝園林學院,湖北荊州434025)
柑橘是我國南方重要的主栽果樹之一,通過生物技術進行柑橘的遺傳改良是一個切實可行的方法[1]。體細胞胚狀體 (體胚)發生是植物體細胞離體培養的重要途徑之一。許多植物器官、愈傷組織及原生質體等培養過程中,體胚能否再生關系到完整植株再生的成敗[2-3]。現代生物技術育種已被廣泛應用于作物遺傳及品質改良,如轉基因技術、體細胞融合技術等一般都需要通過體胚再生途徑獲得完整植株[4-5]。本研究以 ‘國慶1號'溫州蜜柑 (Citrus unshiu Marc.cv.Guoqing No.1)成熟果實中未發育胚珠為外植體,研究不同種類的植物生長調節劑對 ‘國慶1號'植株再生的影響,以期為直接以未發育胚珠為起始材料進行柑橘生物技術育種奠定基礎。
1 材料與方法
1.1 材料
供試材料為 ‘國慶1號'溫州蜜柑 (Citrus unshiu Marc.cv.Guoqing No.1)成熟果實。在超凈工作臺上將果實浸泡在75%酒精中約10min后,用鑷子取出并用酒精燈外焰灼燒30~60s。接著將果實放入已滅菌的培養皿 (內放有多張濾紙)中剝開果皮,去掉果肉后可發現囊衣內緊靠中柱處有許多長約1~2mm未發育胚珠,用尖嘴鑷子將這些未發育胚珠輕輕挑下備用。
1.2 胚狀體誘導
將上述未發育胚珠分別接種于下述培養基A(MT+500mg·L-1麥芽浸出物 (ME))、B(MT+1.0mg·L-1GA3+500mg·L-1ME)、C(MT+2.0mg·L-1BA+0.5mg·L-1IAA)和D(MT+1.0mg·L-1KT+500mg·L-1ME)上。
所有培養基均添加30g·L-1蔗糖及7.5g·L-1瓊脂,pH5.8,暗培養。每種處理接種5瓶,每瓶放置3~5個胚狀體。
1.3 胚狀體誘導生芽
將獲得的胚狀體接種到培養基E(M T+2.0mg·L-1BA+0.5mg·L-1IAA)上。接種5瓶,每瓶接種5個胚狀體,培養后統計出芽的時間、快慢、質量及數量等。
1.4 再生芽誘導生根
將再生芽切下,置于誘導生根培養基上 F(MT+0.5mg·L-1NAA+0.1mg·L-1IBA+0.5g·L-1活性碳+20g·L-1蔗糖+7.2g·L-1瓊脂)和G(1/2MT+0.5mg·L-1NAA+0.1mg·L-1IBA+0.5g·L-1活性碳+20g·L-1蔗糖+7.2g·L-1瓊脂)上。每種處理接種5瓶,每瓶接種3個芽,比較再生根的時間及根的質量。
2 結果與分析
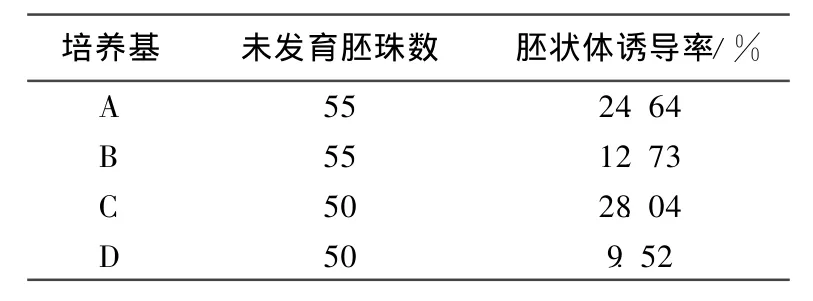
表1 ‘國慶1號'成熟果實中未發育胚珠在不同培養基上胚狀體的誘導率
2.1 未發育胚珠的胚狀體誘導
將 ‘國慶1號'溫州蜜柑成熟果實中未發育胚珠接種于A~D 4種培養基中,結果表明,在暗培養60d后,4種供試培養基都能誘導胚狀體的再生,誘導率如表1所示。柑橘體細胞胚狀體的發育過程一般與合子胚一樣,具有經過原胚、心形胚、魚雷形胚及至具子葉的成熟胚的發育程序。在培養基A和C中既有球形胚狀體的產生,也出現了子葉形胚狀體。在這4種培養基中,培養基A中胚狀體的誘導率為24.64%,培養基D中胚狀體誘導率高達28%。此外,在誘導胚狀體的過程中,未發現有胚性愈傷組織的出現。這些胚狀體繼續在原培養基上培養30d后,有次生胚狀體發生,大部分表現畸形 (圖1(a)和 (b))。圖1(a)所示為培養基A中再生的胚狀體,且再生了次生胚狀體,由于暗培養呈淡黃色同時還伴有白色子葉型胚狀體。
2.2 胚狀體誘導生芽
胚狀體在生芽培養基上培養15d后,如圖1(c)所示,胚狀體開始膨大變綠,有次生胚狀體的產生,培養30d后胚狀體體積明顯增大。少數胚狀體萌發形狀不規則的小芽。通過45d的光照培養,胚狀體再生了不定芽 (圖1(d))。不定芽的葉片不規則,個別部位有黃化現象。生長出來的芽后期生長速度加快,形成植株的莖葉形態。
2.3 再生芽誘導生根
挑選部分較為健壯的芽進行根的誘導,以獲得 ‘國慶1號'的完整植株。在培養30d后培養基J的生根數量明顯多于培養基K,K培養基同樣也能夠使再生芽誘導生成不定根,但是較培養基J的根細,側根較少 (表2)。培養基J中不定芽葉片大且綠,培養基 K的葉片生長勢葉片較黃(圖1(e)和 (f))。由此可見,J培養基更加有利于根的誘導。
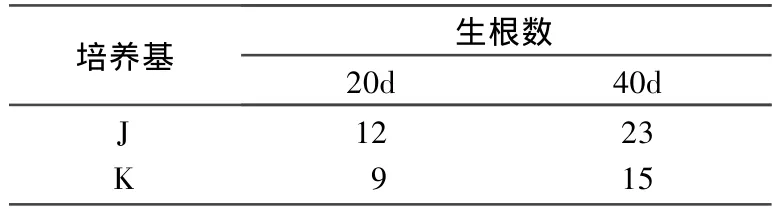
表2 ‘國慶1號'溫州蜜柑胚狀體誘導生根
3 討論
一般而言,柑橘成熟果實中未發育胚珠經誘導能產生大量的胚性愈傷組織[3,6-8]。本研究以 ‘國慶1號'溫州蜜柑成熟果實中未發育胚珠為外植體,研究了不同種類的植物生長調節劑對 ‘國慶1號'植株再生的影響,結果發現很難獲得愈傷組織,即使再生了愈傷組織也極易玻璃化。以成熟果實未發育胚珠為外植體,直接進行植株再生,具有操作簡單易行、容易再生植株等優點。并且愈傷組織的遺傳生理功能可能具有胚性,或是喪失胚性,具有胚性的愈傷組織才具有較強的再分化能力,可以再生植株,是各種生物技術操作的理想材料。此外,愈傷組織隨著繼代次數的增加和保存時間的延長,其胚胎發生能力會下降,并且存在變異[9-12]。外植體脫分化為愈傷組織,抑或再分化為體細胞胚胎,終歸是在各種因素的誘導下基因時空差異表達的結果。深入研究離體培養下植物細胞脫分化及再分化的分子機制,將為促進利用生物技術創造新新種質和遺傳改良奠定基礎,具有重要意義。
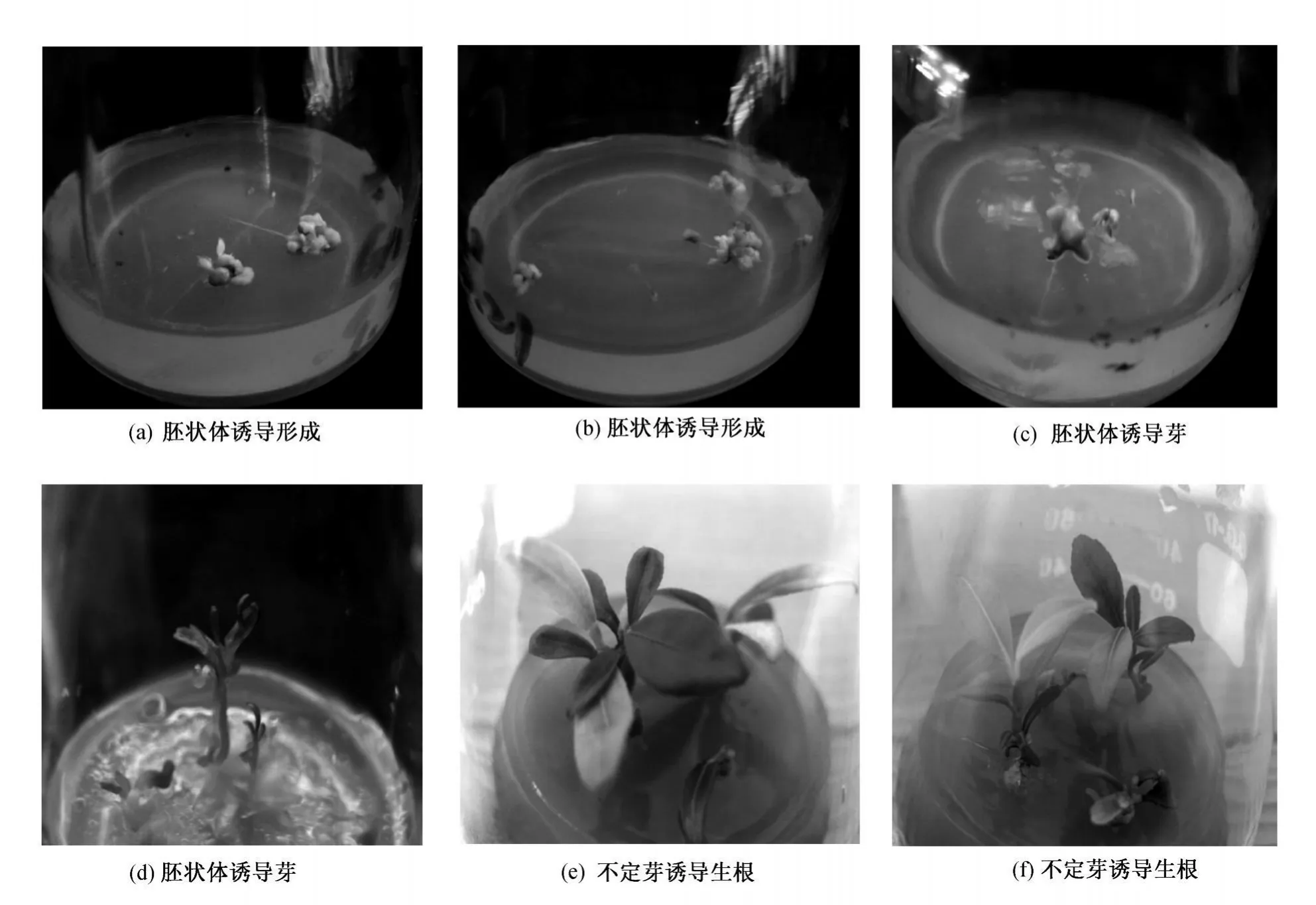
圖1 ‘國慶1號'未發育胚珠再生植株
[1]Cai X D,Fu J,Deng X X,et al.Production and molecular characterization of potential seedless cybrid plants between pollen sterile Satsuma mandarin and two seedy Citrus cultivars[J].Plant Cell Tiss Org Cult,2007,90:275-283.
[2]von Arnold S,Sabala I,Bozhkov P,et al.Developmental pathways of somatic embryogenesis[J].Plant Cell Tiss O rg Cult,2002,69:233-249.
[3]蔡小東,廖 偉.冰糖橙胚狀體、胚性愈傷組織的誘導及植株再生[J].長江大學學報(自科版)農學卷,2010,7(1):56-59.
[4]Grosser J W,Ollitrault P,Olivares-Fuster O.Somatic hybridization in Citrus:An effective tool to facilitate variety improvement[J].In vitro Cell Dev Biol-Plant,2000,36:434-449.
[5]Cai X D,Fu J,Chen C L,et al.Cybrid/hybrid plants regenerated from somatic fusions between male sterile Satsuma mandarin and seedy tangelos[J].Sci Hortic,2009,122:323-327.
[6]霍合強,鄧秀新.寬皮柑橘品種的胚性愈傷組織誘導[J].實驗生物學報,1999,32(3):289-295.
[7]范永梅,甘 霖,鄧秀新.冰糖橙胚性愈傷組織的誘導與植株再生[J].華中農業大學學報,2003,22(4):399-402.
[8]張秀枝.紅江橙與檸檬愈傷組織誘導的研究 [J].廣西農業科學,2008,39(1):6-11.
[9]霍合強,鄧秀新.柑桔胚性愈傷組織的誘導、保存和利用 [J].植物生理學通訊,2000,36(2)181-187.
[10]張俊娥,鄧秀新.柑橘愈傷組織植株再生及其倍性鑒定[J].華中農業大學學報,2007,26(2):237-238.
[11]Bao Y,Dharmawardhana P,Mockler T,et al.Genome scale transcriptome analysis of shoot organogenesis in Populus[J].BMC Plant Biol,2009,9:132.
[12]Che P,Lall S,Nettleton D,et al.Gene expression programs during shoot,root,and callus development in Arabidopsis tissue culture[J].Plant Physiol,2006,141:620-637.

